
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок выполнения работы. Расчет расхода окислителя и выход продуктов полного сгорания газообразного топлива.
Расчет расхода окислителя и выход продуктов полного сгорания газообразного топлива.
Объем кислорода, необходимого для сгорания газообразного топлива и образующихся продуктов сгорания, подсчитывают на основе уравнения горения компонентов, входящих в состав газообразного топлива
Окись углерода 
Водород 
Метан 
Этан 
Пропан 
Бутан 
Пентан 
В соответствии с приведенными выше уравнениями горения компонентов газового топлива объем кислорода, необходимого для сгорания 1м3 газа, подсчитывают по формуле, м3/м3 газа

Объем воздуха  , необходимый для сгорания 1м3 газового топлива в стехиометрических условиях, подсчитывают исходя из содержания в воздухе 21% кислорода по объему, м3/м3 газа
, необходимый для сгорания 1м3 газового топлива в стехиометрических условиях, подсчитывают исходя из содержания в воздухе 21% кислорода по объему, м3/м3 газа
 .
.
Действительное количество воздуха, подаваемое в топку, м3/м3 газа:
 ,
,
где  - коэффициент избытка воздуха.
- коэффициент избытка воздуха.
Суммарный объем продуктов полного сгорания  , состоящий из следующих компонентов, м3/м3 газа
, состоящий из следующих компонентов, м3/м3 газа
 ,
,
Объем продуктов сгорания за вычетом объема водяных паров называется объемом сухих газов:
 ,
,
Выход двуокиси углерода, м3/м3 газа

Выход азота складывается из воздуха, подаваемого в топку, и азота, содержащегося в газовом топливе, м3/м3 газа
 ,
,
Выход водяных паров определяется с учетом содержания водорода и влаги в топливе – d м3/м3 газа и водяных паров, содержащихся в воздухе, используемом в качестве окислителя. Содержание в воздухе водяных паров принимают около 1 мас. % (1,6 об. %), так как влагосодержание воздуха dв=10…16 г/м3 сухого воздуха при относительной влажности φ=50…60% и температуре t=20…30°С.
Выход водяных паров при сжигании газового топлива, м3/м3 газа:

Количество кислорода в продуктах сгорания, м3/м3 газа
 .
.
Расчет расхода окислителя и выхода продуктов полного сгорания твердого и жидкого топлива.
Количество кислорода воздуха Ов, необходимое для полного сгорания 1 кг топлива, кг/кг
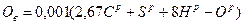 ,
,
где  - соответственно содержание углерода, горючей серы, водорода и кислорода в рабочей массе топлива, масс. %.
- соответственно содержание углерода, горючей серы, водорода и кислорода в рабочей массе топлива, масс. %.
Количество сухого воздуха  , необходимое для сгорания 1 кг топлива (принимая содержание в воздухе 23 мас. % кислорода), кг/кг
, необходимое для сгорания 1 кг топлива (принимая содержание в воздухе 23 мас. % кислорода), кг/кг
 ,
,
Объем воздуха, теоретически необходимый для сгорания 1 кг топлива, равен  , т.е. м3/кг
, т.е. м3/кг
 ,
,
или округленно, м3/кг
 ,
,
Суммарный объем продуктов сгорания
 ,
,
Объем двуокиси углерода, м3/кг
 ,
,
Объем двуокиси серы, м3/кг
 ,
,
Объем азота, м3/кг

Объем водяного пара в продуктах сгорания с учетом содержания в воздухе около 1 мас. % влаги (1,6 об. %), м3/кг
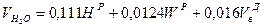 .
.
Объем кислорода, м3/кг
 .
.
Для теплотехнических расчетов топок, теплогенераторов и других теплотехнологических установок необходимо знать энтальпию и влагосодержание продуктов сгорания топлива.
Энтальпия влажных топочных газов, отнесенная к массе сухих газов, кДж/кг

где 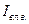 - энтальпия влажного воздуха, определенная по формуле, кДж/кг
- энтальпия влажного воздуха, определенная по формуле, кДж/кг
 .
.
Масса сухих газов, кг
 ,
,
где  ,
,  ,
,  - плотности двуокиси углерода, азота и кислорода соответственно, кг/м3.
- плотности двуокиси углерода, азота и кислорода соответственно, кг/м3.
Влагосодержание топочных газов, отнесенное к массе сухих газов, кг/кг
 ,
,
где  ,
,  - массы водяных паров и сухих газов соответственно.
- массы водяных паров и сухих газов соответственно.
Контрольные вопросы
- Что называется топливом?
- Что называется теплотворной способностью топлива?
- чем отличается высшая теплота сгорания от низшей?
- Что называется условным топливом и для чего ввели данное понятие?
- Что называется балластом топлива и как он влияет на теплотворную способность топлива?
- Что называется коэффициентом избытка воздуха и как он влияет на эффективность использования топлива?
- Какие составляющие элементы топлива обуславливают его теплотворную способность?
- Расскажите о стадиях горения твердого топлива.
- Особенности горения жидкого топлива.
Дата добавления: 2015-04-16; просмотров: 232; Мы поможем в написании вашей работы!; Нарушение авторских прав |