
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ И КОНЦЕНТРАЦИИ ИОНОВ В РАСТВОРЕ МЕТОДОМ ИЗМЕРЕНИЯ ЭЛЕКТРОДВИЖУЩИХ СИЛ
Учебное пособие
для бакалавров и специалистов очной формы обучения специальностей 120401, 120700, 270100, 270300, 270800, 271101
МонастырскаяИрина Александровна
Подписано в печать 01.04.13. Формат 60 84/16. Усл. печ. л.14.Уч.-изд. л.
Тираж экз. Заказ Цена
Отпечатано в Белгородском государственном технологическом
университете им. В.Г.Шухова
308012,г. Белгород, ул. Костюкова 46.
[1] Деизм – учение, допускающее существование бога лишь как первопричины мира и отрицающее его последующее вмешательство в жизнь природы и человека.
[2] Периодизация русской философии дается по изданию В.В.Зеньковского. История русской философии. – Л.:Эго,1991 – Т.1.- Ч.1.
[3] Например, срок жизни: в 1967 году в Канаде одиннадцатилетний мальчик Рики Галант умер от старости, обусловленной заболеванием протогерией.
[4] См.: Глава 3. Онтология данного издания, как пример для заполнения таблицы.
[5] См.: самостоятельная работа «Типы и формы отражения» данного издания.
[6] Фромм Э. Психоанализ и религия / Ф.Ницше, З.Фрейд и др. Сумерки богов. – М.: Изд-во Политлитературы, 1989. – С.143-221.
[7] Однако при этом преступно считать нормальным явлением вымирание населения России по 0, 8 млн. человек в год, причины чего лежат в просчетах социально-экономической политики государства.
[8] Например, за последние 20 лет потребление нефти возросло в 4 раза, природного газа – в 5 раз, бокситов – в 9 раз, каменного угля – в 2 раза.
И.Б.Немировская, В.Т.Семко, Т.А.Фёдорова
УЧЕБНОЕ ПОСОБИЕ ПО КУРСУ
ФИЗИЧЕСКОЙ И КОЛЛОИДНОЙ ХИМИИ
(с лабораторным практикумом)
Москва 2007
УДК 541.1 (075)
ББК [24.5+24.6]я7
У - 91
Т.В.Шнее, С.Э.Старых, М.Ж.Будажапова, И.Б.Немировская, В.Т.Семко, Т.А.Фёдорова
Учебное пособие по физической и коллоидной химии (с лабораторным практикумом)
Одобрено методической комиссией факультета агрохимии, почвоведения и экологии. Протокол № 16/06 от 18 июня 2007 г.
Учебное пособие по физической и коллоидной химии предназначен для студентов сельскохозяйственных вузов по агрономическим, агропедагогическим и другим специальностям очной, очно-заочной и заочной форм обучения. Процессы и законы физической и коллоидной химии рассматриваются на примерах и при использовании биологических и сельскохозяйственных объектов, что облегчает осознание предмета и осмысление процессов, рассматриваемых на специальных дисциплинах.
ОГЛАВЛЕНИЕ
1. Определение электродных потенциалов и концентрации ионов в растворе методом измерения электродвижущих сил................................................................... 5
2. Буферные системы. Изучение свойств буферных и небуферных систем.Определение буферной емкости раствора.Определение рН потенциометрическим методом в биологических объектах............................................................................... 19
3.Электрическая проводимость и ее использование для анализа растворов электролитов......................................................................................................................... 35
4.Термохимия. Закон Гесса. Определение тепловых эффектов химических реакций, теплотворной способности кормов. Определение энтропии реакции...... 54
5.Поверхностные явления и адсорбция....................................................... 73
6. Коллоидные системы, их образование и свойства................................ 100
7.Коагуляция лиофобных и лиофильных коллоидных растворов........... 118
8. Растворы высокомолекулярных соединений. Определение ИЭТ гидрофильного золя вискозиметрическим методом..................................................................... 132
Словарь терминов....................................................................................... 150
Список литературы..................................................................................... 165
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ И КОНЦЕНТРАЦИИ ИОНОВ В РАСТВОРЕ МЕТОДОМ ИЗМЕРЕНИЯ ЭЛЕКТРОДВИЖУЩИХ СИЛ
В агрохимии, физиологии растений и в почвоведении знание современных методов измерения электродвижущих сил имеет большое значение. Эти методы дают возможность быстро и точно определить кислотность почв и концентрацию водородных ионов в клеточном соке живых организмов. Окислительно-восстановительные и мембранные потенциалы также наиболее надежно определяются измерением электродвижущих сил соответствующих почвенных или физиологических объектов.
При соприкосновении двух различных фаз, содержащих электрически заряженные частицы (например, электроны в металлах или ионы в растворах), способные переходить из одной фазы в другую, возникает равновесие, при котором обе фазы заряжаются противоположными знаками электричества и между ними возникает разность потенциалов:
Е = e1 - e2 ,
где Е – электродвижущая сила (ЭДС); e1 и e2 - потенциалы.
Гальваническим элементом или гальванической цепью называется прибор, в котором энергия химической реакции преобразуется в электрическую. Он состоит из обратимых или необратимых электродов, соединенных электролитическим проводником. Элемент называется необратимым, если в системе хотя бы один из процессов является термодинамически необратимым. Обратимый электрод – это металл, находящийся в контакте с раствором, содержащем те же ионы, что и металл. Обратимый электрод схематически записывается M|Mx+, где М – металл, Мх+ - ионы этого металла, содержащиеся в растворе.
Мы изучаем только обратимые электроды, поэтому в дальнейшем слово “обратимый” опускается.
При погружении металлической пластинки в водный раствор ионов того же металла на границе раздела фаз возникает двойной электрический слой, обусловленный конкуренцией двух процессов:
а) растворение металла, характеризуемое работой, затрачиваемой на вырывание протонов из кристаллической решетки металла и перевода их в раствор;
б) наращивание массы металла, определяемое работой по разрушению гидратной оболочки ионов и осаждению их на металле.
Если энергия гидратации больше энергии электронно-ионной связи металла, то ионы выходят из металла в раствор, пластинка заряжается отрицательно, а близлежащий слой раствора – положительно.
Если энергия гидратации меньше энергии электронно-ионной связи металла, то ионы осаждаются на пластинке, она заряжается положительно, а близлежащий слой раствора – отрицательно.
Двойной электрический слой, возникающий на границе металл-раствор, определяет появление равновесного потенциала, величина которого зависит от концентрации ионов металла в электродном растворе и природы (свойств) металла. Такой потенциал называется электродным и определяется уравнением Нернста:
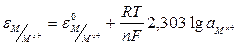 ,
,
где e («эпсилон») - электродный потенциал, В;
e0 – стандартный (нормальный) потенциал, В;
R – универсальная газовая постоянная – 8,31 Дж/моль К;
Т – абсолютная температура, ºК;
F - число Фарадея – 96500 Кл/моль;
n – валентность ионов металла;
2,303 – модуль перехода от натурального логарифма к десятичному;
 - активность ионов металла в растворе.
- активность ионов металла в растворе.
Активность ионов связана с концентрацией раствора, и эта связь выражается уравнением

где  - активность, С – молярная концентрация раствора и
- активность, С – молярная концентрация раствора и  - коэффициент активности, учитывающий электростатическое взаимодействие ионов в растворе.
- коэффициент активности, учитывающий электростатическое взаимодействие ионов в растворе.
Стандартным (нормальным) электродным потенциалом называется потенциал, возникающий на электроде в нормальных условиях (Р = 101,3кПа = 1атм; Т = 298ºК) при активности ионов в электродном растворе, равной 1 г-ион/л. Величины нормальных (стандартных) электродных потенциалов находятся экспериментальным путем относительно водородного электрода, причем нормальный потенциал водородного электрода условно принимается равным нулю. Таблица нормальных потенциалов называется рядом напряжений. В таблице 1 приведены стандартные потенциалы некоторых электродов.
Таблица 1
Нормальные потенциалы некоторых электродов при 298K
(ряд напряжений)
| Электрод | Электродный процесс | e, В |
| Zn|Zn2+ | Zn Û Zn2++ 2e- | -0,76 |
| Fe|Fe2+ | Fe Û Fe2+ + 2e- | -0,44 |
| Cd|Cd2+ | Cd Û Cd2+ + 2e- | -0,40 |
| Fe|Fe3+ | Fe Û Fe3+ + 3e- | -0,04 |
| Pt(H2)|H+ | ½ H2 Û H+ + e- | 0,00 |
| Cu|Cu2+ | Cu Û Cu2+ + 2e- | +0,34 |
| Hg|Hg2+ | Hg Û Hg2+ + 2e- | +0,80 |
Если гальванические цепи составляются из качественно различных электродов с различными активностями ионов, они называются химическими и схематически записываются так:
M1|  |электролитический|
|электролитический|  |M2
|M2
e1 проводник e2
где а1 и а2 – активности ионов в растворе.
Электролитический проводник включают для устранения диффузионного потенциала, который возникает на границе электродных электролитов, либо за счет различной подвижности ионов, либо за счет разницы концентраций. При этом электролитический проводник должен удовлетворять следующим требованиям:
1. электролит должен быть сильным;
2. концентрация электролита должна быть высокой;
3. электролитические подвижности ионов должны иметь близкие значения ( 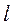 катиона =
катиона = 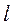 аниона);
аниона);
4. электролит не должен образовывать труднорастворимое соединение с электродными растворами.
ЭДС химических гальванических цепей равна разности электродных потенциалов e1 и e2:
Е = e1 - e2,
Гальванические цепи из одинаковых электродов, но с различной активностью ионов называются концентрационными и записываются так:
M| 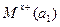 |электролитический|
|электролитический|  |M
|M
e1 проводник e2
При этом а1 > а2
Гальванические цепи, в состав которых входят окислительно-восстановительный электрод и электрод с известным потенциалом (электрод сравнения), называются окислительно-восстановительными. Окислительно-восстановительный электрод состоит из пластинки индифферентного металла (платина или золото), находящегося в контакте с раствором, содержащий ионы одного и того же металла, но разной валентности, или с веществами различной степени окисления.
Схематически такие цепи записываются:
Pt| Mx+,My+ || электрод с известным потенциалом
(электрод сравнения)
Например: Pt|Fe2+,Fe3+ || KClнасыщ, AgCl|Ag
Величина окислительно-восстановительного потенциала рассчитывается по уравнению Нернста - Петерса:
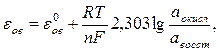
где  - нормальный (стандартный) окислительно-восстановительный потенциал, аокисл - активность окисленной формы, авосст - активность восстановленной формы.
- нормальный (стандартный) окислительно-восстановительный потенциал, аокисл - активность окисленной формы, авосст - активность восстановленной формы.
Стандартным (нормальным) окислительно-восстановительным потенциалом называется потенциал, возникающий в стандартных условиях на индифферентном электроде при соотношении 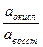 , равном 1. В таблице 2 приведены некоторые стандартные окислительно-восстановительные потенциалы.
, равном 1. В таблице 2 приведены некоторые стандартные окислительно-восстановительные потенциалы.
Таблица 2
Стандартные окислительно-восстановительные потенциалы
в водных растворах
| Электрод | Электродный Процесс | e, В |
| Cr2+|Cr3+|Pt | Cr3++ e- Û Cr2+ | -0,41 |
| Sn2+|Sn4+|Pt | Sn4++ 2e- Û Sn2+ | +0,15 |
| MnO4-,MnO2-|Pt | MnO4-+ e- Û MnO42- | +0,564 |
| Fe2+|Fe3+|Pt | Fe3+ + e- Û Fe2+ | +0,771 |
| Mn2+,Mn3+|Pt | Mn3++ e- Û Mn2+ | +1,51 |
| Pb4+|Pb2+|Pt | Pb4++ 2e- Û Pb2+ | +1,70 |
| Co2+,Co3+|Pt | Co3++ e- Û Co2+ | +1,82 |
Почвы представляют собой окислительно-восстановительные системы, т.к. они содержат ионы различной валентности, например, Fe2+/Fe3+ , Mn2+/Mn3+, N+5/N+3, а также органические вещества различной степени окисления.
Для практического определения неизвестных электродных потенциалов используются электроды сравнения. К ним относятся такие электроды, которые при данных условиях имеют известную величину электродного потенциала. В качестве электродов сравнения на практике чаще всего используется хлорсеребряный электрод (рис.1), который схематически записывается следующим образом:
Ag| AgCl, KClнасыщ
и потенциал которого описывается уравнением

eхс = 0,203 В при 250С.
 К электродам сравнения относятся также водородный электрод – Pt,H2 | 2H+, eH+ = 0 В при аН+=1моль/литр и каломельный – Hg|Hg2Cl2, КClнасыщ , eк = 0,25 В.
К электродам сравнения относятся также водородный электрод – Pt,H2 | 2H+, eH+ = 0 В при аН+=1моль/литр и каломельный – Hg|Hg2Cl2, КClнасыщ , eк = 0,25 В.
1. Корпус;
2. Асбестовая нить;
3. Раствор KCl;
4. Отверстия для заливки раствора хлористого калия;
5. Резиновая пробка;
6. Серебряная проволока;
7. Хлористое серебро;
8. Асбестовый фитиль.
Рис.1. Хлорсеребряный электрод
Дата добавления: 2014-11-13; просмотров: 614; Мы поможем в написании вашей работы!; Нарушение авторских прав |