
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электролиз водных растворов электролитов
При рассмотрении электролиза водных растворов необходимо
помнить, что кроме ионов электролита во всяком водном растворе есть еще
ионы Н+ и ОН- - продукты диссоциации воды. В электрическом поле ионы Н+
перемещаются к катоду, а ионы ОН- к аноду. Таким образом, у катода могут
разряжаться как катионы электролита, так и катионы водорода. У анода
может происходить разряд как анионов электролита, так и гидроксид –
ионов. Кроме того, молекулы воды также могут подвергаться
электрохимическому окислению или восстановлению. Из нескольких
возможных процессов будет протекать тот, осуществление которого
сопряжено с минимальными затратами энергии.
Рассмотрим последовательность разряда ионов при электролизе
водных растворов электролитов.
Катодные процессы. Перенапряжение .
На катоде протекает реакция восстановления, т.е. прием электронов окислителем, поэтому на катоде в первую очередь должны реагировать наиболее сильные окислители, которым отвечает наибольшее значение положительного потенциала.
Однако указанная последовательность разряда ионов часто нарушается
из – за перенапряжения.
Катодное перенапряжение – это дополнительное напряжение,
прикладываемое к катоду (при этом потенциал катода смещается далее в
отрицательную сторону), а анодное – к аноду (при этом потенциал анода
смещается в положительную сторону), необходимое для проведения процесса с заданной скоростью. Перенапряжение всегда вызывается затруднениями при протекании электродного процесса. Наиболее значительно катодное перенапряжение восстановления ионов водорода и
анодное перенапряжение окисления гидроксид – ионов.
Для катодного восстановления при электролизе водного раствора
электролита, с учетом перенапряжения, все окислители можно разделить на три группы:
1) Ионы металлов, потенциал которых существенно более
отрицателен, чем потенциал водородного электрода, т.е.:

В водных растворах разряд этих ионов на катоде практически не
происходит, т.к. на катоде выделяется водород:
2Н+ +2е- → Н2↑ при рН < 7
2Н2О +2е- → Н2↑ + 2ОН- при рН ≥ 7.
Металлы, имеющие такой отрицательный потенциал
(  ), могут быть получены только электролизом их расплавленных солей, в которых ионы Н+ отсутствуют.
), могут быть получены только электролизом их расплавленных солей, в которых ионы Н+ отсутствуют.
2) Ионы металлов, потенциал которых более положителен, чем
потенциал водородного электрода. К ним относятся катионы Cu2+, Ag+, Hg2+, Au3+, ионы платиновых металлов. При наличии этих ионов в растворе на катоде они разряжаются в первую очередь, и разряд ионов Н+ не
происходит.
3) Ионы, потенциал которых относительно мало отличается от потенциала водородного электрода. К ним относятся ионы Sn2+, Pb2+, Ni2+,
Co2+, Zn2+, Cd2+ и других металлов, находящихся в ряду напряжения между алюминием и водородом. Преимущественным процессом в этом случае будет
разряд ионов металлов:
Меn+ +nе- → Ме0,
но часть электричества будет расходоваться на выделение водорода:
2Н2О +2е- → Н2↑ + 2ОН-.
Анодные процессы
На аноде протекают реакции окисления восстановителей, т.е. отдача электронов восстановителем, поэтому в первую очередь на аноде должны реагировать наиболее сильные восстановители – вещества, имеющие отрицательный потенциал.
На аноде при электролизе водных растворов может протекать
несколько процессов:
1) растворение металла:
Ме0 –nе- → Меn+
2) окисление ОН- - ионов или воды:
4ОН- –4е- → О2 + 2Н2О при рН > 7
2Н2О –4е- → О2 + 4Н+ при рН ≤ 7
3) окисление других веществ, присутствующих в растворе или около электрода:
Red –nе- → Ox
где Ox и Red – окисленная и восстановленная форма вещества соответственно.
Если потенциал металлического анода имеет более отрицательное
значение, чем потенциал окисления ионов ОН- или других веществ,
присутствующих в растворе, то происходит растворение металла. При этом
протекает электролиз с растворимым анодом. Из-за высокого перенапряжения выделения кислорода многие металлические аноды становятся неустойчивыми и растворяются (вплоть до Ag).
По активности к окислению на аноде отрицательные ионы могут быть
расположены в следующий ряд:
I-, Вr-, Сl-, S2-, ОН-, SO42-, NO3-, СlO4-
(Н2О)
При электролизе водных растворов соединений, которые содержат
кислородсодержащие ионы, вместо последних на аноде разряжаются гидроксид – ионы или молекулы воды.
Связь между количеством выделившегося при электролизе вещества и
количеством прошедшего через электролит электричества выражается
законами Фарадея.
1 закон Фарадея: массы веществ, выделившиеся на электродах при
электролизе, прямо пропорциональны количеству электричества,
прошедшего через электролит, т.е.
m = k · I · τ, (4.1)
где m – масса вещества, образовавшегося на электроде или у электрода, г;
k – электрохимический эквивалент вещества;  ;
;
I – сила тока, А;
τ – время электролиза, с (ч);
F = 96487 Кл или F = 26,8 А/ч;
Мэ(В) – эквивалентная масса вещества.
2 закон Фарадея (закон эквивалентов для электрохимических реакций): одинаковые количества электричества выделяют на электродах
при электролизе эквивалентные массы различных веществ:
 (4.2)
(4.2)
или
 (4.3)
(4.3)
Отношение количества электричества (q), необходимого для выделения
данной массы вещества, ко всему количеству прошедшего через электролит
электричества (Q), называется выходом по току данного вещества и обычно
выражается в процентах:
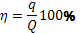 или 100%
или 100%
Напряжение Uэл, которое необходимо подвести к электролизеру, состоит из: напряжения разложения Eр (разность потенциалов анодной и катодной реакций); суммы анодного и катодного перенапряжений Еп; падения напряжения в электролите Uэ=IRвн (Rвн— сопротивление электролита); падения напряжения в шинах, контактах, электродах Uc—I(Rш +RK+Rэ). Получаем:
Uэл = EP + En + Uэ + Uc, (4.4)
Мощность, потребляемая при электролизе, равна:
Рэл = IUэл = I(Ер+Еп + Uэ + Uс). (4.5)
Из этой мощности только первая составляющая расходуется на проведение реакций, остальные являются тепловыми потерями процесса. Лишь при электролизе расплавленных солей часть теплоты, выделяющейся в электролите IUэл, используется полезно, так как расходуется на расплавление загружаемых в электролизер солей.
Эффективность работы электролизной ванны, может быть оценена массой вещества в граммах, выделяемого на 1 Дж затраченной электроэнергии. Эта величина носит название выхода вещества по энергии; ее можно найти по выражению
; (4.6)
здесь α — электрохимический эквивалент вещества, г/Кл; η1—выход по току; Uэл — напряжение на электролизере, В.
Электролиз водных растворов металлов в металлургии
Электролиз водных растворов металлов осуществляется как для их получения (электроэкстракция), так и для их электролитического рафинирования.
Производство цинка. Цинк применяется для производства сплавов (например, латуни), для покрытия изделий из железа защитным слоем, для производства белил. Основным сырьем для производства цинка служат в основном сульфидные руды, в которых главным цинк-содержащим минералом является цинковая обманка ZnS.
Производство цинка из сульфидного концентрата осуществляется пирометаллургическим или гидрометаллургическим методом. В России большее развитие получил второй способ, при котором концентрат подвергают окислительному обжигу, затем выщелачивают серной кислотой. Таким образом, электролитом служит водный раствор, содержащий 5—6% сернокислого цинка ZnS04 с добавлением 10—12% H2SO4, повышающей проводимость электролита.
Электролиз цинка проводят в прямоугольных электролизерах длиной 2—3 м, шириной 0,8—1,1 м и глубиной 1,0—1,5 м, выполненных из железобетона или дерева. Они устанавливаются в цехе на столбах и изолированы от земли фарфоровыми или стеклянными изоляторами. Наружные поверхности электролизеров защищены кислотоупорным лаком, внутри они покрыты винипластом или свинцом. Сверху в электролизер опускают 15—30 свинцовых анодов прямоугольной формы размерами 1000X600 мм, толщиной 5—10 мм. В верхнюю часть анода залита медная штанга, одним концом она опирается на идущую вдоль электролизера анодную шину, а другим — на деревянную изолированную планку у второй стороны электролизера (рис. 4.2.). Срок службы свинцовых анодов 1,5—2,0 года.
Катоды помещаются между анодами; расстояние между соседними электродами 30—40 мм. Катоды изготавливаются из алюминиевого листа толщиной 4—8 мм, их размеры чуть больше размеров анодов. Верхней частью катоды подвешиваются на крючках к штанге, одним концом лежащей на катодной шине, а другим—.на деревянной планке. Цинк наращивают на катоде в течение 40—50 ч, после чего его сдирают с катода и отправляют на переплавку. В процессе электролиза электролит непрерывно циркулирует через электролизеры и очистительную установку. Процесс ведется при 35—40° С, в ваннах имеются змеевики из свинцовых труб с охлаждающей водой. Плотность тока на электродах достигает 400— 600 А/м2; при этих плотностях
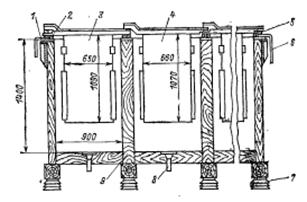
Рис. 4.2. Блок деревянных ванн для электролиза цинка.
1 – катодный токопровод; 2 – катодная шина; 3 – катод; 4 – анод; 5 – анодная шина;
6 – анодный токопровод; 7 – изолятор; 8 – сливной патрубок; 9 – корпус ванны.
тока перенапряжения при выделении катионов водорода на катоде достигают —1,1 В, благодаря чему и оказывается возможным осаждение цинка,
имеющего нормальный электродный потенциал — 0,76 В.
Выход по току составляет 88—94%, напряжение на ванне равно 3,5—4,5 В (все электроды включены параллельно). Ванны включаются в серию последовательно; ток ванны составляет 7000—12 000 А, напряжение серии ванн 350—450 В.
Удельный расход электроэнергии приблизительно равен 3500 кВт-ч/т цинка.
В последнее время ведутся работы по осуществлению непрерывного процесса электролиза цинка. При этом катод выполняется в виде вращающегося барабана, наполовину опущенного в электролитическую ванну в форме полуцилиндра с выстилающим его свинцовым электродом, или в виде ленты, движущейся вдоль электролизера. Осаждающийся на катоде цинк непрерывно снимается с барабана или ленты и сматывается в рулоны; процесс ведется при очень высоких плотностях тока, достигающих 6000 А/м2. В полупромышленной установке с барабанным электролизером при катодной плотности тока 4000 А/м2 и напряжении 4 В был достигнут выход по току 97%.
Дата добавления: 2014-11-13; просмотров: 369; Мы поможем в написании вашей работы!; Нарушение авторских прав |