
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коэффициент избытка воздуха.
В топке не удаётся обеспечить идеального перемешивания горючего с окислителем. При подаче Vº (т.е. объёма воздуха фактически необходимого для сжигания данной массы топлива) происходит недожог. Для полноты сгорания воздух подают с избытком Vв.
α = коэф. избытка воздуха = 
αтопочной камеры зависит от:
1) способа сжигания (факельное сжигание твёрдого топлива αт״ = 1,2÷1,25, слоевое сжигание αт״ = 1,4÷1,7).
2) вида и марки топлива (природный газ и мазут αт״ = 1,05÷1,1).
3) конструкции горелочного устройства.
Присосы холодного воздуха в газовый тракт
 1- уравновешенная тяга (работает и вентилятор и дымосос).
1- уравновешенная тяга (работает и вентилятор и дымосос).
Обмуровка котла имеет неплотности, т.к. засчёт работы дымососа газоходы находятся под разрежением, поэтому холодный воздух присасывается к газам, увеличивая при этом коэф. избытка воздуха и объём уходящих газов.
αух = αт + Δα Vух = Vт + ΔVв

|
αгв = αт” – Δαт - Δαпс
Присосы влияют отрицательно:
1) Δαт↑ → υср. фак↓ → qт↓ → D↓ → B↑,
2) Δαт↑ → υг↓ → Δt↓ = υг – tп.c. → Qотд↓→υух↑ → КПД↓,
3) Δα↑ → υух↑ → υдым↑.
Меры борьбы с присосом
1) уплотнение обмуровки.
2) B и Д настраивают так, чтобы Sт’’ = min (2÷3) кг/м2
3) Работа котла под наддувом (без дымососа, работает только мощный вентилятор).
Расчёт объёмов продуктов сгорания твёрдого/жидкого топлива
При полном сгорании:
α = 1: CO2 + SO2 + N2 + H2O = 100%
 |
RO2 – трёхатомные газы (абстрактная характеристика).
α > 1: CO2 + SO2 + N2 + H2O + O2 = 100%

RO2
Теоретические объёмы (α = 1):
Объём 3-х атомных газов:
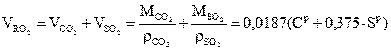
 ;
;
Объём водяных паров:
|
 ,
,
а) 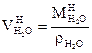 , б)
, б)  , в)
, в) 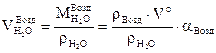 .
.
Объём азота:
 .
.
Суммарный объём:
 .
.
Действительные объёмы (α > 1):
 ,
,
 ,
,
 ,
,
 .
.
Суммарный объём:  .
.
Расчёт процессов горения газового топлива
Особенности:
1.Расчёты ведут на 1 м3,
2.Состав в объёмных процентах:
1. топливо: (CO2 + H2 + H2S + CH4 + CmHn) + (N2 + CO2 + O2) = 100%
2. воздух: O2 (21%) + N2 (79%) = 100%.
3. продукты сгорания: (CO2 + H2O + SO2) + (CO + H2 + CH4) + N2 + O2 = 100%
Элементарные реакции горения:
1.
|
 , получается
, получается  ;
;
2.
|
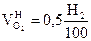 , получается
, получается 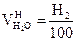 ;
;
3.
|
 , получается
, получается 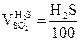 ,
, 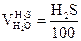 ;
;
4.
|
 , получается
, получается  ,
, 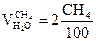 ;
;
5.CmHn требуется  , получается
, получается  ,
,  ;
;
Теоретический расход кислорода:
 м3/м3;
м3/м3;
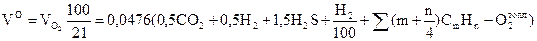 м3/м3;
м3/м3;
Расчёт объёмов продуктов сгорания:
При полном сгорании топлива состав газов следующий:
При α = 1 CO2 + SO2 + N2 + H2O = 100%
Объём 3-атомных газов:
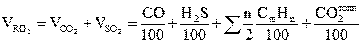 ;
;
Объём воды:
 ;
;
Объём азота:
 ;
;
Суммарный объём:
 ;
;
При α > 1 CO2 + SO2 + N2 + H2O + O2 = 100%
Объём 3-атомных газов:
 ;
;
Объём воды:
 ;
;
Объём азота:
 ;
;
Объём кислорода:
 ;
;
Суммарный объём:
 ;
;
Основное уравнение газового анализа. Материальный баланс кислорода (автор Бунте)
|
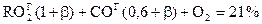
а) такое количество О2 расходуется на образование 3-х атомных газов,
б) такое количество О2 расходуется на окисление СОГ,
в) этот кислород переходит в газы в избыточном виде.
 – концентрация компонента полученная в процессе газового анализа %.
– концентрация компонента полученная в процессе газового анализа %.
|
 – топливная характеристика = 0, 03 ÷ 0, 3 ÷ 0, 8.
– топливная характеристика = 0, 03 ÷ 0, 3 ÷ 0, 8.
1) Если СО = 0 (недожог отсутствует), то  ,
,
2) Если О2Г = 0 (т. е. α = 1), то 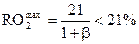 /
/
Контроль топочного процесса ведут по формулам:
Углекислотная:
| топливо | RO2max, % |
| углерод | |
| АШ | |
| Ку, БУ | 18–19 |
| мазут | 16–17 |
| природ. газ | ~12 |
При полном сгорании топлива и α = 1 состав газов – RO2 + N2 = 100%, где RO2 = RO2max = f(сост. топ.). Ориентировочные значения RO2max = >
При полном сгорании топлива и α > 1 состав газов – RO2 + N2 + O2 = 100%, здесь RO2 < RO2max,  .
.
Кислородная:
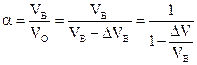
Если  ,
, 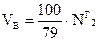 , то при полном сгорании топлива
, то при полном сгорании топлива
 .
.
Если недожег представлен виде СО, то с учетом СО + 0, 5О2 = СО2, выражение принимает вид
 .
.
Если СОтопл = 0 и N2 = 0, то

О2, %
 8
8
0 α
1 1, 6
Дата добавления: 2014-12-30; просмотров: 353; Мы поможем в написании вашей работы!; Нарушение авторских прав |