КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Электролиз
В соответствии с учебным планом изучения данной дисциплины студенты выполняют контрольную работу, которая является обязательной частью учебного процесса и без успешного написания которой они не допускаются к экзамену.
Рекомендации по оформлению контрольной работы:
- четко оформите титульный лист, укажите номер зачетной книжки
- задания оформите в следующем порядке: номер задачи, текст задачи, краткое условие задачи, решение, ответ
- текст, формулы, пояснения к задачам напишите разборчиво или отпечатайте (интервал между строчками 1 клетка)
- страницы нумеруйте, оставляя поля
- в конце работы укажите список использованных информационных источников
Контрольная работа представляется на проверку в академию в сроки, установленные учебным планом. Допущенные к защите работы остаются у преподавателя или хранятся в деканате, а незачтенные возвращаются студенту на доработку. Качество выполнения контрольной работы учитывается при сдаче экзамена по дисциплине.
Задание 1. Определите класс(ы) органических соединений, к которому(ым) относится вещество с данной эмпирической формулой;
- постройте структурную формулу, дайте название
- постройте и назовите изомеры (если таковые имеются)
| № задачи | Эмпирическая формула соединений | № задачи | Эмпирическая формула соединений | № задачи | Эмпирическая формула соединений |
| 1.1 | С5Н8; С6Н13О2N | 1.11 | С8Н18; C6H5N | 1.21 | С2Н3Cl; С6Н12 |
| 1.2 | С6Н12; С4Н8О2 | 1.12 | С5Н10О; СН4О | 1.22 | С9Н12; С4Н8О2 |
| 1.3 | С6Н3; С2Н3Cl | 1.13 | С6Н6О; С3Н9N | 1.23 | C3H6; С4Н8О |
| 1.4 | С3Н7NO2; С5Н11Cl | 1.14 | С5Н8; С4Н8О2 | 1.24 | С4Н6; С3Н5О2Na |
| 1.5 | С6Н14О6; (СН3)3N | 1.15 | С3Н9N; NC3H7O2 | 1.25 | С4Н10О; С6Н6 |
| 1.6 | СН2О; С6Н12О6 | 1.16 | С6Н3; СН2О | 1.26 | С4Н8; С6Н5ОН |
| 1.7 | С2Н7ОN; С6Н6 | 1.17 | С8Н10; С2Н3О2Na; | 1.27 | С12Н22О11; С3Н6 |
| 1.8 | С2Н6О; С12Н22О11 | 1.18 | С6Н4N3O6; C4H8O2 | 1.28 | С6Н12О6; С3Н6Сl2 |
| 1.9 | С6Н4N3O6; С6Н5Вr | 1.19 | С9Н12; С4Н6Cl | 1.29 | С2Н5NO2 ; С8Н18 |
| 1.10 | С2Н3О2К; С5Н10 | 1.20 | С5Н11Br; С6Н12 | 1.30 | С4Н8О2; С6Н12Сl2 |
Задание 2. Охарактеризуйте ниже приведенные вещества по плану:
- определение класса,
- строение, получение
- химические свойства
- роль в жизнедеятельности человека
| № задачи | Вещество | № задачи | Вещество | № задачи | Вещество |
| 2.1 | Лактоза | 2.11 | Уксусная кислота | 2.21 | Сорбиновая кислота |
| 2.2 | Валин | 2.12 | Метан | 2.22 | Ксилоза |
| 2.3 | Крахмал | 2.13 | Щавелевая кислота | 2.23 | Пропен |
| 2.4 | Этанол | 2.14 | Уксусный альдегид | 2.24 | Рибоза |
| 2.5 | Бензол | 2.15 | Глюкоза | 2.25 | Ацетилен |
| 2.6 | Анилин | 2.16 | Масляная кислота | 2.26 | Глицерин |
| 2.7 | Мочевина | 2.17 | Сахароза | 2.27 | Молочная кислота |
| 2.8 | Глицин | 2.18 | Яблочная кислота | 2.28 | Стеарат натрия |
| 2.9 | Фенол | 2.19 | Бензойная кислота | 2.29 | Фруктоза |
| 2.10 | Этилен | 2.20 | Ацетон | 2.30 | Целлюлоза |
Задание 3. Охарактеризуйте класс органических веществ (название класса, общая формула, гомологический ряд, номенклатура, изомерия, строение, получение, химические свойства)
| № задачи | Функциональная группа | № задачи | Функциональная группа | |||||
| 3.1 | 
| 3.16 | 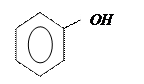
| |||||
| 3.2 |  > С = С < > С = С <
| 3.17 | - С = С – С = С - | |||||
| 3.3 | - С º С - | 3.18 | R – O – R/ | |||||
| 3.4 | 
| 3.19 | 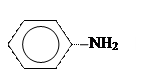
| |||||
| 3.5 |  CH2 – O –COOR CH2 – O –COOR
 CH2 – O – COOR/
CH2 – O –COOR// CH2 – O – COOR/
CH2 – O –COOR//
| 3.20 |
| |||||
| 3.6 | R - SH | 3.21 | R - OH | |||||
| 3.7 | 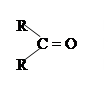
| 3.22 | 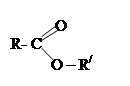
| |||||
| 3.8 | R – NO2 | 3.23 | R – SO2OH | |||||
| 3.9 | R - NO | 3.24 | R – (OH)n | |||||
| 3.10 | 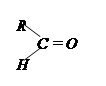
| 3.25 |   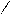 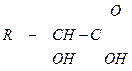
| |||||
| 3.11 | (-СН2 – СН2- )n | 3.26 |   R – CH =CH – C =O
R/ R – CH =CH – C =O
R/
| |||||
| 3.12 |  R – C = O
Hal R – C = O
Hal
| 3.27 |     О О
R – C – O – C – R/ О О
R – C – O – C – R/
| |||||
| 3.13 | 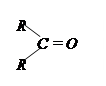
| 3.28 |  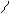 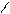 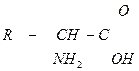
| |||||
| 3.14 | R – NH2 | 3.29 | R - OH | |||||
| 3.15 | НООС- R - СООН | 3.30 | R- Hal |

Задание4. Напишите уравнения реакций, характеризующие химические свойства ниже приведенных веществ, укажите условия протекания данных реакций и назовите продукты реакции
| № задачи | вещества | № задачи | вещества |
| 4.1 | Ацетилен, ацетон; | 4.16 | формальдегид, бутадиен -1,3 |
| 4.2 | бутин, манноза | 4.17 | бутанол, янтарная кислота |
| 4.3 | Масляная кислота, ксилол | 4.18 | фениламин, пентин |
| 4.4 | аллиловой спирт; мальтоза | 4.19 | сахароза, щавелевая кислота |
| 4.5 | Этанол, крезол | 4.20 | Масляная кислота; лизин |
| 4.6 | пропанол -2 ; пропен | 4.21 | ацетальдегид; пентанон |
| 4.7 | бензол; лактоза | 4.22 | этиламин; гексин-3 |
| 4.8 | пропионовая кислота; фенол | 4.23 | Анилин; метанол |
| 4.9 | глицерин; лейцин | 4.24 | метиламин; толуол |
| 4.10 | пропанол; пентин | 4.25 | Бутиламин, уксусный ангидрид |
| 4.11 | Бутен, масляный альдегид | 4.26 | Изобутилен, пропаналь |
| 4.12 | муравьиная кислота, валин | 4.27 | пропин; глюкоза |
| 4.13 | Йодистый этил, пентен | 4.28 | Манноза; бутаналь |
| 4.14 | уксусная кислоты, бутан | 4.29 | Лактоза ; 2,2-дибромбутан |
| 4.15 | олеиновая кислота, гексин | 4.30 | валин; валерьяновый альдегид |
Задание 5. Составьте уравнения качественных реакций на предложенные вещества
| № задачи | Вещество | № задачи | Вещество | № задачи | Вещество |
| 5.1 | Фенол | 5.11 | Глицин | 5.21 | Масляная кислота |
| 5.2 | Уксусная кислота | 5.12 | Ацетоуксусный эфир | 5.22 | Изопропиловый спирт |
| 5.3 | Этанол | 5.13 | Пропен | 5.23 | Лизин |
| 5.4 | Глицерин | 5.14 | Формальдегид | 5.24 | Бутин |
| 5.5 | Этиламин | 5.15 | Пропанол | 5.25 | Фруктоза |
| 5.6 | Этилен | 5.16 | Крахмал | 5.26 | Бензол |
| 5.7 | Глюкоза | 5.17 | Пропиламин | 5.27 | Бутанол |
| 5.8 | Ацетилен | 5.18 | Пентоза | 5.28 | Щавелевая кислота |
| 5.9 | Бутадиен | 5.19 | Метан | 5.29 | Ацетальдегид |
| 5.10 | Бутиламин | 5.20 | Белки | 5.30 | Этиленгликоль |
Задание 6. Предложите схемы синтеза следующих веществ: напишите уравнения реакций, назовите образующиеся соединения, укажите условия протекания реакций.
| № задачи | Вещества | № задачи | Вещества |
| 6.1 | Октина-2 из ацетилена | 6.16 | Пентина-2 из пентанола-1 |
| 6.2 | Ацетальдегида из бутанола-2 | 6.17 | Аллилового спирта из пропилена |
| 6.3 | Бутанона-2 из 1-бромбутана | 6.18 | 2,2-дихлорпропана из ацетилена |
| 6.4 | Изопрена из 3-метилбутанола-1 | 6.19 | Этилбензола из этилена |
| 6.5 | 2-бромэтанола-1 из бромистого этила | 6.20 | Пропилбензола из бензола и пропилового спирта |
| 6.6 | Полистирола из бензола и этилена | 6.21 | Циклопропана из пропилена |
| 6.7 | Циклогексена из этанола | 6.22 | Пентина-2 из пентанона-2 |
| 6.8 | 1,2-дибромпентана из пентанола-1 | 6.23 | Бутаналя из бутена-1 |
| 6.9 | Гептина-1 из ацетилена | 6.24 | Пентина-1 из ацетилена |
| 6.10 | Янтарной кислоты из этиленгликоля | 6.25 | Изовалериановой кислоты из ацетона |
| 6.11 | Щавелевой кислоты из бензола | 6.26 | Дифенилового эфира из бензола |
| 6.12 | 1,2-дибромпропана из пропанола-2 | 6.27 | Масляной кислоты из пропанола-1 |
| 6.13 | Бутандиола -1,3 из этанола | 6.28 | Этилацетата из этанола |
| 6.14 | Бутаналя из этанола | 6.29 | Этиламина из бромистого пропила |
| 6.15 | 1,4-дибромбутена-2 из ацетилена | 6.30 | Щавелевой кислоты из этилена |
Задание 7. Как различить следующие вещества. Напишите уравнения реакций
| № задачи | Вещества | № задачи | Вещества |
| 7.1 | Олеиновую и лауриновую кислоты | 7.16 | Глюкозу и крахмал |
| 7.2 | Глюкозу и сахарозу | 7.17 | Циклогексанол и циклогексен |
| 7.3 | Гексанол и фенол | 7.18 | Первичные и вторичные спирты |
| 7.4 | D-глюкозу и D-галактозу | 7.19 | Малеиновую и фумаровую кислоты |
| 7.5 | Метиламин и фениламин | 7.20 | Бутен и бутин |
| 7.6 | D-глюкозу и D-сорбит | 7.21 | Сахарозу и мальтозу |
| 7.7 | п-крезол и бензиловый спирт | 7.22 | Первичные и вторичные амины |
| 7.8 | Пентозы и гексозы | 7.23 | Аллиловый спирт и глицерин |
| 7.9 | Фенол и циклогексен | 7.24 | Щавелевую и уксусную кислоты |
| 7.10 | Ацетальдегид и ацетон | 7.25 | Бензол и циклогексан |
| 7.11 | Бутан и бутен | 7.26 | Сахарозу и крахмал |
| 7.12 | Аллиловый спирт и пропиловый спирт | 7.27 | Стеариновую и линолевую кислоты |
| 7.13 | Этилацетат и ацетоуксусный эфир | 7.28 | Толуол и фенол |
| 7.14 | Восстанавливающие и невосстанавливающие олигосахариды | 7.29 | Одноатомные и многоатомные спирты |
| 7.15 | Глицерин и пропиловый спирт | 7.30 | Щавелевую и янтарную кислоты |
Задание 8. Предложите схемы получения органических веществ из неорганических: напишите уравнения реакций, назовите образующиеся соединения, укажите условия протекания реакций.
| № задачи | Вещества | № задачи | Вещества |
| 8.1 | п-крезол из карбоната кальция | 8.16 | Акрилонитрил из углерода |
| 8.2 | Поливинилацетат из карбида кальция | 8.17 | Этиловый эфир аминоуксусной кислоты из углерода |
| 8.3 | Этилацетат из углерода | 8.18 | Глицин из углерода |
| 8.4 | Винилацетат из карбида кальция | 8.19 | Молочная кислоту из углерода |
| 8.5 | Янтарная кислота из углерода | 8.20 | Анилин из оксида кальция |
| 8.6 | Глицерин из углерода | 8.21 | Этилат натрия из оксида алюминия |
| 8.7 | Муравьиная кислота из карбоната кальция | 8.22 | Фенолформальдегидные смолы из карбида кальция |
| 8.8 | Полиэтилен из оксида алюминия | 8.23 | Фенол из карбоната кальция |
| 8.9 | Триброманилин из карбоната кальция | 8.24 | Акрилонитрил из карбоната кальция |
| 8.10 | Этилмеркаптан из углерода | 8.25 | Бутанол из оксида алюминия |
| 8.11 | Толуол из карбида алюминия | 8.26 | о-крезол из карбида кальция |
| 8.12 | Диэтиловый эфир из углерода | 8.27 | Хлоропрен из карбоната кальция |
| 8.13 | Аланин из карбида алюминия | 8.28 | Этилацетат из углерода |
| 8.14 | Винилацетат из оксида кальция | 8.29 | Циклогексен из карбида алюминия |
| 8.15 | Бутанон из оксида алюминия | 8.30 | Сульфат фениламмония углерода |
Задание 9. Ответьте на вопрос, ответ обоснуйте
9.1Какое из соединений – фенол или тимол (2-изопропил-5-метилфенол) является более сильной кислотой и почему?
9.2 В чем сходство изомеров и таутомеров? Почему кислоты и основания ускоряют взаимные превращения таутомеров?
9.3 В каких реакциях проявляется сходство между группами >C=O; >C=S; >C=NR; -C º N ? Объясните причину этого сходства.
9.4Охарактеризуйте полярность и поляризуемость связей С – Н; С - Cl; C - Br; C - I. почему йодистые алкилы обладают наибольшей реакционной способностью?
9.5Учитывая, что преобладающей кислотой триацилглицеридов оливкового масла является олеиновая кислота, а подсолнечного – линоленовая, определите, какое из масел в большей степени будет подвергаться окислению при длительном хранении?
9.6Объясните понятия конформация и конфигурация на примере 1-хлор-1-бромэтана.
9.7 Объясните, почему при восстановлении D-глюкозы боргидридом натрия образуется один шестиатомный спирт D-глюцит (сорбит), а при восстановлении D-фруктозы – два спирта – D-глюцит и D- маннит.
9.8 Что называется константой основности амина КВ? Как влияют электронные эффекты радикалов и пространственные факторы на основность аминов?
9.9 Расположите в ряд по убыванию кислотности фенол; 2-этилфенол; 2,4-динитрофенол. Какова будет относительная реакционная способность этих веществ в реакциях электрофильного замещения по ароматическому кольцу?
9.10 Объясните изменение реакционной способности в реакциях электрофильного присоединения в рядах: а) этилен< пропилен < 1,1-диметилэтилен
б) хлор > бром > йод
9.11 Почему амиды кислот более слабые основания, чем амины?
9.12 От чего зависит способность карбонильного углерода к присоединению нуклеофильных реагентов? Расположите в ряд по убыванию способности к такому присоединению следующие группы: - СНО; - СООН; - СОО -; -СОNH2; -СООСН3; -СОСН3; - СОCl.
9.13 Объясните, почему скорость нитрования по SE концентрированной азотной кислотой резко падает при добавлении солей азотной кислоты (например, NaNO3) и увеличивается при добавлении концентрированной серной кислоты?
9.14 Расположите соединения в порядке уменьшения их кислотных свойств: третбутиловый спирт; бутиловый спирт; трис-(трихлорметил)метанол.
9.15 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях нитрования и укажите продукты реакции: нитрование этилбензола; бензойной кислоты; м-этилтолуола.
9.16 Расположите в ряд по легкости дегидратации следующие спирты: 4-метилпентанол-1; 3-метилбутанол-2; 2метилпентанол-2
9.17 Что такое мутаротация? Растворы гликозидов подвержены мутаротации в водной кислоте. Объясните это явление.
9.18 Карбонильные соединения с водой образуют гидраты. Какой гидрат устойчивее: уксусного или трихлоруксусного альдегида. Почему?
9.19 В четырех пробирках находятся: аллиловый спирт; пропиловый спирт; глицерин и о–крезол. Как идентифицировать каждое из веществ?
9.20 Расположите соединения в ряд по возрастанию их кислотных свойств: акриловая кислота; пропионовая кислота; п-нитробензойная кислота; винилуксусная кислота.
9.21 Какое из перечисленных веществ образует магнийорганическое соединение с наибольшим выходом: бромистый бутил; йодистый третбутил или бромистый изопропил?
9.22 Почему полиэтилен плавится при более низкой температуре, чем найлон?
9.23 Расположите соединения в порядке уменьшения их кислотных свойств: м-нитрофенол; фенол; п-крезол; 2,4,6-тринитрофенол.
9.24 Карбонильные соединения с водой образуют гидраты. Какой гидрат устойчивее: пропионового альдегида или метилглиоксаля? Почему?
9.25 С помощью электронных эффектов (индукционного и мезомерного) опишите взаимное влияние функциональных групп в следующих соединениях: ОСН-СООН; ОСН-СН2 – СООН; СН3–СО–СН2-СН2– СООН; СН3–СО–СН2– СООН
9.26 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях сульфирования и укажите продукты реакции: сульфирование этилбензола; фенола; нитробензола; бромбензола; п-ксилола.
9.27 Наиболее удобным методом синтеза вторичных спиртов является реакция альдегидов с реактивами Гриньяра. Почему при получении высоких выходов продуктов магнийорганического синтеза реакции проводят со свежеприготовленными реактивами Гриньяра, с перегнанными реагентами, в среде сухих растворителей, в атмосфере чистого инертного газа?
9.28 Каким образом можно отличить растительное масло (подсолнечное, льняное) от минеральных (машинного, солярового)?
9.29 Как объяснить факт, что температура кипения спиртов значительно выше, чем у галогеналканов с тем же углеводородным радикалом? Почему температура кипения этиленгликоля выше, чем у пропилового и изопропилового спиртов, хотя все три вещества имеют одинаковую молекулярную массу.
9.30 Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях бромирования и укажите продукты реакции: бромирование бензола; м-ксилола; м-динитробензола; п-нитроизопропилбензола
Задание 10. Определите молекулярную формулу вещества по приведенным ниже данным.
| № задачи | Исходные данные |
| 10.1 | 52,1% С; 13,1% Н; 34,8 % О; DH =23 |
| 10.2 | 92,2% С; 7,8% Н; DH =39 |
| 10.3 | 85,71% С; 14,29% Н; DH =21 |
| 10.4 | 29,8% С; 6,3% Н; 44,0 % Cl; М = 80,5 |
| 10.5 | 78,6% С; 8,4% Н; 12,92 % N; М=107 |
| 10.6 | 32,0% С; 4,0% Н; молекула содержит кислород; М=150 |
| 10.7 | 85,71% С; 14,29% Н; DH = 28, вещество обесцвечивает бромную воду и перманганат калия |
| 10.8 | 40,0% С; 6,67% Н; Dпо воздуху ≈ 1 |
| 10.9 | 20,0% С; 6,67% Н; 46,67 % N; остальное – кислород, М = 60 |
| 10.10 | 79,2% С; 5,5% Н; остальное - кислород; DH =53 |
| 10.11 | 48,7% С; 13,6% Н; 37,8 % N; M = 74 |
| 10.12 | 25,2% С; 2,8% Н; 49,6 % Cl; остальное – кислород, М = 143 |
| 10.13 | 67,9% С; 5,7% Н; 26,4 % N; М = 106 |
| 10.14 | 46,38% С; 5,9% Н; 27,01 % N; остальное – кислород, М = 155 |
| 10.15 | Пенициллин G : 57,45% С; 5,4% Н; 8,45 % N; 9,61% S |
| 10.16 | Витамин РР: 59,10% С; 4,92% Н; 22,91% N; остальное – кислород |
| 10.17 | 8,0% С; 92,0 % Cl; Dпо воздуху =5, 24 |
| 10.18 | 85,70% С; 14,30% Н; DH =21 |
| 10.19 | 80,0% С; 20,0% Н; DH =15 |
| 10.20 | 54,55% С; 9,09% Н; 36,36 % О; DH =22, вещество восстанавливает оксид серебра в аммиачном растворе, образуя кислоту. |
| 10.21 | Первичный амин: 38,7% С; 16,15% Н; остальное азот. |
| 10.22 | Одноосновная кислота: 26,1% С; 4,35% Н; 69,55 % О |
| 10.23 | При сжигании 1,4г вещества получено 4,4г оксида углерода (IV) и 1,8г воды. DH = 28. Выведите формулу вещества. |
| 10.24 | При сгорании 2,3г вещества образовалось 4,4г оксида углерода (IV) и 2,7 воды. Dпо воздуху = 1,59. Выведите формулу вещества |
| 10.25 | 52,0% С; 13,0% Н; остальное кислород, DH =23 |
| 10.26 | При взаимодействии 0,32г предельного спирта с металлическим натрием выделилось 112мл водорода. Выведите структурную формулу спирта. |
| 10.27 | При сгорании 4,8г вещества получено 6,6г оксида углерода (IV) и 5,4г воды. DH =16. Выведите формулу. |
| 10.28 | Папаверин: 70,8% С; 4,1% Н; 4,1 % N; остальное – кислород |
| 10.29 | При сжигании 29г вещества получено 44,8л оксида углерода (IV) и 45г воды. Dпо воздуху = 2. Выведите формулу вещества. |
| 10.30 | Индиго (краситель): 73,3% С; 3,8% Н; 10,7% N; остальное - кислород. М = 262 |
Задание 11. Определить мольную долю компонентов в смеси по приведенным ниже данным.
11.1 При хлорировании метана объемом 17,92л (н.у.) получена смесь хлорметана и дихлорметана общей массой 61,1г. метан израсходован полностью. Определите мольную долю хлорметана (в%) в полученной смеси.
11.2 Для нейтрализации смеси фенола и уксусной кислоты потребовалось 23,4 мл 20%-ного раствора гидрооксида калия (плотность 1,2 г/мл). При взаимодействии исходной смеси с бромной водой образовалось 16,55 г осадка. Каков состав исходной смеси ( %).
11.3 При взаимодействии ацетилена объемом 3,36 л (н.у) с хлороводородом получена смесь винилхлорида (хлорэтена) и дихлорэтана общей массой 12,66 г. ацетилен израсходован полностью. Определите мольную долю винилхлорида (%) в полученной смеси.
11.4 При хлорировании этана объемом 16,8 л (н.у) получена смесь хлорэтана и дихлорэтанов общей массой 53,55 г. Этан израсходован полностью. Определите мольную долю хлорэтана (%) в полученной смеси
11.5 Смесь этана и этилена объемом 33,6 л подвергли гидрированию. При этом получили продукт массой 15 г. Какова объемная доля этилена в исходной смеси.
11.6 Для нейтрализации смеси фенола и уксусной кислоты израсходовано 23,4 мл раствора гидрооксида калия (ω = 40%; ρ = 1,2г/см3). При действии на исходную смесь азотной кислоты массой 18,9г образовался 2,4,6 – тринитрофенол. Вычислите массовую долю (%) уксусной кислоты в смеси.
11.7 Через смесь бензола, фенола и анилина массой 20г пропустили хлороводород. При этом выпал осадок массой 2,59г. при нейтрализации такой же массы смеси затрачен раствор гидрооксида натрия массой 10г (ω = 20%). Какова массовая доля (%) бензола в смеси?
11.8 На смесь массой 10г содержащую анилин, аминоуксусную и уксусную кислоты подействовали бромной водой массой 20г с массовой долей брома 2%. При этом выпал осадок массой 1,1г. при действии на такую же массу смеси израсходован хлороводород объемом 2,247 л (н.у). Какова массовая доля (%) уксусной кислоты в смеси?
11.9 При бромировании бензола объемом 35,5 мл получена смесь бромбензола и дибромбензолов общей массой 73,86г. Бензол израсходован полностью. Определите мольную долю бромбензола (%) в полученной смеси. Плотность бензола – 0,879г/мл.
11.10 Смесь содержит равное число молекул этанола и уксусной кислоты. Рассчитайте массовые доли веществ в такой смеси.
11.11 При нитровании бензола объемом 26,6 мл получена смесь нитробензола и динитробензолов общей массой 39,6г. Бензол израсходован полностью. Определите мольную долю нитробензола (%) в полученной смеси. Плотность бензола – 0,879г/мл.
11.12 При сгорании смеси этиламина и паров метанола образовалось 43,2 г воды и 4,48 л газа (н.у), нерастворимого в растворе щелочи. Вычислите массовую долю метанола в исходной смеси.
11.13 Смесь бензола и циклогексена обесцвечивает 75 г бромной воды с массовой долей брома 3%. При сжигании такого же количества исходной смеси в избытке кислорода образовавшиеся продукты пропустили через избыток известковой воды и получили 21 г осадка. Определите состав исходной смеси (% по массе).
11.14 При радикальном хлорировании циклогексана объемом 21,5мл получена смесь хлорциклогексана и дихлорциклогексанов общей массой 25,77г. Циклогексан израсходован полностью. Определите мольную долю хлорциклогексана (%) в полученной смеси.
11.15 При действии избытка натрия на смесь этилового спирта и фенола выделилось 6,72 л водорода (н.у). Для полной нейтрализации этой же смеси потребовалось 25 мл 40%-ного раствора гидрооксида калия (плотность 1,4 г/мл). Определите состав исходной смеси.
11.16 Смесь уксусной и аминоуксусной кислот обработана раствором, содержащим NaOH массой 80 г. Вычислите массу смеси, если на взаимодействие с такой же ее порцией затрачена соляная кислота массой 36,5 г.
11.17 При взаимодействии 300 г 9%-го раствора щавелевой кислоты НООС – СООН с раствором гидрооксида натрия получена смесь двух солей общей массой 36,24 г.Щавелевая кислота израсходована полностью. Определите мольную долю кислой соли (в%) в полученной смеси.
11.18 На нейтрализацию смеси муравьиной и уксусной кислот затрачен раствор гидрооксида калия массой 200г с ω=11,2%. При действии на такую же массу смеси аммиачным раствором оксида серебра, выделилось серебро массой 2,16г. Какова массовая доля (%) уксусной кислоты в смеси?
11.19 При бромировании этана объемом 13,44л (н.у) получена смесь бромэтана и дибромэтанов общей массой 77,25г. этан израсходован полностью. Определите мольную долю бромэтана (%) в полученной смеси.
11.20 Через 10г смеси бензола, фенола и анилина пропустили ток сухого хлороводорода, при этом выпало 2,59 г осадка. Его отфильтровали, а фильтрат обработали водным раствором гидрооксида натрия. Верхний органический слой отделили. Его масса уменьшилась на 4,7 г. Вычислите массовые доли веществ в исходной смеси.
11.21 При взаимодействии 260 г 8%-го раствора малоновой кислоты НООС –СН2 - СООН с раствором гидрооксида калия получена смесь двух солей общей массой 32,96 г. Малоновая кислота израсходована полностью. Определите мольную долю кислой соли (в%) в полученной смеси.
11.22 Смесь фенола и анилина прореагировала с 40г раствора, в котором массовая доля гидрооксида натрия 5%. Эта же смесь может прореагировать с бромной водой, содержащей 72г брома. Определите массы фенола и анилина в исходной смеси.
11.23 16 г раствора фенола и уксусной кислоты в диэтиловом эфире обработали избытком металлического натрия, при этом выделилось 493 мл газа (н.у). Такое же количество раствора обработали избытком 5%-ного раствора гидрокарбоната натрия; образовалось 269 мл газа. Вычислите массовые доли веществ в растворею
11.24Через 50 г смеси фенола, анилина и бензола пропустили газообразный хлороводород, при этом выпал осадок массой 12,95г. С такой же смесью полностью прореагировал раствор, содержащий 8,4г едкого калия. Найдите массовые доли компонентов в смеси.
11.25На нейтрализацию смеси муравьиной и уксусной кислот затратили раствор объемом 8 мл с массовой долей КОН 40% и плотностью 1,4 г/мл. К такому же образцу смеси кислот прибавили избыток аммиачного раствора оксида серебра. Выделился металлический осадок массой 10,8 г. Определите массовые доли кислот в смеси.
11.26На нейтрализацию смеси фенола с этанолом израсходован раствор объемом 50 мл с массовой долей гидрооксида натрия 18% (плотность 1,2 г/мл). Такая же масса смеси прореагировала с металлическим натрием массой 9,2г. Определите массовую (%) фенола и этанола в смеси.
11.27При нагревании смеси этанола и уксусной кислоты с каталитическим количеством серной кислоты получили этилацетат массой 13,2 г. Выход эфира составил 60%. При действии избытка гидрокарбоната натрия на исходную смесь такой же массы образовался газ объемом 7,84 л (н.у). Определите массовые доли веществ в смеси.
11.28При действии металлического натрия на смесь массой 17,45г, состоящую из фенола и 2-хлорэтанола, выделился водород в количестве, необходимом для восстановления оксида меди (I) массой 14,4 г. Вычислите массовые доли веществ в исходной смеси.
11.29Для каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до соответствующих спиртов потребовалось 11,2 л водорода (н.у). Определить состав смеси альдегидов (в % по массе)
11.30 При взаимодействии фталевой кислоты НООС –С6Н4 - СООН со 170 г 8%-ного раствором гидрооксида натрия получена смесь двух солей общей массой 40,68 г. Кислота и щелочь израсходованы полностью. Определите мольную долю кислой соли (в%) в полученной смеси.
Вопросы для подготовки к экзамену:
1. Особенности органических соединений, причины многообразия соединений углерода. История развития органической химии.
2. Гибридные состояния атома углерода в одинарной, двойной, тройной С-С связях. Особенности строения углеводородов с разными типами связей.
3. Теория химического строения органических соединений А.М.Бутлерова, ее основные положения
4. Явление изомерии. Виды изомерии (с примерами)
5. Взаимное влияние атомов. Мезомерный и индуктивный эффекты. Суммарное электронное влияние заместителя.
6. Классификация органических реакций по направлению их протекания, по механизму протекания и способу разрыва связи. Радикальные, ионные реакции. Электрофилы, нуклеофилы (примеры).
7. Классификация органических соединений. Функциональные группы. Основы номенклатуры. Гомологические ряды. Изологические ряды. Генетические ряды.
8. Алканы. Строение, номенклатура, изомерия. Основные способы получения и химические свойства. Отдельные представители.
9. Алкены. Строение, номенклатура, изомерия. Основные способы получения и химические свойства. Правило Марковникова. Качественные реакции. Отдельные представители.
10. Алкины. Строение, номенклатура, изомерия. Основные способы получения и особенности химических свойств по сравнению с алкенами. Качественные реакции. Отдельные представители.
11. Циклоалканы. Особенности строения и химических свойст.
12. Алкадиены. Номенклатура, особенности строения и химических свойств. Эффект сопряжения.
13. Арены. Понятие ароматичности. Номенклатура и изомерия углеводородов ряда бензол. Механизм реакций электрофильного замещения в ароматическом ряду.
14. Способы получения и химические свойства аренов. Качественные реакции.
15. Галогенпроизводные углеводородов. Изомерия, номенклатура. Влияние галогенов на углеводородный радикал. Основные способы получения и химические свойства.
16. Спирты. Строение одноатомных спиртов, номенклатура, изомерия. Основные способы получения и химические свойства. Качественные реакции.
17. Отдельные представители одноатомных спиртов: метанол, этанол. Способы производства. Роль в жизнедеятельности человека.
18. Фенолы. Строение, номенклатура, изомерия. Основные способы получения и химические свойства. Качественные реакции. Антиоксиданты на основе фенолов.
19. Многоатомные спирты. Особенности строения и химических свойств. Основные представители. Качественные реакции.
20. Непредельные спирты. Особенности строения и химических свойств. Кето-енольная таутомерия. Отдельные представители.
21. Меркаптаны (тиоспирты, тиолы) – сернистые аналоги спиртов. Особенности строения и химических свойств. Распространение в природе.
22. Простые эфиры. Строение, номенклатура, изомерия. Основные способы получения и химические свойства.
23. Карбонильные соединения. Альдегиды. Особенности строения карбонильной группы, номенклатура, изомерия. Основные способы получения и химических свойств. Реакции конденсации. Качественные реакции. Отдельные представители.
24. Карбонильные соединения. Кетоны. Особенности строения, номенклатура, изомерия. Основные способы получения и химических свойств. Качественные реакции. Отдельные представители.
25. Понятие о диальдегидах и дикетонах. Непредельные и ароматические альдегиды и кетоны. Особенности строения, способов получения, химических свойств. Отдельные представители.
26. Карбоновые кислоты. Классификация, номенклатура, изомерия. Особенности строения карбоксильной группы. Способность образовывать водородные связи. Распространение в природе, роль в перерабатывающей и пищевой отрасли.
27. Одноосновные карбоновые кислоты. Основные способы получения и химических свойств. Качественные реакции. Отдельные представители.
28. Дикарбоновые кислоты. Особенности строения, физических и химических свойств. Отдельные представители, их распространение в природе и роль в процессах жизнедеятельности человека.
29. Сложные эфиры карбоновых кислот. Строение, способы получения. Распространение в природе и продуктах жизнедеятельности человека.
30. Кислоты ароматического ряда и непредельные карбоновые кислоты. Способы производства и химические свойства. Отдельные представители. Роль бензойной кислоты, бензонатов в перерабатывающей и пищевой промышленности.
31. Амиды карбоновых кислот. Мочевина. Нитрилы. Способы получения и химические свойства.
32. Липиды. Классификация, функции. Воски. Фосфолипиды как пример сложных омыляемых липидов: особенности строения, биологические функции, строение клеточных мембран.
33. Природные животные и растительные жиры. Особенности строения. Аналитическая характеристика жиров: кислотное число, число омыления, йодное число. Физические и химические свойства. Кислотный гидролиз. Проблема прогоркания жиросодержащих пищевых продуктов и способы решения.
34. Мыла и детергенты. Омыление (щелочной гидролиз). Недостатки мыла и достоинства детергентов. Поверхностно-активные вещества.
35. Оксикислоты. Изомерия, номенклатура. Особенности строения, способов производства и химических свойств. Отдельные представители. Распространение в природе, роль в процессах жизнедеятельности человека.
36. Оксокислоты (альдегидо- и кетокислоты). Изомерия, номенклатура. Особенности строения, способов производства и химических свойств. Отдельные представители. Распространение в природе, роль в процессах жизнедеятельности человека.
37. Оптическая изомерия как один из видов пространственной изомерии. Проекционные формулы Фишера.
38. Углеводы. Общая характеристика, классификация, строение, биороль. Распространение в природе.
39. Моносахариды. Классификация, изомерия. Конфигурация и генетические ряды. Основные представители.
40. Таутомерия моносахаридов. Мутаротация растворов.
41. Химические свойства моносахаридов. Качественные реакции. Превращения моносахаридов в технологических процессах.
42. Дисахариды. Классификация, распространение в природе, биороль. Отдельные представители: мальтоза, лактоза, целлобиоза и сахароза, их строение и свойства.
43. Полисахариды. Характеристика и строение крахмала, гликогена, целлюлозы, гемицеллюлоз, пектиновых веществ. Распространение в природе, направления использования.
44. Амины и аминоспирты. Классификация, номенклатура, изомерия. Основные способы получения и химические свойства. Качественные реакции. Отдельные представители
45. Аминокислоты. Классификация, особенности номенклатуры, изомерия. Заменимые и незаменимые аминокислоты. Особенности строения ( образование биполярного иона, изоэлектрическая точка). Методы разделения аминокислот (электрофорез, хроматография)
46. Способы получения и химические свойства аминокислот. Качественные реакции.
47. Пептиды. Строение, пептидная связь. Способы получения. Биороль.
48. Белки. Классификация и биофункции. Примеры белков различных классов. Уровни организации белковых молекул.
49. Магнийорганические соединения – реактивы Гриньяра, их использование для синтеза органических веществ различных классов.
Информационные источники:
• И.И.Грандберг Органическая химия М., 2001
• А.П.Нечаев, Т.В. Еременко Органическая химия М.,1985
• Б.Д.Березин, Д.Б. Березин Курс органической химии М., 2001
• С.Я. Янковский, Н.С.Данилова Задачи по органической химии М., 2000
• www.alhimik.ru
• www.chem.msu.su/rus/
• www.xumuk.ru/
• др.
Номера задач по контрольной работе (по номеру варианта)
| Предпоследняя цифра | Последняя цифра варианта | |||||||||
| 1.1; 2.1; 3.1; 4.1; 5.1; 6.1; 7.1; 8.1; 9.1; 10.1; 11.1 | 1.2;2.2; 3.2; 4.2; 5.2; 6.2; 7.2; 8.2; 9.2; 10.2; 11.2 | 1.3; 2.3; 3.3; 4.3; 5.3; 6.3; 7.3; 8.3; 9.3; 10.3; 11.3 | 1.4; 2.4; 3.4; 4.4; 5.4; 6.4; 7.4; 8.4; 9.4; 10.4; 11.4 | 1.5; 2.5; 3.5; 4.5; 5.5; 6.5; 7.5; 8.5; 9.5; 10.5; 11.5 | 1.6; 2.6; 3.6; 4.6; 5.6; 6.6; 7.6; 8.6; 9.6; 10.6; 11.6 | 1.7;2.7; 3.7; 4.7; 5.7; 6.7; 7.7; 8.7; 9.7; 10.7; 11.7 | 1.8; 2.8; 3.8; 4.8; 5.8; 6.8; 7.8; 8.8; 9.8; 10.8; 11.8 | 1.9; 2.9; 3.9; 4.9; 5.9; 6.9; 7.9; 8.9; 9.9; 10.9; 11.9 | 1.10; 2.10; 3.10; 4.10; 5.10; 6.10; 7.10; 8.10; 9.10; 10.10; 11.10 | |
| 1.11;2.11; 3.11; 4.11; 5.11; 6.11; 7.11; 8.11; 9.11; 10.11; 11.11 | 1.12; 2.12; 3.12; 4.12; 5.12; 6.12; 7.12; 8.12; 9.12; 10.12; 11.12 | 1.13; 2.13; 3.13; 4.13; 5.13; 6.13; 7.13; 8.13; 9.13; 10.13; 11.13 | 1.14;2.14; 3.14; 4.14; 5.14; 6.14; 7.14; 8.14; 9.14; 10.14; 11.14 | 1.15; 2.15; 3.15; 4.15; 5.15; 6.15; 7.15; 8.15; 9.15;10.15; 11.15 | 1.16; 2.16; 3.16; 4.16; 5.16; 6.16; 7.16; 8.16; 9.16; 10.16; 11.16 | 1.17; 2.17; 3.17; 4.17; 5.17; 6.17; 7.17; 8.17; 9.17; 10.17; 11.17 | 1.18; 2.18; 3.18; 4.18; 5.18; 6.18; 7.18; 8.18; 9.18; 10.18; 11.18 | 1.19; 2.19; 3.19; 4.19; 5.19; 6.19; 7.19; 8.19; 9.19; 10.19; 11.19 | 1.20; 2.20; 3.20; 4.20; 5.20; 6.20; 7.20; 8.20; 9.20; 10.20; 11.20 | |
| 1.21; 2.21; 3.21; 4.21; 5.21; 6.21; 7.21; 8.21; 9.21; 10.21; 11.21 | 1.22; 2.22; 3.22; 4.22; 5.22; 6.22; 7.22; 8.22; 9.22; 10.22; 11.22 | 1.23; 2.23; 3.23; 4.23; 5.23; 6.23; 7.23; 8.23; 9.23; 10.23; 11.23 | 1.24; 2.24; 3.24; 4.24; 5.24; 6.24; 7.24; 8.24; 9.24; 10.24; 11.24 | 1.25; 2.25; 3.25; 4.25; 5.25; 6.25; 7.25; 8.25; 9.25; 10.25; 11.25 | 1.26; 2.26; 3.26; 4.26; 5.26; 6.26; 7.26; 8.26; 9.26; 10.26; 11.26 | 1.27; 2.27; 3.27; 4.27; 5.27; 6.27; 7.27; 8.27; 9.27; 10.27; 11.27 | 1.28; 2.28; 3.28; 4.28; 5.28; 6.28; 7.28; 8.28; 9.28; 10.28; 11.28 | 1.29; 2.29; 3.29; 4.29; 5.29; 6.29; 7.29; 8.29; 9.29; 10.29; 11.29 | 1.30; 2.30; 3.30; 4.30; 5.30; 6.30; 7.30; 8.30; 9.30; 10.30; 11.30 | |
| 1.1; 2.1; 3.1; 4.1; 5.1; 6.1; 7.1; 8.1; 9.1; 10.1; 11.1 | 1.2;2.2; 3.2; 4.2; 5.2; 6.2; 7.2; 8.2; 9.2; 10.2; 11.2 | 1.3; 2.3; 3.3; 4.3; 5.3; 6.3; 7.3; 8.3; 9.3; 10.3; 11.3 | 1.4; 2.4; 3.4; 4.4; 5.4; 6.4; 7.4; 8.4; 9.4; 10.4; 11.4 | 1.5; 2.5; 3.5; 4.5; 5.5; 6.5; 7.5; 8.5; 9.5; 10.5; 11.5 | 1.6; 2.6; 3.6; 4.6; 5.6; 6.6; 7.6; 8.6; 9.6; 10.6; 11.6 | 1.7;2.7; 3.7; 4.7; 5.7; 6.7; 7.7; 8.7; 9.7; 10.7; 11.7 | 1.8; 2.8; 3.8; 4.8; 5.8; 6.8; 7.8; 8.8; 9.8; 10.8; 11.8 | 1.9; 2.9; 3.9; 4.9; 5.9; 6.9; 7.9; 8.9; 9.9; 10.9; 11.9 | 1.10; 2.10; 3.10; 4.10; 5.10; 6.10; 7.10; 8.10; 9.10; 10.10; 11.10 | |
| 1.11;2.11; 3.11; 4.11; 5.11; 6.11; 7.11; 8.11; 9.11; 10.11; 11.11 | 1.12; 2.12; 3.12; 4.12; 5.12; 6.12; 7.12; 8.12; 9.12; 10.12; 11.12 | 1.13; 2.13; 3.13; 4.13; 5.13; 6.13; 7.13; 8.13; 9.13; 10.13; 11.13 | 1.14;2.14; 3.14; 4.14; 5.14; 6.14; 7.14; 8.14; 9.14; 10.14; 11.14 | 1.15; 2.15; 3.15; 4.15; 5.15; 6.15; 7.15; 8.15; 9.15;10.15; 11.15 | 1.16; 2.16; 3.16; 4.16; 5.16; 6.16; 7.16; 8.16; 9.16; 10.16; 11.16 | 1.17; 2.17; 3.17; 4.17; 5.17; 6.17; 7.17; 8.17; 9.17; 10.17; 11.17 | 1.18; 2.18; 3.18; 4.18; 5.18; 6.18; 7.18; 8.18; 9.18; 10.18; 11.18 | 1.19; 2.19; 3.19; 4.19; 5.19; 6.19; 7.19; 8.19; 9.19; 10.19; 11.19 | 1.20; 2.20; 3.20; 4.20; 5.20; 6.20; 7.20; 8.20; 9.20; 10.20; 11.20 | |
| 1.21; 2.21; 3.21; 4.21; 5.21; 6.21; 7.21; 8.21; 9.21; 10.21; 11.21 | 1.22; 2.22; 3.22; 4.22; 5.22; 6.22; 7.22; 8.22; 9.22; 10.22; 11.22 | 1.23; 2.23; 3.23; 4.23; 5.23; 6.23; 7.23; 8.23; 9.23; 10.23; 11.23 | 1.24; 2.24; 3.24; 4.24; 5.24; 6.24; 7.24; 8.24; 9.24; 10.24; 11.24 | 1.25; 2.25; 3.25; 4.25; 5.25; 6.25; 7.25; 8.25; 9.25; 10.25; 11.25 | 1.26; 2.26; 3.26; 4.26; 5.26; 6.26; 7.26; 8.26; 9.26; 10.26; 11.26 | 1.27; 2.27; 3.27; 4.27; 5.27; 6.27; 7.27; 8.27; 9.27; 10.27; 11.27 | 1.28; 2.28; 3.28; 4.28; 5.28; 6.28; 7.28; 8.28; 9.28; 10.28; 11.28 | 1.29; 2.29; 3.29; 4.29; 5.29; 6.29; 7.29; 8.29; 9.29; 10.29; 11.29 | 1.30; 2.30; 3.30; 4.30; 5.30; 6.30; 7.30; 8.30; 9.30; 10.30; 11.30 |
Тест
Жеңіл сұрақтар
Систематикалық номенклатураны құрастыру ережесі?
<variant> префикс + түбір + суффикс
РН - бойынша атаңыз? Систематикалық номенклатураны құрастыру ережесі?
СН3 - СН - СН2 - CН - CН - CH3
| | |
CH3 CH3 CH3
<variant>метилизопропилизобутилметан
РН - бойынша атаңыз?
СН3 - СН - СН2 - CН - CH3
| |
CH2 CH3
|
CH3
<variant>метилэтилизобутилметан
Х
 <question1> Х - ты анықтаңыз? CH3-CHСІ 2,3 диметилбутан
<question1> Х - ты анықтаңыз? CH3-CHСІ 2,3 диметилбутан
|
CH3
<variant>2Na
 <question1> Х - ты анықтаңыз? Х + НСІ изобутан
<question1> Х - ты анықтаңыз? Х + НСІ изобутан
<variant>2 хлор - 2 - метилпропан
Т0С
 <question1> Х - ты анықтаңыз? Х + NaOН бутан
<question1> Х - ты анықтаңыз? Х + NaOН бутан
<variant>СН3СН2СН2СН2СООNa
<question1> Х - ты анықтаңыз
электролиз
 Х бутан.
Х бутан.
<variant>СН3СН2СООNа
<question1> Х - ты анықтаңыз
 Х + Н2 пропан.
Х + Н2 пропан.
<variant>Пропилен
<question1> Х - ты анықтаңыз
 Х + 2Na 2,3 - диметилбутан.
Х + 2Na 2,3 - диметилбутан.
<variant> 2 - хлорпропан
 <question1> Х - ты анықтаңыз?
<question1> Х - ты анықтаңыз?
 1 хлорпропан + 2Na Х.
1 хлорпропан + 2Na Х.
<variant> Гексан
<question1> Вюрц синтезімен метилэтилекіншілікбутилметанды қайсы қосылыстан алуға болады?
<variant> 1 - хлорбутан
<question1> 2,3 диметилбутанды Вюрц синтезімен қайсы қосылыстан алуға болады.
<variant>2 - хлорпропан
<question1> Х - ты анықта?

 Х + 2Nа триметилүшіншілікбутилметан
Х + 2Nа триметилүшіншілікбутилметан
<variant>2 - метил - 2 - хлорпропан
 Кольбе
Кольбе
 <question1> Х - ты анықта? СН3 - СН - СООNa синтезі Х
<question1> Х - ты анықта? СН3 - СН - СООNa синтезі Х
|
СН3
<variant> диметилизопропилметан
<question1> Х - ты анықта? Триметилметан + HNO3 (15%)
<variant> 2 - метил - 2 - нитропропан
<question1> Х - ты анықта?Диметилэтилметан + Вч2(hv )
<variant> 2 - метил - 2 - бромбутан
<question1> С5Н12 изомерлерін анықта?
СН3 СН3
| |
1. СН3СН - СН2СН3 2. СН3 - СН2 - СН - СН3 3. СН3 - С - СН3
| |
СН3 СН3
4. СН3СН2СН2СН2 – СН3 5. СН3 - СН2 - СН2
|
СН3
<variant> 1,3,4
<question1> Соңғы өнім.
|



 СН3СН2СІ + НСІ .... .... ....
СН3СН2СІ + НСІ .... .... ....
hv синтезі 15%
<variant>2 – нитробутан.
|
CI2 2Na
|


 СН3СН - СООNa + NaOH … …
СН3СН - СООNa + NaOH … …
| hv T0C
СН3
<variant>2,3 - диметилбутан
|
|


 СН3СН = CH2 … …
СН3СН = CH2 … …
Hv
<variant>пропан
|
Мg HOH HNO3

|

 СН3СН2СН2Вч + … …
СН3СН2СН2Вч + … …
эфир (15%)
<variant> 2 - нитропропан
<question1> Келесі алкандардың қайсысын Вюрц синтезімен алғанда қоспа түзіледі:
1. СН3СН2СН3 2. СН3СН3 3. изобутан 4. бутан
<variant> 1,3
<question1> Соңғы өнімдер. СН3СН2СІ + Na + СН3СI
<variant>этан, пропан, бутан
<question1> Вюрц реакциясымен синтездеуге болатын алкан?
<variant> бутан
|
|

 СН3 - СН - СН2СІ + НСІ …
СН3 - СН - СН2СІ + НСІ …
| (15%)
СН3
<variant>2 - нитро - 2 - метилпропан
<question1> Соңғы өнім. Этан + Ғ2 (изб)
<variant>С2Ғ6
 <question1> Соңғы өнім. Пентан + О2 (жану)
<question1> Соңғы өнім. Пентан + О2 (жану)
<variant> СО2 + Н2О + Q
 <question1> Соңғы өнім. Бутан + SО2 + СІ2 (hv) Х
<question1> Соңғы өнім. Бутан + SО2 + СІ2 (hv) Х
<variant> С4Н9SО2СІ
 <question1> SR - реакцияның СН3 - СН2 + HNO3(15%) СН3СН2NO2 + НОН
<question1> SR - реакцияның СН3 - СН2 + HNO3(15%) СН3СН2NO2 + НОН
соңғы сатысын анықтаңыз?
. .
 <variant> CН3СН2 + NO2
<variant> CН3СН2 + NO2
. .
 <question1> SR - механизмінің СН3СН3 + СІ2 (hv) СН3СН2СІ + НСІ сатыларын ретімен орналастырыңыз.
<question1> SR - механизмінің СН3СН3 + СІ2 (hv) СН3СН2СІ + НСІ сатыларын ретімен орналастырыңыз.
. .
 1. СН3 - СН3 СН3СН2 + Н
1. СН3 - СН3 СН3СН2 + Н
. .
 2. СН3СН2 + СІ СН3СН2СІ
2. СН3СН2 + СІ СН3СН2СІ
 3. СІ2 СІ0 + СІ0
3. СІ2 СІ0 + СІ0
. .
 4. СН3 - СН3 + СІ СН3СН2 + НСІ
4. СН3 - СН3 + СІ СН3СН2 + НСІ
.
 5. СН3СН2 + СІ2 СН3СН2СІ + НСІ
5. СН3СН2 + СІ2 СН3СН2СІ + НСІ
<variant> 3,4,2.
<question1> Сульфохлорлау реакциясының механизмін ретімен орналастыр?
. . .
 1. CH3 + SO2 CH3SO2
1. CH3 + SO2 CH3SO2
. .
 2. CH3 + SO2 CH3SO2
2. CH3 + SO2 CH3SO2
Hv
 3. СІ2 СІ0 + СІ0
3. СІ2 СІ0 + СІ0
. .
 4. CH3SO2 + CI2 CH3SO2CI + CI
4. CH3SO2 + CI2 CH3SO2CI + CI
. .
Дата добавления: 2015-01-05; просмотров: 387; Мы поможем в написании вашей работы!; Нарушение авторских прав