
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Схема фазовых превращений однокомпонентных систем
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис. 4.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок – двухфазной газожидкостной области, левый участок – жидкой фазе. Отрезок пунктирной линии вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума – кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
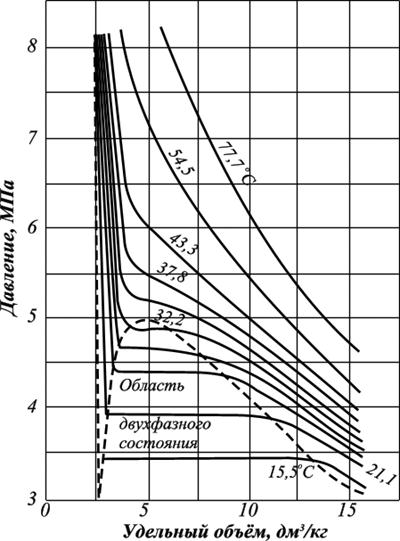
Рис. 4.1. Диаграмма фазового состояния чистого этана
Для индивидуальных углеводородов граничным давлением (при данной температуре) между жидкой и газовой фазой является давление упругости паров, при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью. Давление, при котором газ начинает конденсироваться, называется давлением насыщениядля газа.
Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис. 4.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С (рис. 4.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.

Рис. 4.2. Диаграмма фазового состояния чистого этана в координатах Т-Р
Из рисунка 4.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А (рис. 4.2), можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
Дата добавления: 2014-10-31; просмотров: 395; Мы поможем в написании вашей работы!; Нарушение авторских прав |