
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обменное или ионосорбционное.
1. Механическое – способность почвы, как пористого тела задерживать в своих порах различные соединения, размеры которых больше диаметра..
2. Физическое поглощение – способность тонкодисперсных частиц (илистых) удерживать на своей поверхности молекулы различных химических соединений за счет сил молекулярного сцепления.
3. Химическое поглощение – способность почв образовывать трудно растворимые соединения и закреплять различные питательные элементы в форме трудно-растворимых соединений.
Na2 SO4 + 2KCl→2NaCl+ K2 SO4
4. Обменное или ионосорбционное – это обмен ионов находящихся в коллоидных частицах на ионы, присутствующие в почвенных растворах.
ППК –почвенный поглотительный комплекс – совокупность или множество коллоидных частиц.
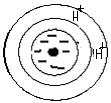 + Ca CO3 ↔
+ Ca CO3 ↔ 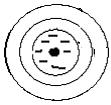 + H2CO3
+ H2CO3
Реакции: 1.обратимы, 2. Идут в эквивалентных отношениях, 3. быстротечность.
4. Биологическое поглощение – способность растительных и животных организмов поглощать из почвы различные химические элементы, накапливать в своих тканях и возвращать в землю после отмирания.
12. Кислотность почв: её природа, виды и значение.
- свойство почвы, обусловленное наличием водородных ионов в почвенном растворе и обменных ионов водорода и алюминия в почвенном поглощающем комплексе.
H+ - катион, носитель кислотных свойств.
H2O ↔ H+ + OH-
(кислотный св-ва) (щелочная)
1. В почве присутствуют неорганические минеральные кислоты HCl, H2SO4, HNO2 , и т.п.
HCl выделяется корнями растений. Они возникают в процессе выветривания (химического), а некоторые кислоты производятся растениями.
HCl ↔ H+ + Cl-
2. Присутствуют органические кислоты CH3 COOH → H+ + CH3COO- (уксусная кислота). Образуются в результате разложения опада.
3. Специфические кислоты – Гуминовые и фульвокислоты, входящие в состав гумуса → они могут диссоциировать → появляется катион Н.
H2CO3 (углекислота).
В лесных почвах много H+ → они кислые т.к. много фульвокислоты.
На кислотность сильно влияет углекислота:
1) H2CO3 ↔ H+ + HCO3-
2) H2CO3 ↔ 2H+ + CO3-
3) H2CO3 → CO2↑ и H2O
PH – это отрицательный логарифм концентрации катионов водорода.
H2O↔ H+ + OH-
1. [H+] = [OH-] = 10-7 г/ион / л H2O
2. [H+] = 10-7 г/ион / л H2O
3. Lg [H+] = -7
-Lg [H+] = 7 РН – отрицательный логарифм концентрации водорода.
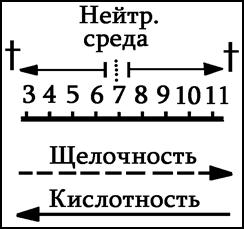 Пример: Рh = 3 и Рh = 6. Во сколько раз кислее? (ответ – в 1000 раз).
Пример: Рh = 3 и Рh = 6. Во сколько раз кислее? (ответ – в 1000 раз).
PH = 7
PH ∙ 7 = 10-7 = 1/ 10000000
PH ∙ 6 = 10-6= 1/ 1000000
PH ∙ 3= 10-3= 1/ 1000
Кислота у почв земного шара меняется от 3 (кислая) до 11 (щелочная) – солончаки.
Виды кислотности:
1. Актуальная (активная) кислотность обусловлена наличием свободных катионов водорода.
PH H2O актуальная кислотность.
2. Обменная кислотность – обусловлена наличием, как свободных катионов водорода, так и поглощенных катионов.
Раствор KCl H2O + KCl
(ППК) H+ + KCl (р-р) ↔(ППК) H+ K+ HCl
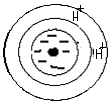
+ KCl↔  + HCl
+ HCl
3. Гидролитическая кислотность – обусловлена наличием, как свободных, так и всех поглощенных катионов водорода. Выражена в мг/экв. По ней определяют скольео надо внести извести.
Дата добавления: 2015-01-19; просмотров: 232; Мы поможем в написании вашей работы!; Нарушение авторских прав |