
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Глава 3. 3.1. Ионная химическая связь
СТРОЕНИЕ ВЕЩЕСТВА.
ХИМИЧЕСКАЯ СВЯЗЬ.
3.1. Ионная химическая связь
В Периодической системе элементов особняком стоят благородные газы. Это уникальные химические элементы, так как даже в форме простого вещества они существуют в виде отдельных атомов, не связанных друг с другом.
Некоторые химики до сих пор затрудняются ответить на вопрос, как рассматривать частицы благородных газов в простом веществе: как свободные атомы или как одноатомные молекулы. Нет однозначного мнения и о том, какой тип кристаллической решетки характерен для простых веществ этих элементов. По физическим свойствам это вещества с молекулярными кристаллическими решетками, а по составу — ...? Ведь силы межмолекулярного взаимодействия, удерживающие частицы в кристаллах, действуют между атомами.
Такое «равнодушное» отношение к образованию химических связей является «пределом мечтаний» для атомов всех других химических элементов, которые в виде свободных атомов встречаются очень редко, только в экстремальных условиях.
Почему же атомы благородных газов так самодостаточны? Проанализировав их положение в Периодической системе элементов, вы сами сможете назвать причину. Все дело в том, что атомы благородных газов содержат завершенный внешний электронный слой, на котором у атома гелия находятся два электрона, а у остальных — восемь. Атомы всех других элементов стремятся приобрести именно такую устойчивую электронную конфигурацию и часто достигают этого либо в результате присоединения электронов от других атомов (такой процесс в химии называют восстановлением), либо в результате отдачи своих внешних электронов другим атомам (процесс окисления). Атомы, присоединившие чужие электроны, превращаются в отрицательные ионы, или анионы. Атомы, отдавшие свои электроны, превращаются в положительные ионы, или катионы.
Понятно, что между противоположно заряженными катионами и анионами возникают силы электростатического притяжения, которые и будут удерживать ионы друг около друга, осуществляя тем самым ионную химическую связь.
! Ионная химическая связь — это связь, образовавшаяся между катионами и анионами за счет их электростатического притяжения.
Поскольку катионы образуются преимущественно атомами металлов, а анионы — атомами неметаллов, логично сделать вывод, что этот тип связи характерен для бинарных (двухэлементных) соединений, образованных типичными металлами (щелочными и щелочноземельными) и типичными неметаллами (галогенами, кислородом). Классическим примером веществ с ионной связью являются галогениды и оксиды щелочных и щелочноземельных металлов (рис. 3.1).
Схему образования ионной связи между атомами натрия и хлора можно представить так:

Два разноименно заряженных иона, связанных силами взаимного притяжения, не теряют способности взаимодействовать и с другими противоположно заряженными ионами. В результате образуются кристаллические соединения, состоящие из огромного числа ионов.
Кристаллические вещества характеризуются правильным расположением тех частиц (в нашем случае ионов), из которых они состоят, в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки. Понятно, что вещества с ионным типом связи имеют ионные кристаллические решетки (цв. вклейка, рис. 4).
Такие соединения представляют собой твердые, прочные, нелетучие вещества с высокими температурами плавления. При обычных условиях кристаллы таких веществ не проводят электрический ток, а растворы и расплавы большинства ионных соединений представляют собой прекрасные электролиты.
Вещества с ионными кристаллическими решетками хрупкие. Если попытаться деформировать такую кристаллическую решет ку, один из ее слоев будет двигаться относительно другого до тех пор, пока одинаково заряженные ионы не окажутся друг против друга. Эти ионы сразу начнут отталкиваться, и решетка разрушится. Отсюда и хрупкость ионных соединений.
| Са ) (Са2^) + 2е |

Ионные соединения — это не только бинарные соединения щелочных и щелочноземельных металлов. Это также соединения, образованные тремя и более элементами. Вы без труда сможете назвать их. Это все соли (цв. вклейка, рис. 5), а также гидроксиды щелочных и щелочноземельных металлов.
В заключение приведем классификацию ионов по разным признакам:
1) по составу различают простые (Na+, Сl-, Са2+) и сложные (ОН-, S042-, NH4+) ионы;
2) по знаку заряда различают положительные ионы, или катионы (Мn+, NH4+, Н+), и отрицательные ионы, или анионы (ОН-, анионы кислотных остатков);
3) по наличию гидратной оболочки различают гидратированные (например, синие ионы Си2+.4Н20) и негидратированные (например, неокрашенные ионы Си2+).
Все в нашем мире относительно. То же самое можно сказать и об ионной связи. Число соединений с ионным типом связи весьма ограничено, но даже в них чисто ионной связи не наблюдается. Например, отсутствуют «чистые» ионы натрия и хлора с зарядами +1 и -1 соответственно. Истинный заряд этих ионов составляет +0,8 и -0,8. Следовательно, даже в соединениях, которые рассматривают как ионные, в некоторой степени проявляется ковалентный характер связи. И, наконец, относительной истиной является утверждение о том, что ионная связь — это результат взаимодействия самых типичных металлов с самыми типичными неметаллами. Например, соли аммония, образованные за счет ионной связи между катионами аммония и анионами кислотного остатка (например, NH4Cl, NH4NO3), имеющие ионную связь, состоят исключительно из неметаллов.
? 1. Почему благородные газы раньше относили к нулевой группе Периодической системы? Почему сейчас их относят к восьмой группе? Какие металлы по аналогии называют благородными? Почему?
2. Напишите электронную конфигурацию внешнего слоя атомов благородных газов, галогенов, щелочных металлов.
3. Дайте определение понятия «катион». Какие группы катионов вы знаете?
4. Дайте определение понятия «анион». Какие группы анионов вы знаете?
5. Исходя из понятий «катион» и «анион» дайте еще одно определение ионной связи.
6. Составьте схемы образования ионной связи для веществ: CaF2, Li20, KCl.
7. Дайте определение понятий «кристаллическая решетка», «ионная кристаллическая решетка».
8. Какими физическими свойствами характеризуются вещества с ионными кристаллическими решетками?
9. Среди перечисленных веществ: KCl, AlCl3, BaO, Fe2O3, Fe2(S04)3, H2S04, Si02, NH3 — определите соединения с ионной кристаллической решеткой.
10. Не проводя расчеты, определите, в каком из соединений: NaCl, KCl, LiCl, CaCl2 — массовая доля хлора выше. Вывод подтвердите расчетами.
11. Определите формулу ионного соединения, массовые доли элементов в котором составляют: кальция 24,39 %, азота 17,07%, кислорода 58,54%.
3.2. Ковалентная химическая связь.
Альтернативным путем построения устойчивой конфигурации из восьми (для водорода — двух) электронов является их обобществление, т.е. предоставление в совместное пользование. В результате такого процесса образуются Общие электронные пары, которые играют роль «связующей нити» между атомами, образующими химическую связь.
! Химическая связь между атомами, возникающая путем обобществления электронов с образованием общих электронных пар, называется ковалентной.
Образование общей электронной пары может происходить двумя способами.
При сближении двух атомов, имеющих неспаренные электроны, происходит взаимное проникновение соответствующих электронных орбиталей, их перекрывание. В месте перекрывания образуется так называемая электронная плотность, т.е. область пространства, где вероятность нахождения электрона значительно увеличивается. Область перекрывания условно считают обшей электронной парой двух атомов. Такой механизм образования ковалентной связи называют обменным.
Обменный механизм, например, реализуется при образовании химической связи в молекуле водорода Н2. Атомы водорода передают в общее пользование друг другу свои единственные неспаренные электроны, тем самым получая завершенный энергетический уровень из двух электронов, подобный атому инертного газа гелия. Образующаяся электронная пара в равной мере принадлежит обоим атомам:
Н. + .Н → Н : Н или Н-Н
 |
Атомы хлора также содержат по одному неспаренному электрону. За счет их спаривания и происходит образование химической связи, т.е. обшей электронной пары в молекуле хлора С12:
В обоих приведенных примерах ковалентной связью связаны атомы одного и того же элемента. Общая электронная пара в равной мере принадлежит обоим атомам.
! Ковалентная связь, образующаяся между атомами одного и того же элемента, называется неполярной.
Обобществлять электроны с образованием ковалентной связи могут атомы разных элементов. В этом случае необходимо принимать во внимание такое свойство химического элемента, как элек-троотрицательность.
! Электроотрицательностью называют свойство атомов элемента оттягивать к себе общие электронные пары.
Важнейшие элементы-неметаллы можно расположить в следующий ряд по усилению их электроотрицательности:
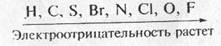
Рассмотрим образование ковалентной связи в молекуле аммиака. Атом азота содержит на внешнем энергетическом уровне пять электронов в полном соответствии с номером группы, из которых три электрона неспаренные (чтобы определить число неспаренных электронов, нужно от заветной восьмерки отнять число внешних электронов, в нашем случае: 8 - 5 = 3).
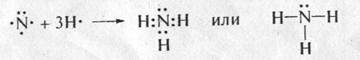 |
Химические связи в молекуле аммиака образуются за счет образования трех электронных пар между тремя атомами водорода и одним атомом азота:
Атом азота значительно более электроотрицателен, чем водород, поэтому в большей степени притягивает к себе общие электронные пары. В результате такого смещения атом азота приобретает частичный отрицательный заряд δ-, атомы водорода — частичный положительный заряд δ+.
! Ковалентная химическая связь между атомами с различной электроотрицательностью называется полярной.
Во всех приведенных выше примерах химическая связь осуществляется за счет одной общей пары электронов. Однако атомы способны образовывать также две или три общие электронные пары, например в молекулах оксида углерода(IV) или азота:
 |
Число общих электронных пар определяет кратность ковалентной связи, которая бывает одинарной, двойной, тройной. Так, в молекуле Н2 или NH3 связи одинарные, в молекуле СО2 — две двойные связи, в молекуле N2 — одна тройная связь.
Другой возможный механизм возникновения общей электронной пары рассмотрим на классическом примере образования катиона аммония.
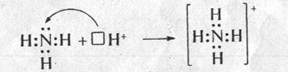 |
В молекуле аммиака каждый атом дополнил свою электронную оболочку до конфигурации благородного газа: атом азота получил восемь электронов, атомы водорода — по два электрона. При этом у атома азота осталась неподеленная пара электронов, за счет которой он может образовать четвертую химическую связь с катионом водорода, т.е. частицей, вообще лишенной электронов. При этом механизм возникновения четвертой связи N—Н иной. Атом азота, предоставивший для образования связи пару электронов, называют донором, а катион водорода, предложивший пустую орбиталь — акцептором. Получившаяся при этом частица несет положительный заряд и называется катионом аммония:
Такой механизм образования ковалентной связи называют донорно-акцепторным. Все четыре связи N —Н в катионе аммония абсолютно равноценны, невозможно различить, какая из них образована по донорно-акцепторному, а какая — по обменному механизму.
Вещества с ковалентным типом связи в твердом состоянии образуют кристаллические решетки двух типов: атомные и молекулярные.
Кристаллические решетки, в узлах которых расположены атомы, называют атомными. Вещества с атомной кристаллической решеткой характеризуются большой прочностью и твердостью, высокой температурой плавления, они нелетучи, без химического взаимодействия практически не растворяются ни в каких растворителях. Примерами таких веществ могут служить алмаз, кварц Si02, оксид алюминия, карборунд SiC.
Кристаллические решетки, в узлах которых расположены молекулы вещества, называют молекулярными. Внутримолекулярные ковалентные связи достаточно прочны, но отдельные молекулы соединены между собой довольно слабыми межмолекулярными силами. Поэтому молекулярная решетка самая непрочная среди всех типов решеток. Такие вещества имеют небольшую твердость, сравнительно низкие температуры плавления; они летучи. Примерами соединений с молекулярной кристаллической решеткой могут служить вода, йод, углекислый газ, уксусная кислота, сахароза.
Все аллотропные модификации углерода, в том числе и наиболее известные — алмаз и графит, имеют атомные кристаллические решетки (цв. вклейка, рис. 6, 7).
? 1. Дайте определение ковалентной связи. Какие два механизма ее образования вы знаете? Приведите примеры, напишите схемы.
2. Дайте определение ковалентной неполярной связи. Приведите примеры, напишите схемы.
3. Дайте определение ковалентной полярной связи. Приведите примеры, напишите схемы образования ковалентной связи по обменному и донорно-акцепторному механизму.
4. Какие типы связей характерны для следующих вешеств: Вг2, НВг, КВг? Напишите схемы их образования.
5. Как различают ковалентные связи по кратности? Какие связи образуются в следующих соединениях: SО2, H2S, HCN? Напишите структурные формулы этих веществ.
6. Не проводя расчетов, укажите, в каком из оксидов серы: SО2 и SO3 — содержание серы максимально. Вывод подтвердите расчетами.
7. При сжигании 24 г углерода получено 33,6 л углекислого газа. Какова массовая доля примесей в образце углерода?
8. Можно ли рассматривать ионную связь как ковалентную? Почему?
3.3. Металлическая химическая связь
Атомы металлов характеризуются тремя отличительными особенностями.
Во-первых, они имеют 1—3 электрона на внешнем энергетическом уровне. Однако у атомов олова и свинца валентных электронов четыре, у сурьмы и висмута — пять, у полония — шесть. Почему же эти элементы являются металлами? Очевидно, начинает сказываться вторая отличительная особенность строения атомов металлов — их сравнительно большой радиус. Наконец, в-третьих, атомы металлов имеют большое число свободных орбиталей. Так, у атома натрия, например, один внешний валентный электрон располагается на третьем энергетическом уровне, который имеет девять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов их свободные орбитали могут перекрываться, и валентные электроны получают возможность перемешаться с орбитали одного атома на свободную и близкую по энергии орбиталь соседних атомов. Атом, от которого «ушел» электрон, превращается при этом в ион. В результате этого в металлическом изделии или кусочке металла формируется совокупность свободных электронов, которые непрерывно перемещаются между ионами. При этом, притягиваясь к положительным ионам металла, электроны вновь превращают их в атомы, затем снова отрываются, превращая последние в ионы, и так происходит бесконечно. Следовательно, в простых веществах металлах реализуется бесконечный процесс превращения атом  ион, который осуществляют валентные электроны, а частицы, из которых состоят металлы, так и называют атом-ионами:
ион, который осуществляют валентные электроны, а частицы, из которых состоят металлы, так и называют атом-ионами:
 |
Такая же картина наблюдается и в металлических сплавах.
! Металлической связью называют связь в металлах и сплавах между атом-ионами металлов, осуществляемую совокупностью валентных электронов.
Металлическая связь определяет и особое кристаллическое строение металлов и сплавов — металлическую кристаллическую решетку, в узлах которой расположены атом-ионы.
Металлическая кристаллическая решетка и металлическая связь обусловливают и все наиболее характерные свойства металлов: ковкость, пластичность, тягучесть, электро- и теплопроводность, металлический блеск, способность к образованию сплавов.
Пластичностью объясняется способность металлов расплющиваться при ударе или вытягиваться в проволоку под действием силы. Это важнейшее механическое свойство металлов лежит в основе уважаемой большинством народов мира профессии кузнеца. Недаром среди богов разных верований почти единственным рабочим богом был бог огня, покровитель кузнечного ремесла: у греков — Гефест, у римлян — Вулкан, у славян — Сварог. Пластичность металла объясняется тем, что под внешним воздействием слои атом-ионов в кристаллах легко смещаются, как бы скользят друг относительно друга без разрыва связи между ними. Некоторое представление об этом вам может дать простейший опыт. Если между двумя плоскими стеклянными пластинками, например между зеркальцами, поместить несколько капель воды, то зеркальца будут легко скользить друг по другу, а вот разъединить их будет довольно трудно. В нашем опыте вода играет роль совокупности электронов металла.
Наиболее пластичны золото, серебро и медь. Из золота можно изготовить самую тонкую фольгу толщиной всего 0,003 мм. Такие тонкие листочки фольги используют для золочения изделий, например деревянной резьбы. Художественные изделия из золота, созданные благодаря его пластичности, дошли до нас через тысячелетия (цв. вклейка, рис. 8).
Высокая электрическая проводимость металлов как раз и обусловлена наличием в них совокупности подвижных электронов, которые под действием электрического поля приобретают направленное движение. Лучшими проводниками электрического тока являются серебро и медь. Немного уступает им алюминий. Однако в большинстве стран все чаще и чаще провода изготавливают не из меди, а из более дешевого алюминия. Хуже всего электрический ток проводят марганец, свинец и ртуть, а также вольфрам и некоторые подобные ему тугоплавкие металлы. Электрическое сопротивление вольфрама настолько велико, что он начинает светиться при прохождении через него тока, что используют для изготовления нитей ламп накаливания (рис. 3.2).
Аналогично электропроводности изменяется и теплопроводность металлов, которая также объясняется высокой подвижностью электронов, которые, сталкиваясь с колеблющимися в узлах решетки ионами металлов, обмениваются с ними тепловой энергией. С повышением температуры эти колебания ионов с помощью электронов передаются другим ионам, и температура металла быстро выравнивается. О практическом значении этого свойства вы можете судить по кухонной металлической посуде.

|
Гладкая поверхность металла или металлического изделия характеризуется металлическим блеском, который является результатом отражения световых лучей. Высокой световой отражательной способностью обладают металлы: ртуть (из нее раньше готовили знаменитые венецианские зеркала), серебро, палладий и алюминий. Из последних трех металлов изготавливают зеркала, прожекторы и фары.
В порошке металлы теряют блеск, приобретая черную или серую окраску, и только магний и алюминий сохраняют его. Поэтому из алюминиевой пыли изготавливают декоративное покрытие — краску «серебрянку». Отраженный поверхностью металлов свет и определяет серебристо-белый цвет большинства металлов, так как они рассеивают в равной степени все лучи видимой части спектра. А вот золото и медь поглощают в большей степени лучи с короткой длиной волны, близкие к фиолетовым, отражая при этом длинноволновые лучи, а потому и окрашены соответственно в желтый (червонный) или красно-желтый (медный) цвета. Посмотрите на рис. 9 на цветной вклейке, где представлены изготовленные природой причудливые самородки металлов, имеющие соответствующую окраску.
Еще в глубокой древности люди заметили, что сплавы обладают другими, нередко более полезными свойствами, чем составляющие их чистые металлы. Поэтому в чистом виде металлы используют редко. Чаще применяют их сплавы. Из чуть более 80 известных металлов получены десятки тысяч различных сплавов. Например, у первого полученного человеком сплава — бронзы прочность выше, чем у составляющих се меди и олова. Сталь и чугун прочнее чистого железа. Чистый алюминий — очень мягкий металл, сравнительно непрочный на разрыв. Но сплав, состоящий из алюминия, магния, марганца, меди, никеля, называемый дюралюминием, в 4 раза прочнее алюминия на разрыв, а потому его образно называют «крылатым металлом» и используют для изготовления конструкций самолетов (рис. 3.3).

Кроме большей прочности сплавы обладают и более высокой коррозионной стойкостью и твердостью, лучшими литейными свойствами, чем чистые металлы. Так, чистая медь очень плохо поддается литью, в то же время оловянная бронза имеет прекрасные литейные качества — из нее отливают художественные изделия, которые требуют тонкой проработки деталей. Чугун — сплав железа с углеродом — также великолепный литейный материал.
Кроме высоких механических качеств сплавам присущи свойства, которых нет у чистых металлов. Например, нержавеющая сталь — сплав на основе железа — обладает высокой жаропрочностью и коррозионной стойкостью даже в агрессивных средах.
 Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов и сплавов.
Начавшаяся примерно 100 лет назад научно-техническая революция, затронувшая и промышленность, и социальную сферу, также тесно связана с производством металлов и сплавов.
На основе вольфрама, молибдена, титана и других металлов начали создавать устойчивые к коррозии, сверхтвердые и тугоплавкие сплавы, применение которых значительно расширило возможности машиностроения. В ядерной и космической технике (рис. 3.4) из сплава вольфрама и рения делают детали, работающие при температуре до 3000 0С.
В медицине используют хирургические инструменты и имплантаты из сплавов тантала и платины.
? I. Какими особенностями характеризуется строение атомов металлов? Какое положение в таблице Менделеева занимают металлы?
2. Дайте определение металлической связи. Что общего у нее с ионной и ковалентной связями?
3. Какое строение имеет металлическая кристаллическая решетка? Сравните ее с ионной и атомной кристаллическими решетками.
4. Какие физические свойства металлов определяются их кристаллическим строением?
5. Назовите жидкий при обычных условиях металл. Какие правила техники безопасности необходимо соблюдать при работе с предметами, содержащими этот металл?
6. В состав бронзы входят 20% олова и 80% меди. Рассчитайте массу каждого компонента бронзы, необходимой для изготовления скульптуры массой 200 кг. Какое количество вещества каждого металла потребовалось для этого?
7. Плотность металлического золота равна 19 г/см3. Определите площадь золотой пленки толщиной 0,003 мм, которую можно изготовить из кусочка металла массой 3 г.
8. Для получения металлической меди используют два ее природных оксида, содержащих соответственно 89 и 80 % металла. Определите формулы оксидов.
9. В знаменитом легкоплавком сплаве Вуда с температурой плавления всею 62 0С массовая доля висмута в два раза больше, чем свинца; массовая доля свинца в два раза больше, чем олова; а массовая доля кадмия равна массовой доле олова. Рассчитайте массовые доли металлов в сплаве.
3.4. Водородная химическая связь
Рассмотрением водородной связи завершаем знакомство с типами химической связи. И эо не случайно.
Во-первых, водородная связь — предмет нескончаемых дискуссий между физиками и химиками, с различных точек зрения рассматривающих этот тип связи. Физики утверждают, что это разновидность межмолекулярного взаимодействия, имеющего физическую природу, и аргументируют тем, что энергия такой связи составляет всего лишь 4 —40 кДж/моль. Большинство химиков придерживаются иной точки зрения, которая будет изложена ниже.
Во-вторых, рассмотрение водородной связи позволит сравнить эту связь с другими типами и тем самым обобщить наши предоставлении о природе химической связи вообще.
В-третьих, это самая значимая на нашей планете химическая связь, ибо она определяет структуру тех соединений, которые являются носителями жизни на Земле, отвечают за хранение и воспроизведение наследственной информации живых организмов.
Все изученные ранее типы химической связи имеют названия, в основу которых положены обобщенные химические понятия: ионы, атомы, металлы. А «водородная связь» — специфический термин, ассоциирующийся с конкретным химическим элементом — водородом. Очевидно, это связано со спецификой строения атома водорода, имеющего один валентный электрон. Участвуя в образовании химической связи, этот электрон обнажает крошечное ядро атома водорода, представляющее собой ни что иное как протон.
! Химическую связь между атомами водорода одной молекулы и атомами электроотрицательных элементов (фтором, кислородом, азотом) другой молекулы называют водородной.
Межмолекулярная водородная связь объясняет тот факт, что вещества с небольшими относительными молекулярными массами при обычных условиях представляют собой жидкости (вода, спирты — метиловый, этиловый, карбоновые кислоты — муравьиная, уксусная) или легко сжижаемые газы (аммиак, фтороводород).
Механизм образования водородной связи имеет двойную природу. С одной стороны, он состоит в электростатическом притяжении между атомом водорода с частичным положительным зарядом и атомом кислорода (фтора или азота) с частичным отрицательным зарядом. С другой стороны, в образование водородной связи вносит свой вклад и донорно-акцепторное взаимодействие между почти свободной орбиталью атома водорода и неподеленной электронной парой атома кислорода (фтора или азота). Например, вода ассоциирована в жидкость за счет водородных связей, возникающих между молекулами-диполями:

В жидкой воде образуется множество водородных связей между молекулами.
Способность некоторых газов за счет образования водородных связей легко сжижаться и вновь переходить в газообразное состояние с поглощением теплоты позволяет использовать их в качестве хладагентов в промышленных холодильных установках. Наиболее широко применяется в этой роли аммиак:
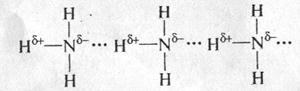
Именно водородными связями объясняются аномально высокие температуры кипения (100°С) и плавления (0 0С) воды. При этом, в отличие от большинства других жидкостей плотность воды при переходе в твердое состояние (лед, снег) не увеличивается, а уменьшается. Это объясняет тот факт, что лед легче воды и не тонет в ней, а потому водоемы не промерзают зимой до дна, тем самым сохраняя жизнь водным обитателям.
Водородные связи в немалой степени способствуют образованию кристаллов в виде бесконечного разнообразия снежинок.
Все рассмотренные выше примеры касались такой разновидности водородной связи, которая называется межмолекулярной водородной связью. Однако еще более важна в организации структур жизненно важных молекул внутримолекулярная водородная связь. Эта связь определяет вторичную структуру белковых молекул.
 Белковая молекула представляет длинную полимерную цепочку, закрученную в спираль. Витки этой спирали удерживаются от раскручивания за счет водородных связей между атомами водорода и кислорода участков первичной структуры белковой молекулы.
Белковая молекула представляет длинную полимерную цепочку, закрученную в спираль. Витки этой спирали удерживаются от раскручивания за счет водородных связей между атомами водорода и кислорода участков первичной структуры белковой молекулы.
Будучи очень нежной и уязвимой водородная связь в белках может легко разрушаться — белки денатурируют. Такая денатурация может быть обратимой и необратимой.
Обратимая денатурация белковых молекул имеет социальное значение. Так, денатурирующими факторами белков человеческого организма могут служить механические воздействия (работники дорожных служб, шахтеры, горняки и другие специалисты, использующие вибрирующие инструменты), действие высоких температур (рабочие горячих цехов — металлурги (рис. 3.5), стекловары и т.д.), электромагнитное излучение (врачи-рентгенологи, работники АЭС), химическое воздействие (работники химических производств). А потому, все перечисленные категории работников для компенсации вредного воздействия условий труда на организм пользуются предусмотренными законодательством Российской Федерации льготами: имеют сокращенный рабочий день, большую продолжительность оплачиваемого отпуска, специальное питание, более ранний выход на пенсию, более высокую заработную плату.
Необратимая денатурация хорошо вам известна по процедуре варки яиц или приготовления мяса, рыбы и других белковых продуктов.
О том, как денатурирующие факторы приводят к разрушению природной структуры белковых молекул, можно судить по несложным опытам. Если к раствору белка куриного яйца прилить немного этилового спирта или соли тяжелого металла (медного купороса, нитрата свинца(II)), можно будет заметить выпадение осадка вследствие денатурации белка. Аналогичным действием обладает никотин, очень крепкий чай и кофе. Может быть, эти опыты помогут вам понять, как губительны такие вредные привычки, как курение, употребление спиртного и др.
? 1. Дайте определение водородной связи. Какую точку зрения — физиков или химиков — вы разделяете по вопросу ее природы?
2. Каков механизм возникновения водородной связи? Какие виды водородной связи вы знаете?
3. Какими особыми свойствами обладают вещества с межмолекулярной водородной связью?
4. Какую роль играет межмолекулярная водородная связь в практической жизни человека и в природе?
5. Какую роль играет внутримолекулярная водородная связь в организации структуры белков?
6. В чем, по-вашему, состоит социальная роль водородных связей? Ответ проиллюстрируйте примерами из практической жизни человека.
7. Приготовьте сообщение о химической природе негативных последствий курения и употребления алкоголя для организма человека.
Дата добавления: 2015-01-19; просмотров: 1890; Мы поможем в написании вашей работы!; Нарушение авторских прав |