
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гликолиз. Р-ции. Регуляция.
Реакции:
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АТФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГТФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неоганич.
Регуляция гликолиза: гликолиз стимулир-ся инсулином, повышающим кол-во молекул гексокиназы, фосфофруктокиназы, пируваткиназы. В печени активность глюкокиназы регулир-ся гормонами: активацию вызывает инсулин и андрогены, подавляют ее активность глюкокортикоиды и эстрогены.
57. Пентозофосфатный путь (ПФП)-это альтернативный путь окисл-я гл-зы в печени, мол.ж-зе и жир.тк. Фер-ты этого пути распол-ны в цит-ме. Сост.из 2 этапов: окисл-го и неокисл-го. В завис-ти от необх-ти он может осущ-ся по циклич-му или шунтирующему пути. Один из вариантов стехиометрии предпол., что из 3 мол-л гл-зо-6-фосфатов образ-ся 3 мол-лыCO2 и 3 мол-лы пяти углеродн.сахаров. Пентоза превр-ся 2 мол-лы глюкозо-6-фосфата и 1 мол-лу глицеральдегид фосфат. Акцептором протонов и электронов служит НАД. Р-ции:1)Гл-зо-6-фосфат при участии фермента гл-зо-6-фосфат дегидрогеназа в присутствии НАДФ и кофакторовMn2+или Ca2+ обратимо превр-ся в 6-глюконолактон. Из него образ-ся 6-фосфоглюконат (фермент глюконолактонгидролаза). Кофакторы те же. 2)6-фосфоглюконат окисл-ся 6 фосфоглюконатдегидрогеназой кофермент НАДФ, кофакторыMn2+, Ca2+. В обратим.р-ции до 3-кето-6-фосфоглюконата, при декарбоксилировании которого обр-ся рибулоза-5-фосфат.3)Фермент рибулозо-5-фосфат эпимераза изм-т конфигурации мол-лы в обл.3 углер.атома превращая рибулозо-5 фосфат в ксилулозо-5-фосфат (обрат.р-ция). Альтер-но фермент рибозо-5-фосфат кетоизомераза обратимо превращает в рибулозо-5-фосфат в рибозо-5-фосфат.4)Транскетолаза при помощи тиаминпирофосфата и Mg2+переносят 1 и 2 атомы углерода. Ксилозо-5-фосфат на рибозо-5-фосфат, в рез-те чего образ-ся седогетулозо-7-фосфат и глицеральдегид-6-фосфат.5)Трансальдолаза катализирует перенос 3-х углер.части седогептулозо-7-фосфат на глицеральдегид-3-фосфат с образованием фруктозо-6-фосфата и эритрозо-4фосфата.6)Транскетолаза при помощи тиамин пирофосфата и Mg2+ переносит 1-й и 2-ой атомы углерода ксилулозо-5-фосфата на эритрозо-4-фосфат с образованием фр-зо-6-фосфата и глицеральдегид-3- фосфата. Значение ПФП:1.Он является главным источником восстановит-го экв-та НАДФН(Н+),который исполь-ся в биосинтезах,а также в реакциях нейтромирации активн.форм кислорода. 2.В ходе р-ций обр-ся рибоза-5-фосфат,который исп-ся для синтеза нукл к-т и носителей Е.(нуклеотидов). 3.В неокислит.части обр-ся сложн.сахара используемые при образование компонента межклеточного матрикса, углеводных компонентов рецептора и тд.
58. Биосинтез углеводов в тканях. Реакции глюконеогенеза и гликогеногенеза, углеводные и неуглеводные источники для глюконеогенеза, взаимоотношение процессов синтеза и распада гликогена. Биосинтез углеводов в тканях происходит аэробным (с доступом кислорода) и анаэробным (без доступа кислорода) путями. Анаэробный путь- гликолиз и гликогенолиз. Гликолиз- процесс распада глюкозы, протекающий без потребления О2 .Конечный продукт- молочная к-та. В процесс гли-за образуется АТР. Суммарное ур-ие гли-за:C6H12+2АДФ+2Фн ->2CH3CH(OH)COOH+2H2O. Благодаря гликолизу организм человека опред-ый период может осуществлять ряд физиологических ф-ий в условиях недостаточности О2. Его ферменты способны связываться с мышечными белками. Гликогенолиз- расщепление начинается с гликогена. Начальная реакция - фосфорилиз гликогена- расщепление с присоединением фосфор. к-ты. В печени и почках имеется фермент- глюкоза-6- фосфотаза. Образовавшаяся глюкоза выходит из клетки в кровь. Это заключит. Стадия гликогенолиза в печени, приводящего к повышению содержания глюкозы в крови. Аэробный путь - окисление глюкозы до СО2 и Н2О, пируват проникает в митохондрии, где полностью окисляется до СО2 и Н2О. Если содержание кислорода недостаточно, то пируват превращается в лактат.Аэробный распад глюкозы можно выразить суммарным уравнением: С6Н12О6 + 6 О2 → 6 СО2 + Н2О + 2820 кДж/моль. Глюконеогенез -это образование глюкозы из таких неуглеводных предшественников лактата, циклокарбоновых к-т, глицерола, пропиата. Состоит из 10 р-ций- необратимые: 1,4,11,13, остальные обратимые.
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АТФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГТФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неоганич.
59. Биосинтез и распад гликогена. Регуляция обмена гликогена. Гликоген- разветвлённый полимер глюкозы. Наибольшая его концентрация обнаружена в печени и мышцах. Поскольку мышечная масса организма человека велика, то большая часть гликогена организма содержится в мышцах. Глюкоза из крови легко проникает в клетки органов и тканей, проходя ч/з биологические мембраны клеток. Как только глюкоза поступает в клетку, она метаболизируется в ней в результате первой химической реакции. Фосфорилирование глюкозы происходит в присутствии АТФ и фермента - гексокиназы. Глюкоза превращается в глюкозо-6-фосфат . Этот эфир глюкозы теперь будет использоваться в анаболических и катаболических реакциях. Глюкоза из клетки может выйти только после реакции гидролиза при участии глюкозо-6-фосфатазы. Этот фермент есть в печени, почках, эпителии кишечника. В других органах, тканях его нет. Процесс биосинтеза гликогена протекает в 4 стадии. Ферменты:1) фосфорилаза, 2) фосфоглюкомутаза, 3) глюкоза-6-фосфатаза, 4) глюкокиназа, 5) глюкозо-1-фосфатуридил трансфелаза, 6) гликоген-синтетаза. Основная часть гликогена нах-ся в печени и истощается за сутки. Фермент гликогенсинтетаза катал-ся присоединением глюкозы. И сущ-ет в 2 формах: А) активная (дефосфолирована).Б) неактивная (фосфолирована). Фосфолирование катал-ся протеинкиназами, там присоединяется АМФ, синтез которой стим-ся адреналином и глюкагоном. Переход из активной формы в неактиную актив-ся гидрокартизоном, инсулином, глюкозой и ИНГИБИРУЕТСЯ гликогеном. Глюкоза подвергается фосфолированию при участии фермента гексокиназы, а в печени- глюкокиназы. глюкозо-6-фосфат->(фосфоглюкомутазыа) глюкозо-1-фос-фат. Сущ-ет 2 стадии- 1)Стадия синтеза глюкозо-1-фосфата: глюкозо-1-фосфат+УТФ (уридинтрифосфат)-> (УДФ-глюкоза) + пирофосфат. 2)стадия образования гликогена. C6H12O6->(гексокиназа)глюкоза-6-фосфат->(фосфомутаза)глюкоза-1-фосфат. Распад- это процесс расщепления гликогена. Сущ-ет 2 пути распада: 1)Гидролитический- осуществ-ся под действием фермента амилазы в печени в присутствии воды и выделяется свободная глюкоза. 2)Фосфоролитический- катализ-ся ферментом фосфорилазой. Это расщепление энергетически выгодно, т.к освободжается фосфолиривонная глюкоза. Главные ферменты, контролирующие метаболизм гликогена –гликогенфосфорилаза и гликогенсинтаза.
60. Глюконеогенез Регуляция. Реакции и роль в обмене вещ-в. Глюконеогенез -это образование глюкозы из таких неуглеводных предшественников,как лактата,промеж.продукты циклокарбон. К-т,глицерола,пропиата.
Реакции: Необратимые: 1,4,11,13 !!!!
1)2ПВК+2АТФ+2СО2->(пируваткарбоксилаза)2 оксалоацетат+2фосфат неорганич.+2 АДФ
2)2 ацелоацетат+ 2 НАДН(Н+)->(малатдегидрогеназа) 2 малат+2НАД+
3)2 малат +2НАД+->(малатдегидрогеназа)2 ацелоацетат+2НАДН(Н+)
4)2 оксалоацетат+2 ГТФ->(фосфоенол-пируват-карбоксикиназа)2 фосфоенол-пируват+2ГДФ
5)2 фосфоенол-пируват->(енолаза)2 фосфоглицерат
6)2 фосфоглицерат->(фосфоглицератмутаза) 2 3-фосфоглицерат
7)2 3-фосфоглицерат +2АТФ->(фосфоглицераткиназа)2 1,3-дифосфоглицерат +2 АДФ
8)2 1,3-дифосфоглицерат +2 НАДН(Н+)->(глицеральдегид-3-фосфат-дегидрогеназа) 2 глицеральдегид-3-фосфат+2 фосфат нерганич.
9)Глицеральдегид-3-фосфат->(триозофосфат-изомераза) дигидрокси ацетон фосфат
10)Глицеральдегид-3-фосфат+дигидрокси-ацетон-фосфат->(фруктозодифосфат-альдалаза) фруктозо-1,6-дифосфат
11)Фруктозо-1,6-дифосфат+Н2О->(фруктозодифосфатаза) фруктозо-6-фосфат+фосфат неорганич.
12)Фруктозо-6-фосфат->(фосфоглико-изомераза) глюкозо-6-фосфат
13)Глюкозо-6-фосфат + Н2О->(глюкозо-6-фосфатаза) глюкоза+ фосфат неорганич.
Регуляция глюконеогенеза: Превращение метаболитов в глюконеогенезе связаны так,что один процесс активен,а второй неактивен. А вообще термодинамически выгодна их одновременная активация. 1.Ацетил-КоАактивирует,а АДФ ингибирует пируваткарбоксилазу(первый фермент глюконеогенеза). Когда в клетке накапливается митохондриальный ацетил-КоА,биосинтез глюкозы из пируватаусиливается.,одновременно подавляются окислительные декарбоксилирования пирувата. Скорость глюконеогенеза зависит от концентрации лактата и других предшественников глюкозы 2. Фруктоза-1,6-бисфосфотаза ингибируется АМФ. В тоже время АМФ является аллостерическим
активатором фосфофруктокиназы. При низкой концентрации АМФ и высокой концентрации АТФ происходит стимуляция глюконеогенеза. А когда величина АМФ низкая,в клетке наблюдается расщепление глюкозы. Фруктозо-2,6-бисфосфатаза активирует фосфо-фруктокиназу и ингибирует фруктозодифосфатазу
Роль глюконеогенеза в обмене углеводов: глюконеогенез не только обеспечивает органы и ткани глюкозой, но еще и перерабатывает образующийся в тканях лактат, препятствуя тем самым развитию лактат-ацидоза.
61. Нарушение обмена углеводов.Выделяют след.основныенарушения обмена угл-ов:1.гипер-и гипогликимия.2.болезни накопления гликогена. 3.гликозурия. 4.галактозимия. 5.лактозурия .6.мальтозурия. 7.фруктозурия-причиной может быть:а)фруктозная нагрузка;б)дефицит фруктокиназы (неспособность потреблять фруктозу);в)недостаток или частич. Неактивность фруктозодифосфатальдолазы в печени;следствие накопление фруктозо-1-фофата блокирующего потребление глюкозы.
Норм.конц.глюкозы в крови 3,3-6 ммоль/л.Гипергликимия может быть вызвана избыт.кол-ом глюкозы в пищи или сах.диабетом.Сах.диабет бывает первичн. или вторичный. 1.Первичный (идиопатический) подраздел.на: а)потенциальный(фамильная предрасположенность); б)латентный (скрытый)-проявл.при лечении картизоном, острых инфекциях, беременности;характерен диабетический тип кривой сахарной нагрузки; в)асимптоматический (химич) г)клинический-делится на:-первого типа-инсулинзависимый (ювенильный)-проявл.в первые 40 лет жизни и хар-ся резким снижением секреции инсулина вследствие атрофии бета-клеток.-второго типа-инсулин-независимый. Поражает людей тарше 40 лет,хар-сянекот.снижениемсекреции инсулина. 2.Вторичный. Причины: а)поврежд.поджел. железа, прихронич. панкреатите,опухолях и др.очевидныхзаболеваниях; б)присутствие антаганистовинсулина: избыточная секреция гормона роста или глюкокартикоидов; в)ингибирование секреции инсулина:секреция инсулина бета-клетками может подавляться при избыт.продуктахнорадреналина,что приводит к мобилизации гликогена в печени.Адреналин и норадреналин блокируют секрецию инсулина.Др.причины диабелта:1.частичное нарушение норм.структуры инсулина;2.повыш.уровень секреции инсулиназы; 3.частичн. наруш.норм. структуры инсулиновых рецепторов.Гипогликимия делится на:а)гипогликимияголодание. Причины: инсулинсекретирующие опухоли (поджел.железа), недостаточн.ф-ии гипофиза и надпочечников,болезни печени и болезни накопления гликогена.б)реактивная гипогликимия. Причины: передоз. инсулина, физич.нагрузка,прием лекарственных препаратов, приемалкоголя, частичная реакция желудка. Такое состояние может вызвать сульфанилмочевина.Глюкозурия делится на:1.алиментарная(избыток глюкозы в пище);2.эмарганальная(стресс).Др.причины.1.действие хим. препаратов(морфин,хлороформ); 2.диабет;3.низкий порог ренальной реабсорбции;4.остр.инфекции,сотряс.мозга.
62. Гликогенозы, причины, сущность, проявления заболевания. Значение нарушений активности глюкозо-6-фосфотазы, кислой альфа-глюкозидазы, фосфорилазы, фосфоглюкомутазы, фосфофруктокиназы. Болезнь Гирке. Гликогеноз - группа наслед. Заболеваний, харктеризующихся отложением в тканях либо большим кол-вом гликогена, либо необычным его видом. Сущ-ет 7 типов болезней гликогеноза: 1тип- болезнь Гирке- в печени, почках много гликогена, отсутствует повышение уровня глюкозы в крови. В печени, почках, кишечнике либо отсутствует либо низкое содержание глюкозо-6-фосфотазы. 2тип- болезнь Помпа- отсуствует глюкозидаза- она предотвращает накопление в лизосомах. 3тип- болезнь Форбса или Кори. 4тип- болезнь Андерсена- наступает летальный исход от печеночной недостаточности в первый год жизни. 5тип- синдром МакАрдля- невыносливость к физич. нагрузкам, в крови почти нету лактата. 6тип- недостаточ. фосфорилазы в печени. 7тип- недостаточ. фосфофруктокиназы в печени.
63. Сахарный диабет: причины, типы, сущность нарушений углеводного, липидного, белкового обменов. Принципы диагностики и лечения, осложнения. Сах.диабет – это хрон. заболевание, приводящее к нарушениям углеводного, белкового и липидного обмена в результате недостатка гормона инсулина или неправильного его действия.Сахарный диабет бывает первичным или вторичным: 1.Первичный (идиопатический) подразделен на:а)потенциальный; б)латентный проявляется. при лечении картизоном, острых инфекциях, беременности; характерен диабетический тип кривой сахарной нагрузки; в) асимптоматический (химический) ; г) клинический - делится на: «первого типа» инсулинзависимый -проявляется в характеризуется резким снижением секреции инсулина вследствие атрофии бета-клеток и «второго типа» инсулин-независимый. характеризуется некоторым снижением секреции инсулина. 2.Вторичный. Причины :а)повреждение поджелуд .ж-зы при хроническом панкреатите, опухолях и др. заболеваниях; б)присутствие антагонистов инсулина: избыточная секреция гормона роста или глюкокартикоидов;Другие причины диабета: 1.частичное нарушение нормальной структуры инсулина; 2.повыш. уровень секреции инсулиназы; 3. частичное нарушение структуры инсулиновых рецепторов.Различают 2 группы симптомов: основные и второстепенные.К основным симптомам относятся: Полиурия — усиленное выделение мочи, вызванное повышением осмотического давления мочи за счёт растворённой в ней глюкозы. Полидипсия (постоянная неутолимая жажда) — обусловлена значительными потерями воды с мочой и повышением осмотического давления крови.Полифагия — постоянный неутолимый голод, вызван нарушением обмена веществ при диабете, неспособностью клеток поглощать и перерабатывать глюкозу в отсутствие инсулина.Похудание - обусловлено повышенным катаболизмом белков и жиров из-за выключения глюкозы из энергетического обмена клеток.К вторичным симптомам относятся: зуд кожи и слизистых оболочек, сухость во рту, общая мышечная слабость, головная боль, нарушение зрения. Осложнения:Диабетический кетоацидоз — тяжёлое состояние, развивающееся вследствие накопления в крови продуктов промежуточного метаболизма жиров. Возникает при— инфекциях, травмах, операциях, при недостаточном питании. Гипогликемия — снижение уровня глюкозы в крови ниже нормального значения (обычно ниже 3,3 ммоль/л), происходит из-за передозировки сахароснижающих препаратов, сопутствующих заболеваний или недостаточного питании, приёма крепкого алкоголя. Гиперосмолярная кома , Встречается у пожилых больных с диабетом 2-го типа в анамнезе или без него и всегда связана с сильным обезвоживанием. Лактацидотическая кома - обусловлена накоплением в крови молочной кислоты и чаще возникает на фоне сердечно-сосудистой, печеночной и почечной недостаточности, как следствие этого, накопления в тканях молочной кислоты. Основной причиной развития лактацидотической комы является резкое смещение кислотно-основного равновесия в кислую сторону; обезвоживания, как правило, при этом виде комы не наблюдается.
64. Галактоземия. Причины. Сущность проявления заболевания. Галактоземия- редкое генетическое нарушение обмена веществ, при котором изменяется нормальный процесс метаболизма углеводов (сахаров) галактозы. Причины возникновения. При нормальном метаболизме, лактоза, содержащаяся в продуктах питания, под действием фермента лактазы, расщепляется, образуя глюкозу и галактозу. У людей, больных галактоземией, ферменты, необходимые для преобразования галактозы или отсутствуют, или же их уровень очень низок, что приводит к накоплению токсического галактозо-1-фосфата в различных тканях, эти процессы приводят к гепатомегалии (увеличение печени), циррозу печени, почечной недостаточности, катаракте, повреждениям головного мозга и яичников. Без лечения, смертность детей грудного возраста с диагнозом галактоземия составляет около 75%.
65. Переваривание и всасыв липидов в ЖКТ. транспорт в кровотоке. Пища ч-ка содержит простые липиды, слож.липиды, а также эфиры холестерола (ацетат, олеат, пальментат и стеорат). Переваривание липидов осущ-ся в тонком кишечнике при помощи желчи и панкреатического сока, у детей вырабатывается фермент слюны-язычная липаза, которая активна в желудке. В желудке липиды подвергаются кислому гидролизу,в результате чего образуется некоторое кол-во свобод. жирных кислот.При поступлении в тонкий кишечник происходит нейтрализация пищи при помощи бикарбонатов панкреатического сока. Далее в результате действия липаз происходит дальнейшее расщепление липидов. Желчные кислоты эмульгируют липиды, резко увеличивает площадь поверхности контакта водной и жировой фазы. Это необходимо, потому что липазы водорастворимы. При их действии образуется: свободные жиров.к-ты, лизолицетины, свободный холестерол.
66. Классы липопротеинов, их состав и ф-ции в транспорте липидов. Перенос триацилглицерола и холестерола в клетки. Липопротеины — сложные соединения, молекулы которых построены из липидов и белков, связанных между собой посредством гидрофобных и электростатических взаимодействий. Они входят в состав всех живых организмов, выполняют ф-цию транспорта и запасания липидов. Основные липопротеины плазмы: хиломикроны (образуются в клетках кишечника, богаты триглицеридами), липопротеины очень низкой (являются транспортной формой эндогенных триглицеридов), промежуточной, низкой (наиболее атерогенные липопротеины крови) и высокой плотности (самые мелкие, образуются в печени и кишечнике в виде незрелых дисковидных частиц). Холестерол поступает в клетки из крови в основном в составе лпнп, поступает в ткани путем эндоцитоза ЛП, некоторое количество холестерола поступает в клетки путём диффузии из ЛПНП и других ЛП при их контакте с мембранами клеток.
67. β-окисление жирных кислот. Окисление ненасыщенных жирных кислот с четным и нечетным числом углеродных атомов. Попадая в клетки триглицнриды подвергаются действию эстераз, которые отщипляют жирные кислоты. Образуется глицерол фосфорилируется превращается в дигидроксиацетонфосфат и включается в гликолиз. Жирные кислоты из цитоплазмы перемещаются в митохондрии, где происходит их расщепление. В зависимости от необходимости клетки отщепляют одно, двух-, трех углеродные фрагменты. Но в большинстве случаев клетке требуется клетке 2-х углеродный фрагмент. Перемещение жирных кислот осуществляется в три этапа: рис 1.

Далее в матриксе осуществляется расщепление жирных кислоты на 2-х углеродные фрагменты: рис 2. Окисление ненасыщенных жирной кислоты включает 2 этапа: 1. Выравнивание конфигурации за счет переноса группы СО из цис- в трансположение. 2. Гидратация присоединение OH-группы по 2-й связи и далее обычно. Окисление жирной кислоты с нечетным числом атомов углерода, обычное расщепление 2-х углеродных фрагментов дает в конце пропионил СоА, он карбоксилируется и изомеризуется, происходит внутримолекулярная перестройка –образуется сукцинил СоА.

68. НАРУШЕНИЯ ОБМЕНА ЛИПИДОВ Патологические состояния, связанные с отклонениями от нормального режима протекания метаболических процессов с участием липидов, вызываются, в первую очередь, нарушениями их переваривания и всасывания в организме. Первым симптомом нарушения обмена липидов является стеанорея, т.е. появление липидов в кале. Различают 3 основных типа стеанореи: 1) панкреатогеннаястеанорея, которая обусловлена низкой скоростью синтеза панкреатической липазы, что, в свою очередь, приводит к снижению интенсивности гидролиза триацилглицеринов в кишечном соке; 2) гепатогенная стеанорея, которая связана с нарушением поступления желчи в двенадцатиперстную кишку, в результате чего не происходит эмульгирования жиров, а, следовательно, и их гидролиза липазой; 3) энтерогенная стеанорея, которая обусловлена снижением метаболической активности слизистой оболочки тонкого отдела кишечника, в котором происходит ресинтез липидов.Увелич-е концентрации липопротеинов в крови приводит к возникновению гиперлипопротеинемии, а понижение - к гипопротеинемии. Гиперлипопротеинемии обусловлены замедлением расщепления липопротеиновых комплексов вследствие недостаточности липопротеинлипазы или в результате гиперинсулинизма, индуцирующего в печени усиленный синтез триацилглицеринов из углеводов. Гиперлипопротеинемия наряду с гиперхолестеролемией (увеличением содержания в крови холестерина) является основной причиной атеросклероза. Гиполипопротеинемии связаны как с нарушением переваривания и всасывания жиров в тонком отделе кишечника в результате дефицита липазы, а также с нарушениями продукции и поступления желчи. Кроме того, увелич-е содерж-я тиреоидных гормонов (гипертиреоз) приводит к усилению катаболизма сывороточных липидов.При атеросклерозе (отложение холестерина в стенках артерий) в стенках сосудов (преимущественно крупных артерий) откладываются жиры и прорастает соединительная ткань. Такие очаги разрешения сосудов называются атеросклеротическими бляшками. Атеросклеротические бляшки являются причиной сужения просвета сосудов и деформации участка кровеносного сосуда, что в свою очередь приводит к нарушениям циркуляции крови во внутренних органах.Сфинголипидозы - врожденные нарушения метаболизма липидов, главным образомсфинголипидов , обусловленные отсутствием лизосомных ферментов , катализирующих процессы распада сфинголипидов.Основу молекуулярной структуры сфинголипидов составляет церамид - продукт соединения через аминогруппу аминоспиртасфингозина и жирной кислоты. Разнообразие сфинголипидов связано с присоединением к церамиду более простых молекулярных групп, главным образом гексоз.Сфинголипиды являются важнейшими структурными компонентами клеточных мембран, в частности миелиновых оболочек нервных волокон, поэтому нарушение постоянно протекающего в организме их обновления, их распада в лизосомах клеток создает патологическую картину поражения большинства жизненно важных органов, включая серое и белое вещества головного мозга. Дефекты деградации сфинголипидов связаны с недостаточностью соответствующих ферментов специфических для каждого типа сфинголипидов.
 69. БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ. Биосинтез жирных к-т и липидов играет важную роль в жизнед-тиорг-мов. Именно в виде жирных к-т и триацилглицериновотклад-ся основные кол-ва энерг-х ресурсов орг-мов животных, в то время как энергоресурсы, откладываемые в форме углеводов, незначительны.В клетках орг-зма жирные к-ты синтез-тся из ацетил-КоА, образующегося из избыточной глюкозы пищи, которая не была использована организмом на энергетические нужды. В качестве восстановителя в биосинтезе жирных к-т принимает участие НАДФН, синтезируемый, в основном, в пентофосфатном пути распада углеводов. Нужно отметить, что хотя все реакции β-окисления жирных кислот обратимы, этот путь не используется организмом с целью их синтеза. Биосинтез жирных кислот осуществляется в цитоплазме клеток и катализируется целым полиферментным надмолекулярным ансамблем - пальмитилсинтетазой, состоящей из семи ферментов.Суммарная реакция биосинтеза жирных кислот в цитоплазме имеет следующий вид (Е - пальмитилсинтетаза):
69. БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ. Биосинтез жирных к-т и липидов играет важную роль в жизнед-тиорг-мов. Именно в виде жирных к-т и триацилглицериновотклад-ся основные кол-ва энерг-х ресурсов орг-мов животных, в то время как энергоресурсы, откладываемые в форме углеводов, незначительны.В клетках орг-зма жирные к-ты синтез-тся из ацетил-КоА, образующегося из избыточной глюкозы пищи, которая не была использована организмом на энергетические нужды. В качестве восстановителя в биосинтезе жирных к-т принимает участие НАДФН, синтезируемый, в основном, в пентофосфатном пути распада углеводов. Нужно отметить, что хотя все реакции β-окисления жирных кислот обратимы, этот путь не используется организмом с целью их синтеза. Биосинтез жирных кислот осуществляется в цитоплазме клеток и катализируется целым полиферментным надмолекулярным ансамблем - пальмитилсинтетазой, состоящей из семи ферментов.Суммарная реакция биосинтеза жирных кислот в цитоплазме имеет следующий вид (Е - пальмитилсинтетаза):
Из данного уравнения можно видеть, что для синтеза жирной кислоты требуется всего одна молекула ацетил-КоА, служащая «затравкой». Непосредственным источником синтеза является малонил-КоА, который образуется из ацетил-КоА по реакции:

Эта реакция катализируется биотинзависимым ферментом - ацетил-КоА- карбоксилазой. Функция биотина сводится к переносу диоксида углерода на субстрат.Пальмитилсинтетаза представляет собой многофункциональный ансамбль белков: в центре полиферментного ансамбля находится ацилпереносящий белок (АПБ), содержащий свободную SH-группу; шесть остальных ферментов располагаются по периметру, причем один из них также содержит SH- группу. Поэтому пальмитилсинтетазу можно обозначить как:

Процесс синтеза жирной кислоты описывается рядом последовательных реакций:1. Перенос ацетила с ацетил-КоА на синтетазу:

2. Перенос малонила с малонил-КоА на синтетазу:

3. Конденсация ацетила с малонилом и декарбоксилирование образовавшегося продукта:
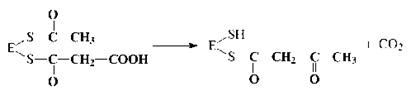
4. Первое восстановление промежуточного продукта с участием НАДФН:

5. Дегидратация промежуточного продукта:

6. Второе восстановление промежуточного продукта с участием НАДФН:

Затем синтезированный бутирил перемещается на ту SH-группу, с которой был связан затравочный ацетил, а на освободившуюся SH-группу поступает новый малонильный остаток из малонил-КоА. Далее цикл повторяется снова; после семи оборотов цикла синтезируется пальмитил-Е, который при участии пальмитилдеацилазыгидролизуется до пальмитиновой кислоты и фермента (Е). Пальмитиновая кислота - это основной продукт биосинтеза, однако в небольших количествах могут образовываться и другие жирные кислоты.Жирные кислоты с разветвленной углеродной цепью синтезируются из продуктов метаболизма аминокислот с разветвленной цепью (валин, изолейцин и лейцин) через ацильные производные КоА путем удлинения цепи и при участии АПБ. Особенности биосинтеза полиненасыщенных жирных кислот представляют интерес в связи с их витаминоподобными функциями. Некоторые полиеновые кислоты могут синтезироваться из олеиновой кислоты с помощью ряда последовательных реакций. Однако, синтез полиненасыщенных кислот, содержащих двойные связи, расположенные между конечным метилом и седьмым атомом углерода, невозможен, поэтому они и являются незаменимыми в пищевом рационе.Т.о., биосинтез и поступление с пищей - два основных источника жирных кислот для организма человека и животных.Биосинтез триацилглицеринов. Образующиеся в результате биосинтеза жирные кислоты в организмах животных и человека в свободном виде встречаются лишь в незначительных количествах, а присутствуют главным образом в виде триацилглицеринов. Синтез триацилглицеринов происходит в печени и жировой ткани из КоА-производных жирных кислот через фосфатидную кислоту по реакции:
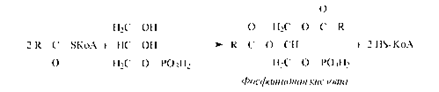
Фосфорилирование глицерина осуществляется глицеролкиназой за счет энергии АТФ. Глицерол-3-фосфат может образовываться и при восстановлении диоксиацетонфосфата.Гидролиз фосфатидной кислоты фосфатазой приводит к образованию 1,2-диацилглицерина, который, реагируя с другой молекулой ацил-КоА, образует нейтральный триацилглицерин.В слизистой кишечника триацилглицерины синтезируются из свободных кислот, моно- и диацилглицеринов, но эти процессы характерны только для слизистой оболочки кишечника. Перенос остатка жирной кислоты происходит через ацильноепроизводноеКоА.
70. Синтез кетоновых тел. Роль кетоновых тел. Биосинтез холестерина и его производных. Роль холестерина в организме.Кетоновые тела- способ транспорта ацетильной группы. К кетоновым телам относятся: ацетоацетат, 3- гидроксибутират и ацетон. Синтез ацетоацетата происходит в митохондриях печени. Затем он восстанавливается до 3- гидроксибутирата, либо расщепляется до ацетона. Далее все 3 соединения поступают в кровь и разносятся по тканям. Кетоновые тела выделяются с мочой. Кетоновые тела используются клетками всех тканей, за исключением эритроцитов и печени. Роль холестерина- в организме человека холестерин присутствует во всех клетках и тканях организма. С его участием происходят процессы выработки витамина D, стероидных гормонов коры надпочечников, женских и мужских половых гормонов, транспорт веществ через клеточные мембраны, поддерживается уровень воды в клетках. Продукты- яичный желток, печень, почки, икра, масло, сметана и др. жирные молочные продукты. Биосинтез холестерина-образование органического спирта холестерина. Синтез холестерина происходит в клетках печени, кишечнике и коже. Биосинтез холестер включает: Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Превращение мевалоната в изопентенилпирофосфат. Образование тридцатиуглеродного изопреноида сквалена. Циклизация сквалена в ланостерин. Превращение ланостерина в холестерин.
71. Причины и типы гипо и гиперлипротеинемий. Атеросклероз,этапы атерогенеза. Функции холестерина в организме человека. Профилактика атеросклероза. Гиперлипротеинемия- повышенный уровень липидов в крови человека. Гиперлипопротеинемия I типа очень редка, резко усиливается после приема жира и снижается после строгого его ограничения. Клинические проявления возникают в возрасте до 10 лет; часто наблюдаются боли в животе, панкреатит, развитие атеросклероза не характерно. Гиперлипопротеинемия II типасоставляет около 30% случаев гиперлипопротеинемий, связана со снижением катаболизма. Характерны образования желтых пятен в области ахиллова сухожилия, сухожилий разгибателей стоп и кистей. Гиполипопротеинемия- состояние, при котором понижено содержание жиров в крови. Увеличивается риск развития атеросклероза, нарушение всасывания жиров в кишечнике, плохой аппетит. Атеросклероз- хроническое заболевание, при котором периодически обостряется процесс повреждения сосудов, характеризующийся нарушением холестеринового обмена. Этапы атерогенеза: 1.Первичное повреждение эндотелия 2.Миграция моноцитов и Т-лимфоцитов 3.Активация тромбоцитов, пролиферация гладкомышечных клеток 4. Образование жировых полосок 5.Формирование атеросклеротических бляшек. Профилактика: Значительную роль в защите от угрозы атеросклероза играют женские половые гормоны эстрогены, способствующие уменьшению содержания в крови веществ, которые принимают участие в образовании опасных наростов на стенках сосудов. Поэтому риск развития атеросклероза у женщин возрастает после климакса. Атеросклероз может развиваться и в течении 10 лет, а может и быстро. Предотвратить быстрое развитие атеросклероза можно например теплыми ваннами из отваров, применением лекарствен препаратов растит. Происхождения, с витамином С, а также употребление петрушки, мяты, чеснока. Роль холестерина- в организме человека холестерин присутствует во всех клетках и тканях организма. С его участием происходят процессы выработки витамина D, стероидных гормонов коры надпочечников, женских и мужских половых гормонов, транспорт веществ через клеточные мембраны, поддерживается уровень воды в клетках.
72. Переваривание белков в ЖКТ Переваривание пищи начинается в ротовой полости,где ферменты L и B(бетта) амилазы отщепляют углеводные компаненты от сложных белков.Далее в желудке белки подвергаются действию HCL и пепсина.HCL выполняет следующие функции:-обеззараживает пищу, активирует профермент пепсиногена,превращая его в активный пепсин., способствует частичной денатурации белков,делая их более доступными для пепсина., обеспечивает оптимальный pH для действия пепсина.Пепсин синтезируется главными клетками желудочных желез в виде профермента пепсиногена.В полости желудка отщепляется 47 аминокислотных остатков с N конца и олбразуется активный пепсин,который далее сам активирует предшественник. Пепсин яв-сяэндопептидазой и расщепляют белки на более короткие момент.Далее пища поступает в тонкий кишечник,где нейтрализуется при помощи бикарбонатов,содержащихся в панкретаическом соке.В верхнем отделе тонкого кишечника на белки воздействует фермент трипсин, эластаза, химотрипсин.Предшественники этих ферментов синтезируются в поджелудочной железе и секретируются в просвет кишечника.Энтероциты секретируют фермент энтеропептидазу,активирующюю предшественники.В результате действия фермента образуются короткие полипетиды,на которые воздействует фермент карбоксидипептидаза,отщепляющий аминокислоты с «С» конца.Окончательное расщепление до аминокислот обеспечивает аминодипептидаза(отщепляет остатки с N конца). Всасывание и транспорт амин.к-т.Всас-е осущ-ся в тонк.кишкеmax концентр-я аминк-т в крови достигается ч/з 30-50 мин.после потреб-я белка.Энтероциты имеют 4 системы источн-ка для трансп-та аминк-т: 1.нейтральных ак-т,2.основных ак-т,3.кислыхак-т.4.для транспорта глицина и аминк-т(пролина и гидроксипролина).D-аминк-ты всасываются при помощи прост.диффузии.Работапереносщиков L-аминок-т требует затрат E и сопряж-но с деят-тьюNa+ K+ АТФазы. Мех-м напоминает всасывание глюкозы. Пример: симпорт с Na,затем удал-е Na из кл-киактивн.транспортом. В процессе уч-ет также витамин В6.Универсальным мех-змомтрансп-та аминк-т явл-ся гамма-глутамильныйцикл.В нем участ-ет 6 ферментов(1-мембрансвязанный,а остальные в цитозоли) и 3-пептидглутатион(гамма-глутанилцистеинилглицин). Ключевым ферментом яв-ся гамма-глутамилтранф-за, которая катализирует перенос глутамин-го остатка от глутатиола на переносимую к-ту.Образ-сяглутамил-аминок-та и цистиниилглицин.Они перенос-ся в цит-му,гдерасщ-ся ферм-ом глутамил-аминотрансферазой до свободной аминок-ты и 5-оксопролина. Одновременно происходит гидролиз дипептинаглутатион в ходе 3х послед-х р-ций,при этом затраг-ся 3 малекулы АТФ на 1 мал-луглутациона.В тонкой кишке в малом кол-ве могут всас-сяолигопептиды и некоторые нативныебелки.Этим об-сявозн-е аллерг-х р-ций поскольку антигенами могут быть только интактные белки. Всасываемыеаминок-ты попадают в портальный кровоток->печень->общ.кровоток.Наиболее интенсивно аминк-ты поглащ-ся печенью и почками,ткани мозга избирательно поглащают метионин, глетидин, глицин, оргинин,глутамин,тирозин(быстро);а так же медлено:лейцин,лизин,пролин.
73. Общие пути катаболизма аминокислот.Значение реакций дезаминирования, трансаминирования, декарбоксилирования. Диагностическое знаачение трансамилаз в сыворотке крови. Общие пути обмена аминокислот. Общие пути превращения аминокислот включают реакции дезаминирования, трансаминирования, декарбоксилирования, биосинтеза. Дезаминирование аминок-т. Первая стадия является ферментативной и завершается образованием неустойчивого промежуточного продукта, который на второй стадии в присутствии воды распадается на аммиак и α-кетокислоту. Трансаминирование аминокислот- реакции межмолекулярного переноса аминогруппы от аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции являются обратимыми и универсальными для всех живых организмов, протекают при участии специфических ферментов (аминофераз). Специфичность трансаминаз обеспечивается белковым компонентом. Ферменты трансаминирования катализируют перенос NH2-группы не на α-кетокислоту, а сначала на кофермент перидоксальфосфат. Образовавшееся промежуточное соединение подвергается внутримолекулярным превращениям, приводящим к освобождению α-кетокислоты и пиридоксаминфосфата; последний на второй стадии реакции реагирует с любой другой α-кетокислотой, это приводит к синтезу новой аминок-ты и освобождениюпиридоксальфосфата. Декарбоксилирование аминокислот. Процесс отщепления карбоксильной группы аминокислот в виде СО2. Образующиеся продукты р-ции – биогенные амины – оказывают сильное фармакологическое действие на множество физиологических функций человека и животных. В живых организмах 4 типа декарбоксилирования аминокислот: 1. α-Декарбоксилирование, характерное для тканей животных; 2. ω-Декарбоксилирование, свойственное микроорганизмам. 3. Декарбоксилирование, связанное с реакцией трансаминирования. 4. Декарбоксилирование, связанное с реакцией конденсации двух молекул.
74. Окислительный катаболизм аминокислот: возможные пути расщепления углеводного скелета, утилизация аминного азота. Углеродные скелеты аминок-т обр-ся из продуктов обмена, аминогруппы вводятся путем прямого аминирования или трансаминирования, лишь немногие из аминок-т обр-ся в рез-те прямого аминирования свободными ионами NH4+. Из свободных аминокислот в цитоплазме количественно преобладает глутаминовая к-та(более 50% пула) Расщепление амин-т включает 2 типа реакций 1)Связанные с удалением и дальнейшим превращением аминогруппы (дезаминирование, переаминирование, включается в состав мочевины).2)превращение углеродного скелета. Превращение углер. скелета в аэробных условиях приводят к соединениям, включающимся в ЦТК.Удаление аминогруппы происходит переаминированием.Аланин и аспартат обр-ся путем трансаминирования соответственно из пирувата и аксалоацетата.
Тирозин обр-ся при гидроксилировании фенилаланина, цистеин синтез-ся из метионина и серина в сложн. последовательности реакций с образованием в качестве промежуточных продуктов S-аденозилметионина и цистатеонина. Углеродн.скелет серина происходит от 3-фосфоглицерата. Серин явл-ся предшественником глицина;-углеродный атом серина переносится тетрагидропалатом,явл-ся переносчиком одноуглеродных групп. Конечные продукты, образующимся в рез-те катаболизма амин-ты делят на 3 гр:1)Глюкогенные (аланин,аргинин,аспарагин,аспарагин.к-та,валин,глутамин.к-та, глицин, гистидин, метионин,пролин,серин,треонин,триптофан,цистеин) 2)Кетогенные (образуют кетоновые тела) лейцин,лизин,триптофан 3)Смешанные (кетогенные и глюкогенные)тирозин,фенилаланин. Сера с серосодержащих амин-т передается на др.серосодержащие амин-ты при их образовании с цистеина на цистеин или с метионина на метионин или отщепляются в виде SO4,из которого затем в цепи реакций возникают SO4 ,лишняя S выводится из организма с мочой в 3х формах: а)неорганические сульфаты 80%, б)сера в составе эфиров, в)органическая S в составе амин-т.Ароматические циклы расщепляются при действии оксидаз или передаются вновь синтезируемой амин-те. Повышение уровня трансаминаз в сыворотке крови отмечено при некоторых заболеваниях мышц, при обширных травмах и прогрессивной мышечной дистрофии.
75. Обмен одноуглеродных групп как способ углеродного скелета при биосинтезе аминокислот и нуклеотидов. Обмен серина, глицина и треонина. Углеродные скелеты аминок-т обр-ся из продуктов обмена, аминогруппы вводятся путем прямого аминирования или трансаминирования, лишь немногие из аминок-т обр-ся в рез-те прямого аминирования свободными ионами NH4+.В первичной ассимиляции аммиака участвуют L-глутаматдегидрогеназа,L-аланиндегидрогенеаза, кот.осуществ-ют восстановительное аминирование кетокислот без участия АТФ. Обр-ие глутамина из глутамата, катализируется глутаминсинтетазой при участии АТФ,фермент активен даже при низк.конц-ях NH4+.Большенство др.аминокислот получают аминогруппу в рез-те трансаминирования. Из свободных аминокислот в цитоплазме количественно преобладает глутаминовая к-та(более 50% пула).Аланин и аспартат обр-ся путем трансаминирования соответственно из пирувата и аксалоацетата. Тирозин обр-ся при гидроксилировании фенилаланина, цистеин синтез-ся из метионина и серина в сложн. последовательности реакций с образованием в качестве промежуточных продуктов S-аденозилметионина и цистатеонина.Углеродн.скелет серина происходит от 3-фосфоглицерата.Серин явл-ся предшественником глицина;-углеродный атом серина переносится тетрагидропалатом,явл-ся переносчиком одноуглеродных групп (метильная, формильная,гидроксиметильная). Аллостерич. регуляция биосинтеза аминокислот осущ.по принципу обратной связи, при этом регуляторным явл-ся первый фермент цепи реакций.

76. Обмен фенилаланина и тирозина. Фенилкетонурия. Фенилаланин – незаменимая к-та. Основной его путь превращения начинается с его гидроксилирования в тирозин. Реакция катализируется специфической фенилаланин-4-монооксигеназой, которая в качестве кофермента содержит тетрагидробиоптерин. Блокирование этой реакции приводит к развитию тяжелой наследственной болезни – фенилкетонурии (фенилпировиноградная олигофрения). В процессе трансаминирования тирозин превращается в n-оксифенилпировиноградную кислоту, которая под действием специфической оксидазы подвергается окислению, декарбоксилированию, гидроксилированию и внутримолекулярному перемещению боковой цепи с образованием гомогентизиновой кислоты; эта реакция требует присутствия аскорбиновой к-ты, роль которой пока не выяснена. Дальнейшее превращение гомогентизиновой кислоты в малеилацетоуксусную к-ту катализируется оксидазой гомогентизиновой кислоты. Малеилацетоуксусная к-та под действием специфической изомеразы в присутствии глутатиона превращается в фумарилацетоуксусную к-ту, подвергающуюся гидролизу с образованием фумаровой и ацетоуксусной кислот. Фенилаланин и тирозин являются также предшественниками меланинов. Фенилкетонурия - наследственное заболевание, в основе которого лежит аномалия аминокислотного обмена вследствие отсутствия или резкого снижения активности фермента фенилаланингидроксилазы. Фермент сохраняет только около 5% активности, в связи с чем нарушается обмен фенилаланина и вследствие этого – тирозина, триптофана и др., накапливаются промежуточные продукты обмена – фенилэтиламин, фенилпировиноградная кислота и др. и возникает дефицит метаболитов, необходимых для нормального функционирования организма. Фенилкетонурия проявляется выраженной олигофренией (идиотией или имбецильностью). Диагностируется в первые дни жизни ребёнка с помощью микробиологических или биохимических методов.
77. Метаболизм метионина. Метионин – незаменимая аминок-та, которая не синтезируется в орг-зме ч-ка. Поэтому метионин должен постоянно поступать в орг-зм вместе с пищей. Метионин входит в состав белка. В метаболизме роль метионина связана с тем, что она содержит подвижную метильную группу (-СНз), которая может передаваться на другие соединения. Способностью метионина отдавать метильную группу обусловлен его липотропный эффект (удаление из печени избытка жира). Отдавая подвижную метильную группу, метионин способствует синтезу холина, с недостаточным образованием которого связаны нарушение синтеза фосфолипидов из жиров и отложение в печени нейтрального жира. Метионин участвует в синтезе адреналина, креатина и других биологически важных соединений; активирует действие гормонов, витаминов (В 12 , аскорбиновой и фолиевой кислот), ферментов. Если нарушается метаболизм, то организм человека «теряет равновесие», что неотвратимо приводит к расстройствам и заболеваниям. Путем метилирования (отдачи -CH3-группы) метионин обезвреживает токсичные продукты. Применяют метионин для лечения и предупреждения заболеваний и токсических поражений печени, а также при хроническом алкоголизме, сахарном диабете и др. Эффект более выражен при жировой инфильтрации клеток печени. При вирусном гепатите применять метионин не рекомендуется. Метионин назначают для лечения дистрофии, возникающей в результате белковой недостаточности у детей и взрослых после дизентерии и других хронических инфекционных заболеваний. Метионин способствует снижению содержания холестерина в крови, уменьшению отложения жира в печени и улучшению функции печени, может оказывать умеренное антидепрессивное действие.
78. Метаболизм гистидина. Дезаминирование гистидина происходит в печени и коже под действием фермента гистидазы с образованием уроканиновой к-ты, которая затем в печени превращается в имидазолонпропионовую к-ту под действием уроканиназы. Дальнейшее превращение в ходе серии р-ций имидазолонпропионовой кислоты приводит к образованию аммиака, глутамата и одноуглеродного фрагмента, соединённого с тетрагидофолиевой кислотой. Реакция декарбоксилирования гистидина имеет большое физиологическое значение, так как является источником образования биологически активного вещества — гистамина, который играет важную роль в процессе воспаления и развития некоторых аллергических р-ций. Декарбоксилирование происходит большей частью в тучных клетках соединительной ткани практически всех органов. Эта р-ция протекает при участии фермента гистидиндекарбоксилазы. Известно связанное с дефектом гистидиназы наследственное заболевание гистидинемия, при котором характерно повышенное содержание гистидина в тканях и задержка умственного и физического развития.
79. Биогенные амины.Явл. продуктами декарбоксилирования аминок-т и обладают повышенной биолог. активностью. К группе относятся многие нейромедиаторы: 1)гамма-аминомаслянная кислота-образ-ся при декарбоксилировании глутаминовой к-ты (ферм. – глутамандекарбоксилаза, коферм.- передоксальфосфат). Основное место синтеза-ткань головного мозга, главный тормозный медиатор в ЦНС, вызывает гиперполяризацию постсинаптической мембраны вследствие обратного транспорта ионов CL и накопл-е в клетке Са. Поэтому сигнал от возбуждающегося нерва не достигает порогового уровня. Распад гамма-аминомаслянной к-ты происходит в рез-те переаминирования с альфа-кетоглутарата, т.к. образуется сукцинат и глутамат. Тормозным медиатором в спинном мозге и в стволе-глицин(антагонист стрихнин). 2)Гистаминобраз-ся при декарбоксилировании гистидина, катализируемого специфической декарбоксилазой. Основное место синтеза –тучные клетки, в которых он находится в виде белково-гистаминового комплекса. Освобожд-ся при действии спец. факторов (либераторов). Гистамин активирует секрецию пепсиногена и НCL в слизистой желудка и является сильным сосудорасширяющим агентом и медиатором аллергических реакций. В большых кол-вах освобождается из ДЕПО при травматическом шоке и зоне воспаления, распадается под действием диаминооксидазы. 3)Серотонин образ-ся из триптофана, при гидроксилировании, (фермент триптофан-5-моно-оксигеназа), (кофермент-тетрагидроптередин).С последующим декарбоксилированием образ-ся с нейронами гипоталамуса и ствола мозга и явл. медиатором этих нейронов. Сильный сосудосуживающий агент, повышает свертываемость крови. Разруш-ся моноаминооксидазой, образ-ся оксиэндолилуксусная к-та, которая выводится из орг-ма с мочой. 4)Дофамин производное тирозина. Под действием тирозиназы тирозин гидроксилируется до 3,4-диоксифенилаланина(ДОФА) . ДОФА декарбоксилир-ся до дофамина (в почках, надпочечниках, в симпатических ганглиях и нервах).Медиатор ингибированного типа одного из проводящих путей (в черной субстанции верхнего отдела ствола мозга и в полосатом теле явл-ся предшественником меланина, норадреналина и адреналина. 5)Норадреналин Медиатор в постганглионарных волокнах симпатической нервной системы, активирует аденилациназу. Это приводит к увеличению уровня синтеза циклической АМФ и активации протеинкиназ, что повышает активность ферментов в клетке. Образ-ся при гидроксилировании ДОФА при помощи фермента дофамин-бета-монооксикеназы, также как и адреналин явл-ся гормоном надпочечников. 6)Адреналин образуется в рез-те азотметилированного норадреналина, (фермент-фенилэтанолфолин-азот-метилтрансфераза),усиливает мобилизацию гликогена. 7)Таурин образ-ся из цистеина, синтезируется во многих органах и тканях, выполняет медиаторную ф-цию на уровне синапсов. Участвует в образовании коньюгированных жирных к-т.
81. Общие принципы обмена аминок-т. Нарушение обмена белков и аминок-т .Белковая недостат-ть развив-ся у ч-ка как при полном, так и при частичном голодании, так и при приеме однообразных белков в питании. Когда в диете преоблад. растит. белки - биологич.ценность которых ниже животных белков, результат-отриц. азотистый баланс (кол-во поступающего азота меньше кол-ва выводимого из орг-ма). Гипопротеинемии (понижение концентрации белков в сыворотке до 30-50гр/л. Нарушение коллоидно-осмотического и водно-солевого обмена(развитие отеков). При тяжелых формах пицеварительной дистрофии наблюдается поражение печени, остановка роста, резкое снижение иммуного столбца, отечность, атомия м-ц. При белковой недостаточности резко понижается интенсивность процессов дезаминирования, трансаминирование и биосинтез аминок-т, а также активность цикла мочевины в печени из-за недостаточного синтеза нужных ферментов, следует аминоацидурия до 10-20 г/сутки (в норме 1г в сутки), повышение концентрации свободных аминок-т в крови и снижение экскреции мочевины .Увелич-ся уровень распада белков. Гипераминоацидурия делится на 1)почечную (связана с приобретенным или врожденным дефектом реабсорбции аминок-т в почки ); 2)Внепочечную (связана с повышенной концентрацией аминок-т в крови).Причины почечной аминоацидурии служат -Хронич. нефрит, нефрозы, наследств.заболевания такие как цистиноз (врожден.нарушение реабсорбции почти всех аминокислот-повыш-е в 5-10 раз экскреции всех аминок-тв 20-30 раз цистина и цистеина, отложении цистина в клетках РЭС, селезенки, печени и роговицы глаза) и цистинурия( наруш-е реабсорбции и повышения выведения мочой цистина, аргинина, лизина, орнитина в 50 раз, повыш-ся вероятность образования камней в почках.Некоторые энзимопатии
| Заболевание | фермент |
| альбинизм | Тирозин-3-монооксигеназа |
| алкаптонурия | Гомогентизат-1,2-диоксигеназа |
| оргининосукцинатацидемия | Оргинино-сукцинат лиаза |
| гомоцистинурия | Цистотиамин-бета-синтаза |
| Болезнь Клинового сиропа(лейциноз) | Дегидрогеназа альфа-кетокислот с развлетвленной цепью |
| Фенилкетонурия | Фенилаланин-4-монооксигеназа |
| гипервалинемия | Валинтрансаминаза |
Аминокислоты широко используются в современной фармакологии. Являясь не только структурными элементами белков и других соединений, они имеют большое значение. Некоторые из них выступают в качестве нейромедиаторных веществ (глутаминовая, аспарагиновая кислоты, глицин, таурин, Ag -аминомасляная кислота и др.). Фенилаланин и тирозин являются предшественниками в биосинтезе дофамина, норадреналина, адреналина; триптофан — предшественником серотонина; гистидин — предшественником гистамина. Производными аминокислот являются энкефалины, эндорфины, динорфины и другие нейропептиды, а также высвобождающие факторы(рилизинг-факторы) гипоталамуса, гормоны гипофиза и т. д. Некоторые аминокислоты (глутаминовая, Ag -аминомасляная, метионин, глицин и др.) нашли самостоятельное применение в качестве лекарственных средств. Расширяется круг новых лекарственных препаратов, синтезируемых с использованием остатков аминокислот (см. Даларгин, Каптоприл, Тимоген и др.). Специальное значение имеют смеси аминокислот, используемые в качестве средств для парентерального питания.
83. Реутилизация пуриновых оснований. Гиперурикемия. Синдром Леша-Нихана. Подагра, причины и сущность заболевания принципы лечения. Реутилизация пуриновых оснований- процесс повторного их использования. Актуален в быстрорастущих тканях, когда активно идет процесс синтеза нуклеин.к-т и недопустима потеря их предшественников. Сущ-ет 2 способа реутилизации:1способ- заключается в присоединении рибозо-5-фосфата к свобод.основаниям гуанину, аденину или гипоксантину с образованием АМФ, ГМФ или ИМФ

2 способ: реутилизируются пуриновые рибонуклеозиды или дезоксирибонуклеозиды. Для этого сущ-ет фермент аденозинкиназа и дезоксицитидинкиназа. Гиперурекимия-повышенное содержание моч.к-ты в крови.
Причиной такого повышения яв-ся 2 фактора: нарушение выведения почками мочевой кислоты- почечная гиперурекимия; избыточное её образование-обменная гиперурекимия. Гиперурекимия вызывается: ускоренным образованием моч.к-ты из-за участия пурина в обмене в-в; из-за ослабленной работы почек; из-за повышенного содержания фруктозы в пище. Гиперурекимия также вызывает голодание и потребление высококалорийной пищи. Одним из способов лечения яв-ся потребление пищевой соды-она понижает содержание кислотной мочи. Синдром Леша-Нихана.Сопровождается проявлением подагры. Основной фактор-дефект гипоксантина, гуанига, фосфорибозилтрансферазы,катализир.превращением гипоксантина и гуанина в инозинмонофосфат и ГМФ. При этом гуанин и гипоксантин превращаются в мочев.к-ту и не испол-ся повторно в синтезе мононуклеотидов. Заболев-е отмечается у лиц мужского пола. Характерным признаком болезни являются аутоагрессивные действия. Диагноз синдрома Лёша-Нихена ставится по трём элементам: повышенная продукция мочевой к-ты, неврологическая дисфункция, поведенческие нарушения. Подозрения могут возникнуть из-за задержки развития, сопровождающейся гиперурикемией. Также, возможно образование камней в почках (нефролитиаз) или наличие крови в моче (гематурия). Зачастую подозрения на синдром Лёша-Нихена возникают с появлением наносимых самому себе ранений у больного. Подагра -это болезнь обмена веществ, при котором соли мочевой кислоты(ураты) откладываются в суставах. Обусловлена 3 факторами: Повышением синтеза мочев к-ты; Снижением содержания в плазме урат связывающих белков; Уменьшением ренальной фильтрации и соответственно замедлением выведения моч к-ты. В развитии подагры 4 стадии: 1)Бессимптомная гиперурекимия - повышенное содержание мочевой кислоты в крови без каких-либо признаков отложения кристаллов . 2)Острый приступ - развивается обычно через несколько лет бессимптомной гиперурикемии; 3)Стадия межприступной подагры-чередование 1 и 2 стадии. Приступы становятся более тяжелыми, захватывают «новые» суставы. Наблюдается воспаление связок, суставных сумок, часто образуются единичные, обычно безболезненные тофусы. 4)Хроническая тофусная подагра-характеризуется наличием тофусов, хронического артрита, поражением почек, нефролитиазом. Тофусы локализуются обычно подкожно или внутрикожно в области пальцев кистей и стоп, коленных и локтевых суставов, на ушных раковинах. Над тофусами кожа может изъязвляться с выделением содержимого в виде пастообразной белой массы. При подагре возрастает частота сахарного диабета, атеросклеротического поражения сосудов. Лечение: противовоспалительные препараты (индометацин,аллопуринол); снизить содержание мочевой кислоты в крови; потребление адекватного объема жидкости; исключение приема лекарственных препаратов, повышающих уровень мочевой кислоты в крови (в первую очередь диуретиков); Диетотерапия- исключение из рациона пищевых продуктов, содержащих большое количество пуринов!
84. Биосинтез и распад пиримидиновых нуклеотидов: этапы, регуляция. Оротацидурия. Биосинтез. Исходным соединением в синтезе пиримидиновых нукл-в явл. карбамоилфосфат, который конденсируясь с аспарагиновой кислотой образует карбамоил-аспарагиновую к-ту, возникающую при замыкании цикла и последовательном окислении оротат реагирует с фофорибозилпирофосфатом, образуя оротидиловую к-ту. Декарбоксилирование оротидилата дает уридилат, который далее превращается в уридил-3-фосфат. Присоединение аминогруппы от глутамина приводит к образованию цитидин-3-фосфата.Скорость биосинтетических реакций регулируется на уровне первой реакции. Регулятором служит фермент аспартаттранскарбамоилаза. Тимидиновые нукл-ды образуются из дезоксидилмонофосфата при помощи тимидилатсинтетазы. Распад. Распад пиримидинов протекает по одному из нескольких механизмов, обнаруженных у разных видов организмов. Например, у человека реализуется такой механизм, которыйвключает дефосфорилирование и отщепление углеводного компонента от нуклеотидов с образованием тимина или урацила; затем происходит восстановление тимина или урацила с образованием полностью гидрированного гетероцикла. Расщепление цитозина происходит аналогично после того, как он дезаминируется в урацил. Раскрытие кольца в промежуточном продукте приводит к образованию карбомоил-аланина, который далее гидролизуется до СО2, NH3 и β-аланина. Все продукты либо выводятся из организма, либо повторно утилизируются в других метаболических процессах. Например, β-аланин может повторно быть использован в биосинтезе кофермента А.Нарушение обмена пиримидиновых нуклеотидов проявляется в виде наследственного заболевания-оротацидурии. С мочой выделяется оротовая к-та в кол-ве превышающем норму. Причина: дефицит дегидрогеназы. Происходит накопление оротата и в результате наблюдается недостаточность пиримидина=>отставание физического и умственного развития.Лечение: устранение пиримидиновой недостаточности путём введения уридина.

85. Биосинтез декарбоксирибонуклеотидов. Дезоксирибонуклеотиды обр-ся из рибонуклеотидов за счет восст-я остатка рибозы. донором протонов и электронов служит низкомолекулярный белок тироредуксин. Ингибиторы синтеза дезоксирибонуклеотидов тормозят деление клетки. Дезоксирибонуклеотиды образ-ся из рибонеклеотидов, за счет восстановл-я остатка рибозы: донором протонов и электронов служит тиоредоксин (содержит в SH группе), после окисления вновь восст-ся при помощи НАДФН(Н+). Общий путь синтеза: ХДФ-> дХДФ-> дХТФ. Исключение дезокси ТТФ, который образ-ся из УДФ. УДФ-> дезокси УДФ-> дезокси УТФ-> дезокси УМФ-> дезокси ТНФ-> дезокси ТДФ-> дезокси ТТФ. Синтез дезоксирибонукл-в в покоящих клетках минимален. Его активация набл-ся на стадиях, предшествующих делению кл.ингибиторы синтеза дезоксирибонукл-в тормозят репликацию и деление клетки.
86. Биосинтез тимидиловых нуклеотидов. Тимидиловые нуклеотиды входят в состав ДНК, содержащей дезоксирибозу. При помощи метода меченых атомов было показано, что этот синтез начинается не со свободнойдезоксирибозы, а путем прямого восстановления рибонуклеотидов у 2-го атома углерода. Химический смысл превращения рибонуклеотидов в дезоксирибо-нуклеотиды сводится к элементарному акту – восстановлению рибозы в 2-дезоксирибозу, требующему наличия двух атомов водорода. Непосредственным источником оказался восстановленный термостабильный белок тиоредоксин, содержащий две свободные SH-группы. Тиоредоксин легко окисляется, превращаясь в дисульфидную S-S-форму.
Дата добавления: 2015-01-29; просмотров: 334; Мы поможем в написании вашей работы!; Нарушение авторских прав