
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Параметры состояния жидкости и пара.
В соответствии с первым законом термодинамики теплота, подведенная к жидкости, затрачивается на увеличение ее внутренней энергии и осуществление работы. Т.к. в процессе нагревания жидкости удельный объем изменяется незначительно, то можно принять, что Sl = pdV = 0. В таком случае Sq` = du. Т.к. при Т0 = 273,15 К u0 = 0, получим
q` = u`.
Поскольку в изобарном процессе q` = Cp (Тн + Т0) = u` – u`+ p(V`– V0) = u`+ pV` – pV0`, то для данного случая имеем, что
q` = h` – pV0, откуда h`= q` – рV0`.
При низких давлениях увеличение относительно малое, и поэтому можно приравнять h ≈ q`.
При Т0 = 273,16 К энтропия S0 = 0 и поэтому
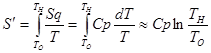
Теплота парообразования для сухого насыщенного пара

откуда  , где r – теплота парообразования.
, где r – теплота парообразования.
Увеличение энтропии в процессе парообразования определяется по формуле:

Состояние кипящей воды и сухого насыщенного пара определяется одним из параметров (р или ТН) и поэтому по таблицам для воды и водяного пара по известным давлению или температуре находим значения V`, V``, h`, S`, S``, r.
Влажный насыщенный пар как двухфазная система подчиняется закону адитивности, и поэтому каждый его параметр ПХ можно определить по формуле.
ПX = xП`` + П` (1 – x)
Отсюда следует, что
Vx = (1 – x)V` + xV`` = V` + x (V`` – V`)
hx = h` + x (h`` – h`) = h` + xr
Sx = S` + x (S`` – S`) = S` + xr/TH
Теплота перегрева пара
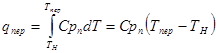
где Срп – средняя теплоемкость перегретого пара.
Поскольку процесс перегрева пара осуществляется при постоянном давлении, то энтальпию перегретого пара можно определить по формуле:
hпер = h`` + qпер = h`` + CрП (Тпер - ТН)
Энтропия перегретого пара:

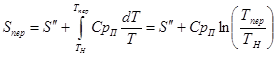
Удельный объем воды при нагревании от 0 до 40С уменьшается до минимального значения, после чего увеличивается.
Основные термические процессы водяного пара
Пар как реальный газ не подчиняется простым закономерностям идеальных газов, поэтому расчеты процессов, происходящих с водяным паром, производятся с помощью таблиц или графически с помощью диаграмм.
Наиболее удобно оценивать характер изменения параметров разных процессов на i-s диаграмме.
Расчетные соотношения для вычисления внешней работы, количества теплоты и изменения внутренней энергии в процессах изменения состояния водяного пара приведены в таблице.
| Процессы | Изменение внутренней энергии | Количество работы | Количество теплоты |
| Изохорный | ∆uv = (i2 – P2v) – (i1 – P1v) = i2 – i1 – v (P2 – P1) | lv = 0 | qv = ∆u |
| Изобарный | ∆uP = (i2 - Pv2) – (i1 – Pv1) = i2 – i1 – P(v2 – v1) | lP = q – ∆u = =P (v2 – v1) | qP = ∆i |
| Изотермный | ∆uT = (i2 – P2v2) – (i1 – P1v1) | lt = q – ∆u | qt = T (s2 – s1) |
| Адиабатный | ∆us = (i2 – P2v2) – (i1 – P1v1) | ls = ∆u = = u1 – u2 | qs = 0 |
Дата добавления: 2015-01-29; просмотров: 335; Мы поможем в написании вашей работы!; Нарушение авторских прав |