
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Обработка результатов химического анализа подземных вод
Химический анализ подземных вод может служить качественным показателем использования воды для хозяйственно-питьевого водоснабжения, бальнеологических, промышленных и хозяйственных целей, а также диагностическим признаком при гидрохимических методах поисков и разведки месторождений полезных ископаемых.
Результаты химического анализа подземных вод могут быть выражены в табличной или сокращенной отчетной форме в виде формулы Курлова.
1). Табличная форма выражения химического анализа.
Количественно концентрация катионов и анионов выражается в г/дм3, мг/дм3, а эквивалентное содержание – миллимолях (ммоль) и процентах (%).
Пример расчета химического анализа воды в табличной форме приводится ниже.
Таблица 1
| Ионы | Содержание, мг/дм3 | Эквивалентное содержание | |
| ммоль | % | ||
| Na+ Ca2+ Mg2+ | 88,04 22,75 15,62 | 69,9 17,6 12,5 | |
| Сумма катионов | - | 126,41 | |
| Cl- SO42- HCO3- | 98,40 17,43 3,51 | 82,5 14,5 3,0 | |
| Сумма анионов | - | 119,34 | |
| М (сухой остаток) | - | - | |
| СО2 (свободный) | - | - | |
| рН водородный показатель | 5,3 | - | - |
| Т воды, градус С | - | - |
Эквивалентное (молярное) содержание определяется путем умножения каждого иона на пересчетный коэффициент, учитывающий его атомный вес и валентность и представляющий собой величины, обратные эквивалентным массам ионов (таблица 2).
Таблица 2
| Катионы | Коэффициент | Анионы | Коэффициент |
| Na+ Ca2+ Mg2+ | 0,0435 0,0499 0,08222 | Cl- SO42- HCO3- | 0,0282 0,0208 0,0164 |
Для пересчета в %-эквивалентную форму суммы катионов и анионов в миллимолях принимаются за 100%, а затем определяется доля каждого катиона и аниона в % от соответствующей суммы катионов и анионов.
Химический анализ считается достоверным, если ошибка анализа не превышает 5%.
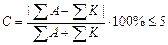
В нашем случае С = 2,88%. Анализ достоверен.
2) Сокращенная форма выражения химического анализа (формула М.Г. Курлова)
Формула Курлова представляет собой псевдодробь, в числителе которой в порядке убывания в %-эквивалентной форме располагаются анионы, а в знаменателе – катионы. Ионы, содержание которых менее 1%, в формулу не включаются. Проценты округляют до целых чисел.
Слева от дроби указывается содержание газов в мг/дм3 и минерализация (М) в г/дм3, за которую принимается сухой остаток. Справа записывают значение (рН), температуру воды (Т) в градусах Цельсия, дебит источника в м3/сут и содержание микроэлементов, если такие имеются.
В нашем случае формула Курлова (таблица 1):

3) Наименование воды по химическому составу.
Наименование химического типа подземных вод должно состоять из двух частей, отражающих преобладающий анионный и катионный состав воды. Наименование химического типа воды начинается с ее анионного, а затем катионного состава в %-эквивалентной форме, превышающего 20% от суммы миллимолярной концентрации. Перечисление ионов производится в порядке возрастания концентрации – от меньшего значения к большему.
В сокращенном анализе анионы представлены хлоридами, сульфатами и гидрокарбонатами, а катионы – натрием, кальцием и магнием. В нашем случае вода хлоридно-натриевая.
4) Классификация воды по минерализации.
В зависимости от величины минерализации, за которую принимается сухой остаток, подземные воды классифицируются в соответствии с приведенной таблицей 3.
Таблица 3
| Минерализация М, г/дм3 | Подгруппа | Группа |
| £ 0,5 >0,5-1,0 | Весьма пресные Пресные | Пресные |
| >1,0-1,5 >1,5-3,0 >3,0-5,0 >5,0-10,0 >10,0-25,0 | Весьма слабосолоноватые Слабо солоноватые Умеренно солоноватые Солоноватые Сильно солоноватые | Солоноватые |
| >25,0-36,0 >36,0-50,0 | Слабосоленые Сильносоленые | Соленые |
| >50,0-150,0 >150,0-350,0 >350,0 | Рассолы слабые Рассолы крепкие Рассолы весьма крепкие (рапа) | Рассолы |
В нашем случае М = 6,9 г/дм3 . Вода солоноватая.
5) Реакция воды по рН.
Реакция воды обусловлена величиной концентрации водородных ионов рН, которая представляет собой обратный логарифм концентрации ионов водорода. Классификация воды по водородному показателю приведена в таблице 4.
Таблица 4
| Водородный показатель рН при Т22оС | Подгруппа | Группа |
| £ 3,5 >3,5-4,5 >4,5-5,5 >5,5-6,0 | Весьма кислая Кислая Умеренно кислая Слабокислая | Кислая |
| >6,0-8,0 | Нейтральная | Нейтральная |
| >8,0-8,5 >8,5-9,0 >9,0-9,5 >9,5 | Слабощелочная Умеренно щелочная Щелочная Весьма щелочная | Щелочная |
В нашем случае рН = 5,3. Вода умеренно кислая.
6) Классификация подземных вод по температуре воды.
Классификация воды по температуре приведена в таблице 5.
Таблица 5
| Температура, ТоС | Наименование |
| <0 >0-4 >4-20 >20-37 >37-50 >50-75 >75-100 >100-200 >200-374 | Переохлажденная Очень холодная Холодная Теплая Очень теплая Горячая Очень горячая Слабо перегретая Весьма перегретая |
Примечание: воды с температурой от 20 до 100оС называются термальными.
В нашем случае Т15оС. Вода холодная.
7) Жесткость воды.
Жесткость воды имеет большое значение при использовании подземных вод для питьевого водоснабжения, промышленных и хозяйственных целей. Жесткость воды обусловливается содержанием в ней солей кальция и магния. Измеряется в миллимолях (мг-экв/дм3).
Различают общую жесткость (ОЖ), устранимую или временную жесткость (УЖ) и постоянную жесткость (ПЖ).
Общая жесткость обусловлена присутствием в воде гидрокарбонатов, хлоридов и сульфатов кальция и магния и равняется сумме устранимой и постоянной жесткости.
Устранимая жесткость обусловлена присутствием в воде гидрокарбонатов кальция и магния. Такая жесткость получила название карбонатной (КЖ) и может быть устранена при кипячении
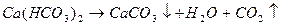
Карбонат кальция и магния выпадает в осадок, образуя накипь. При использовании такой воды для промышленных и коммунальных целей происходит отложение карбоната кальция и магния на стенках котлов и трубопроводов, что приводит к выводу их из эксплуатации.
При высоком содержании НСО3- в воде, превышающем суммарную концентрацию кальция и магния, вся жесткость считается карбонатной.
Постоянная жесткость обусловлена наличием в воде сульфатов и хлоридов кальция и магния и равняется разности между общей и карбонатной жесткостью.
Классификация воды по общей жесткости приводится в таблице 6 (ГОСТ 6055-86).
Таблица 6
| Содержание в ммоль | Группа жесткости |
| £ 1,5 >1,5-3,0 >3,0-6,0 >6,0-9,0 >9,0 | Очень мягкая Мягкая Умеренно жесткая Жесткая Очень жесткая |
Подземные воды, жесткость которых превышает 7 ммоль, не могут быть использованы для питьевого и промышленного водоснабжения.
В нашем случае общая жесткость составляет 38,37 ммоль, устранимая (карбонатная) – 3,50 ммоль, постоянная – 34,86 ммоль. Вода очень жесткая, непригодная для питьевого и промышленного водоснабжения.
8) Пригодность для питьевого водоснабжения.
Пригодность воды для питьевого водоснабжения нормируется ГОСТ 6055-86 «Вода питьевая». В рамках сокращенного гидрохимического анализа нормативными являются минерализация, общая жесткость, содержание Cl- и SO2-4 , а также величина рН с предельно допустимыми концентрациями, приведенными в таблице 7.
Таблица 7
| Наименование показателей | ПДК | Содержание в нашем примере | Степень пригодности |
Минерализация М, мг/дм3
Общая жесткость ОЖ, ммоль
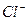 , мг/дм3 , мг/дм3
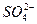 , мг/дм3
рН , мг/дм3
рН
| 6,5-8,5 | 38,37 5,3 | Не пригодна Не пригодна Не пригодна Не пригодна Не пригодна |
В нашем случае вода по всем компонентам не пригодна для водоснабжения.
9) Пригодность для ирригационных целей.
Пригодность использования подземных вод, в том числе и шахтных, для ирригационных целей в сельском хозяйстве нормируется степенью минерализации воды и расчетным ирригационным коэффициентом. Классификация воды по минерализации, нормирующая степень пригодности для орошения сельскохозяйственных угодий, приведена в таблице 8.
Таблица 8
| Минерализация, г/дм3 | Степень пригодности для орошения |
| £1,7 >1,7-5,0 >5,0 | Пригодна Пригодна условно (возможно засоление) Не пригодна |
В нашем случае минерализация 6,9 г/дм3. Вода для орошения не пригодна.
Расчет ирригационного коэффициента выполняется в зависимости от соотношения ионов натрия, хлора и сульфатов в эквивалентной форме в миллимолях.
 а)
а) 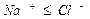

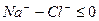
 б)
б) 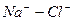 > 0
> 0
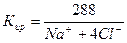
 |
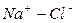 >
> 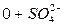
 в) Na+> суммы всех солей
в) Na+> суммы всех солей
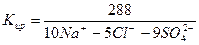
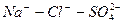 > 0
> 0
Во втором случае избыточное содержание катионов натрия может быть нейтрализовано содержащимся в воде сульфат-ионом. В третьем случае избыток натрия накапливается в почве в виде поглощенных катионов.
В первых двух случаях вода улучшению не подлежит, в третьем случае воду можно улучшить добавкой гипса. Классификация воды по ирригационному коэффициенту приведена в таблице 9.
Таблица 9
| Ирригационный коэффициент | Характеристика воды |
| >18 >6-18 ³1,2-6,0 <1,2 | Хорошая Удовлетворительная Неудовлетворительная Очень плохая |
В нашем случае Na+< Cl-, Кир = 0,58. Вода очень плохая и улучшению не подлежит.
10) Агрессивность подземных вод.
Подземные воды в зависимости от состава могут оказывать разрушающее действие на бетоны, цементы и металлы. Оценка агрессивности подземных вод по отношению к бетонам марки W4 и металлам производится на основании таблиц 5-7 и 26 СНиП
2.03.11-85 «Защита строительных конструкций от коррозии» (в скобках указаны номера таблиц согласно СНиП).
Дата добавления: 2015-04-18; просмотров: 1349; Мы поможем в написании вашей работы!; Нарушение авторских прав |