
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равновесие и кинетика процесса абсорбции триоксида серы.
Последней технологической стадией производства серной к-ты(СК) контактным методом является извлечение SO3 из газовой смеси и превращение ее в СК. Абсорбция SO3 происходит по реакции:
n SO3+H2SO4=H2SO4*SO3+(n-1)SO3, H2SO4*SO3+H2O=2 H2SO4, SO3+mH2O=H2SO4 + (m-1) H2O
В зависимости от количественного соотношения Н2О и SO3 получают H2SO4 различной концентрации при n меньше 1 образуется олеум, при n больше 1 водный раствор H2SO4, n=1 100% H2SO4 или моногидрат.
Газообразный SO3 наиболее полно абсорбируется СК с массовой долей 98,3 %. При мен или большей конц H2SO4 ее способность поглощать SO3 ухудшается, кол-во абсорбирующейся SO3 опред по ф-ле: G=K*F*Δp
К коэф абсорбции, кг/(м2*ч*Па), F – поверхность насадки, м2, Δp – движ сила абсорбции, Па
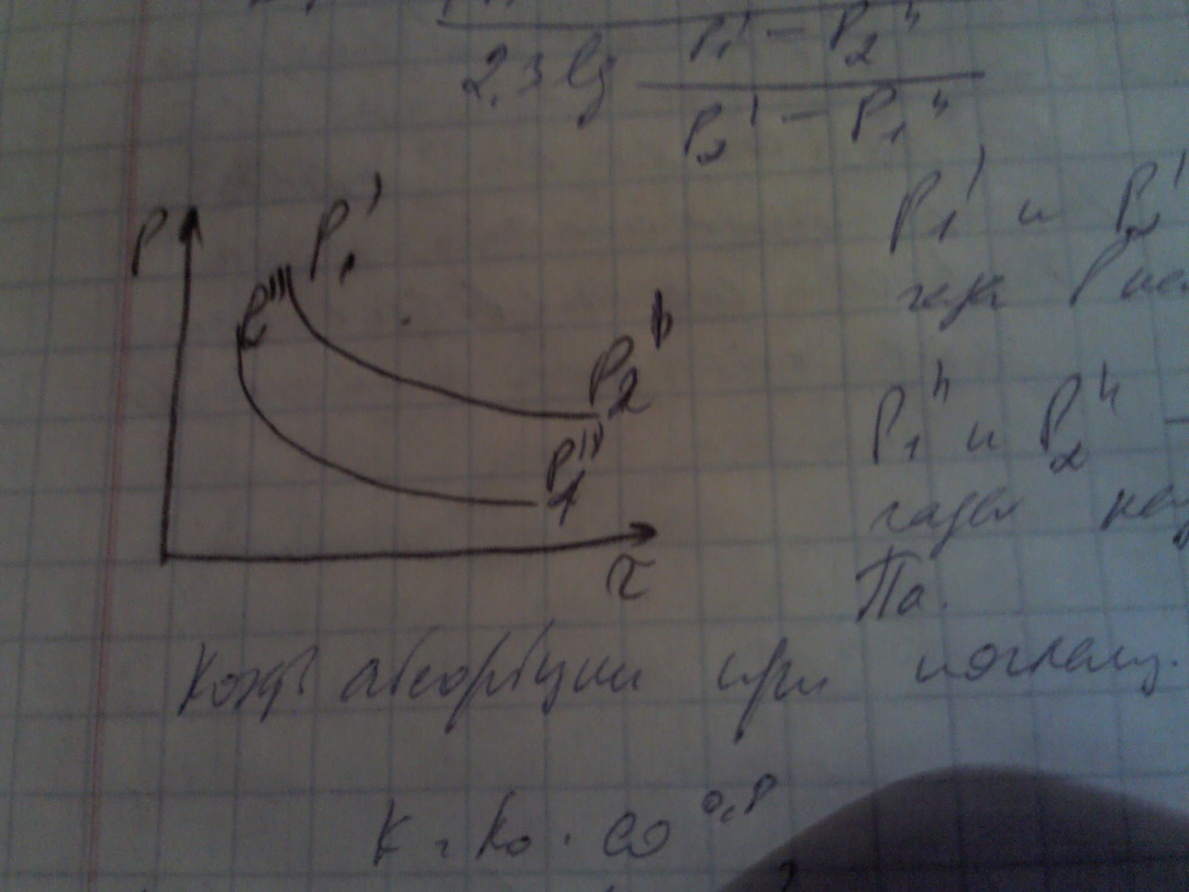
Движ сила находится по ф-ле:
Δp=(Р1’ – P2’’) – (P2’-P1’’)/(2,3 lg((Р1’ – P2’’)/ (P2’-P1’’))), Р1’ и Р2’ парциальные давления абсорб газа в нач и конц пр-са, Па, P1’’ и P2’’ равновесное давление абсорбирующего газа над жид при вх и вых жид, Па\
 Коэф абсорбции при поглащении SO3 H2SO4, м.б. определено по ф-ле: К=К0*ω0,8, К0- коэф зависящий от конц и температуры к-ты,, ω фиктивная скорость газа в абсорбере, без учета заполнения его насадкой, м/с
Коэф абсорбции при поглащении SO3 H2SO4, м.б. определено по ф-ле: К=К0*ω0,8, К0- коэф зависящий от конц и температуры к-ты,, ω фиктивная скорость газа в абсорбере, без учета заполнения его насадкой, м/с
После абсорбции газовая смесь вместе с поглощенным SO3 выводится в атмосферу. Для умен потерь SO3 с отходящими газами его поглощение должно быть наиб полным , полнота абсорбции зависит также от конц применяемой для абсорбции к-ты. Над СК с конц менее 98,3 % равновесное давление SO3 близко к нулю, а равновесное давление паров воды значительное, поэтому с поверхности СК происходит испаренте молекул воды, основ кол-во молекул SO3 движущихся к поверхности СК абсорбируется ею, но часть молекул встречается с молек воды, испар с поверхности СК и дифундирующими в основной поток газа, сталкиваясь эти молекулы соед с образованием паров СК, к-рые затем конденсируются в объеме с образованием мельчайших капель или тумана СК. SO3газ+Н2Опар= H2SO4пар+ H2SO4туман
 Чем ниже конц СК и выше ее температура, тем больше выдел из нее паров воды, больше образуется тумана и больше теряется SO3 над к-той конц более 98,3% равновесное давление SO3больше 0, поэтому SO3 абсорбируется СК неполностью, в этом случае отходящие газы также уносят в атмосферу часть SO3, т.е при конц орашающей к-ты менее и более 98,3% от абсорбции SO3 снижается ,она тем ниже чем выше температура. При конц к-ты 98,3 % равновесные давления паров воды и SO3 малы и близка к нулю но равновесные давления паров СК значительны поэтому происходит испарение паров СК с ее поверхности, однако при темпер нтже 80 при к-рых на практике ведется пр-сс абсорбции. Равновесное давление паров СК оч мало поэтому в производственных усл. к-ты с конц 98,3 % обладает наиб высокой абсорбционной способностью по отношению к SO3. Повыш температуры сниж ст абсорбции, т.к повыш давления паров воды над разбавленной к-той и давлением SO3 над конц к-той, что приводит к образованию тумана и абсорбер начинает газить.
Чем ниже конц СК и выше ее температура, тем больше выдел из нее паров воды, больше образуется тумана и больше теряется SO3 над к-той конц более 98,3% равновесное давление SO3больше 0, поэтому SO3 абсорбируется СК неполностью, в этом случае отходящие газы также уносят в атмосферу часть SO3, т.е при конц орашающей к-ты менее и более 98,3% от абсорбции SO3 снижается ,она тем ниже чем выше температура. При конц к-ты 98,3 % равновесные давления паров воды и SO3 малы и близка к нулю но равновесные давления паров СК значительны поэтому происходит испарение паров СК с ее поверхности, однако при темпер нтже 80 при к-рых на практике ведется пр-сс абсорбции. Равновесное давление паров СК оч мало поэтому в производственных усл. к-ты с конц 98,3 % обладает наиб высокой абсорбционной способностью по отношению к SO3. Повыш температуры сниж ст абсорбции, т.к повыш давления паров воды над разбавленной к-той и давлением SO3 над конц к-той, что приводит к образованию тумана и абсорбер начинает газить.
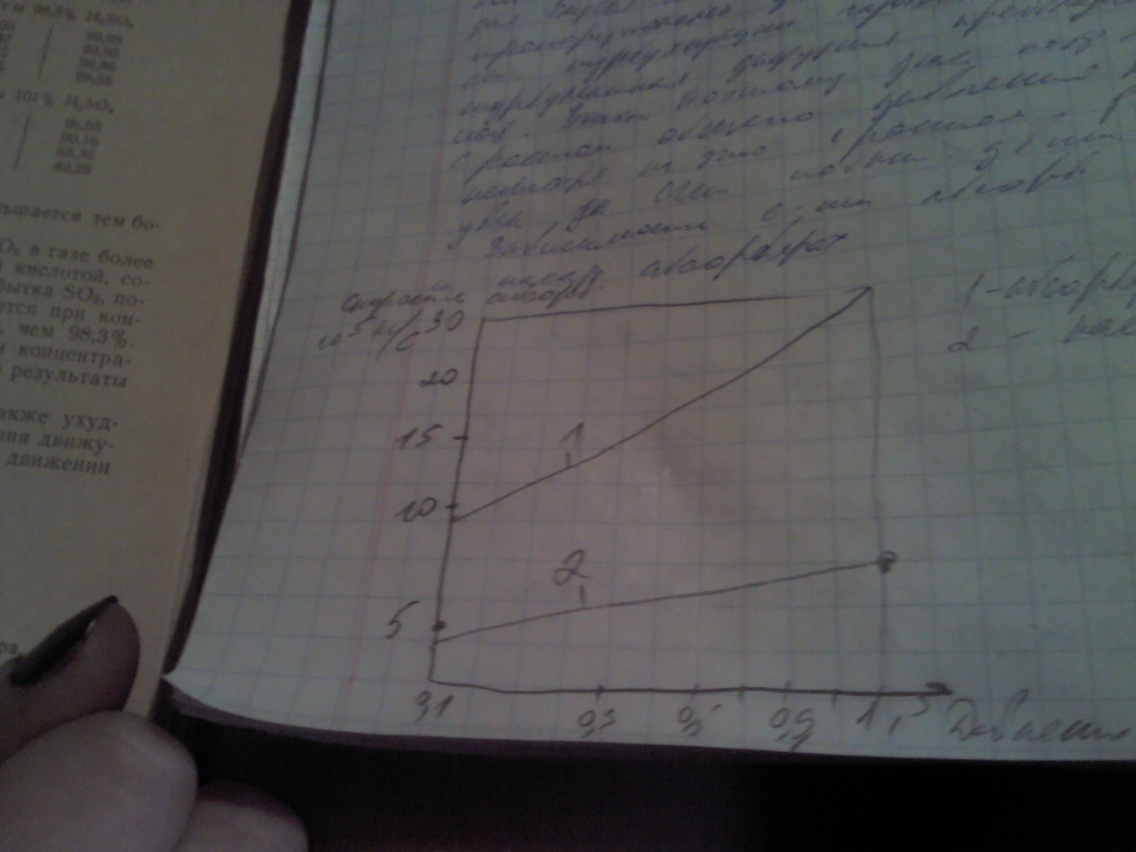
Из графика видно, что наилучш абсорбционной способностью обладает обл 98,3% Ск, а при 60С. Для с-мы SO3-Н2SO4 принято считать, скорость массо пперадачи в газовой фазе,коэф масопередачи опред коэф диффузии для случая молекулярной дифузии, он обратно пропорционален давлению. В реал аппаратах ст турбулизации газовой фазы оч ведика и турбулентная диффузия преобладает над молекулярной. Поэтому значение коэф массопередачи с ростом общего давления падает не линейно не смотря на это с ростом р скорость абсорб увел за счет повыш движ силы.
Зависимость степени абсорбции от давления в тарельчатых и насадочных абсорберах.
Дата добавления: 2015-04-18; просмотров: 676; Мы поможем в написании вашей работы!; Нарушение авторских прав |