
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Вычисление электродных потенциалов по уравнению Нернста. Стандартный электродный потенциал.
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией или активностью, равной 1 моль/л, измеренный в сравнении со стандартнымводородным электродом, потенциал которого при 25 °С принимается равным нулю (Е° = 0; G° = 0).Располагая металлы в ряд по мере возрастания их стандартныхэлектродных потенциалов (Еº), получают ряд напряжений металлов.
Положение того или иного металла в ряду напряжений характеризует его восстановительную способность. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл и тем меньшие окислительные способностипроявляют его ионы, и наоборот.Стандартные электродные потенциалы измеряются в приборах,называемых гальваническими элементами. Гальваническими элементами называют приборы, служащие для преобразования химической энергии окислительно-восстановительной реакции в энергиюэлектрическую. Окислительно-восстановительная реакция, котораяхарактеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение:
ЭДС = ΔЕ = Еок – Евос.
Из уравнения ΔG = –nFΔЕследует, что только при ΔЕ > 0 веЛичина ΔG < 0, то есть процесс принципиально возможен.Электродный потенциал металла Е зависит от концентрацииего ионов в растворе. Эта зависимость выражается уравнением Нернста 
Где
— электродный потенциал, 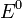 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
 — абсолютная температура;
— абсолютная температура;
 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
 и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Дата добавления: 2015-04-18; просмотров: 590; Мы поможем в написании вашей работы!; Нарушение авторских прав |