
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. СЛАБЫЕ И СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ
Большинство химических реакций протекают в растворах. Наиболее универсальным растворителем является вода, что объясняется её уникальными физико-химическими свойствами, большой химической активностью и доступностью.
При растворении в воде, как в одном из полярных растворителей, вещества претерпевают значительные изменения, в ряде случаев это проявляется в электрической проводимости.
Химически чистая вода практически не проводит электрический ток. Водные растворы большинства органических соединений (спиртов, альдегидов, кетонов, углеводов) также не проводят ток. Растворы же большинства неорганических соединений (солей, кислот, оснований) электропроводны.
Вещества придают раствору электропроводимость, если они состоят из ионов или из молекул, способных при растворении распадаться на ионы. Такие соединения называются электролитами. Вещества, растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Проводимость электролитов определяется подвижностью ионов и принципиально отличается от проводимости металлов. Электролиты считаются проводниками второго рода.
Процесс распада вещества на ионы называют электролитической диссоциацией. При растворении электролита диполи воды за счёт ориентационного или ион-дипольного взаимодействия притягиваются к полярным молекулам или к ионам растворяемого вещества. Полярные молекулы в силовом поле окружающих их диполей растворителя поляризуются, и вследствие сильного смещения связывающих электронов связь становится ионной. Происходит ионизация молекулы, а затем диссоциация с образованием свободных ионов. Подготовительным этапом электролитической диссоциации является сольватация вещества – взаимодействие частиц растворителя с растворяющемся веществом. Если растворителем является вода, процесс сольватации называется гидратацией.
В результате диссоциации образуются катионы (положительно заряженные ионы) и анионы (отрицательно заряженные ионы), суммарный заряд которых равен нулю. Каждый ион в водном растворе окружён гидратной оболочкой, состоящей из молекул воды, чтобы показать её наличие в уравнение вводят aq: NaCl = Na+ (aq) + Clˉ (aq). Однако для удобства в уравнении воду можно не указывать:
NaCl = Na+ + Clˉ.
Сильные электролиты диссоциируют полностью и в растворе находятся в виде ионов. Процесс диссоциации сильного электролита принято считать необратимым.
ПРИМЕР 1.
Определите концентрацию ОН− в 0,05 М растворе Ва(ОН)2.
РЕШЕНИЕ.
Составляем уравнение диссоциации Ва(ОН)2:
Ва(ОН)2 → Ва2+ + 2ОН−.
Согласно уравнению реакции,
из 1 моль Ва(ОН)2 образуется 2 моль ОН−,
тогда из 0,05 моль Ва(ОН)2 образуется х моль ОН−.
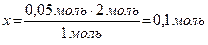
Вещества, диссоциирующие незначительно, являются слабыми электролитами, и в растворах в основном представлены молекулами и только частично ионами.
Сила электролита, его способность распадаться на ионы, может быть охарактеризована при помощи степени диссоциации (α). Эта величина показывает отношение молярной концентрации продиссоциировавших молекул (СД) к исходной молярной концентрации растворённых молекул (С0).
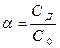 (1)
(1)
Степень диссоциации может быть выражена в долях или процентах.
Степень диссоциации сильных электролитов принимает значения от 100% до 33%, при α < 3% электролиты – слабые, при значениях α от 3% до 33% - средней силы.
К сильным электролитам относятся растворимые основания, кроме гидроксида аммония, соли, некоторые кислоты (например, HNO3, H2SO4, HCl, HBr, HJ, H2Cr2O7, HClO4, HClO3, KMnO4 H2SeO4 и т.д.). Слабыми электролитами являются трудно растворимые основания, NH4OH, некоторые кислоты (например, H2CO4, HNO2, H2SO4, H2SiO3, H2SO3, H2S, HOCl, HF, HCN и т.д.). Ортофосфорная кислота H3РO4 является средним по степени диссоциации электролитом.
Степень диссоциации электролита зависит и от природы растворителя. Одно и тоже вещество в зависимости от растворителя может быть и сильным электролитом, и слабым электролитом, и неэлектролитом. Например, HBr в воде проявляет свойства сильного электролита, а в 100% уксусной кислоте становится электролитом слабым.
В растворах слабых и средних по силе электролитов устанавливается равновесие между образующимися ионами и недиссоциировавшими молекулами, например, HNO2 ↔ H+ + NO2–. В виду обратимости диссоциация таких электролитов подчиняется принципу Ле-Шателье. Одним из способов повышения диссоциации слабого электролита является разбавление раствора. Уменьшение степени диссоциации может быть вызвано добавлением в раствор электролита одноимённых ионов. Так, при добавлении к раствору уксусной кислоты её соли (например, ацетата натрия), повышается концентрация ацетат-ионов и равновесие процесса СН3СООН ↔ СН3СОО− + Н+ смещается влево. Уксусная кислота будет находится в растворе преимущественно в виде молекул.
Равновесие реакции диссоциации слабых электролитов характеризуется константой равновесия – константой диссоциации (КД):
 (2)
(2)
где [H+], [NO2–] – равновесные концентрации ионов, моль/л;
[HNO2] – равновесная концентрация недиссоциировавших молекул, моль/л.
Электролит считается сильным, если КД > 10-2.
Значение константы диссоциации не зависит от концентрации электролита, а зависит от его природы и температуры.
Таким образом, диссоциирующая способность слабого электролита описывается двумя величинами – степенью и константой диссоциации. Две эти характеристики связаны законом разбавления, установленным В. Оствальдом (1888г.): степень диссоциации слабого электролита увеличивается при разбавлении раствора обратно пропорционально корню квадратному из его молярной концентрации.
 (3)
(3)
где С0 – молярная концентрация раствора.
Если α < 0,01, то для расчётов можно использовать приближённое соотношение  . (4)
. (4)
ПРИМЕР 2.
Определите концентрацию ионов ОН− в 0,01 М растворе гидроксида аммония (КД (NH4OH) = 1,77.10–5).
РЕШЕНИЕ.
Решение 1. Используя закон разбавления, находим степень диссоциации NH4OH.
 ;
; 
Находим концентрацию диссоциировавших частиц.
 ;
;  ;
; 
Согласно уравнению реакции С (ОН−) = СД = 4,2.10-4 моль/л.
Решение 2. Концентрацию ионов ОН− также можно вычислить, пользуясь соотношением  (5);
(5);
 .
.
В случае наличия в молекуле двух или более связей, которые ионизируются с последующей диссоциацией, процесс распада на ионы протекает ступенчато и для каждой ступени определяется значение константы диссоциации, например,
I. Н2СО3 ↔ Н+ + НСО3–, КД/ = 4,5.10–7;
II. НСО3− ↔ Н+ + СО32−, КД// = 4,8.10–11
или I. Pb(OH)2 ↔ PbOH+ + OH−, КД/ = 9,55.10–4
II. PbOH+ ↔ Pb2+ + OH−, КД// = 3,0.10–8.
При этом константа диссоциации для каждой последующей стадии всегда меньше, чем для предыдущей, т.к. увеличение заряда диссоциирующей частицы затрудняет выход из неё иона с противоположным зарядом.
Сильные многоосновные кислоты и многокислотные щёлочи диссоциируют по I ступени как сильные электролиты, а по II ступени – как электролиты средней силы.
Дата добавления: 2015-04-18; просмотров: 308; Мы поможем в написании вашей работы!; Нарушение авторских прав |