
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Критерии самопроизвольного протекание химических реакций.Энергия Гиббса.
Реальные процессы проводятся, как правило, в закрытых системах в изобарно-изотермических или изохорно-изотермических условиях. Критерием направленности самопроизвольного процесса в этих случаях является знак изменения энергии Гиббса DG или энергии Гельмгольца DА в системе.
G=H-TS=U+pV-TS, A=U-TS. TS хар-ет связанную с частицами системы энергию, т.е. ту часть полн. Е сист., кот. рассеив. в окр. среде в виде теплоты (потерянная работа). \энергия Гиббса (Гельмг.) – та часть полн. Е системы, кот. м.б. превр. в работу в изоб-изот Илии изох-изот проц. Е G и A – функции состояния системы, их абс. значения не поддаются вычислению. Для выяснения критерия направленности самопр. проц. в закр. сист: dG=dU+dpV+dVp-TdS-dTS, в силу TdS>=dU+pdV => dG<=-SdT+VdP. Для изобарно-изотермического: dG<=0,  . В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изоб.-изот. условиях. При DG=0 система нах. в сост. термод. равн.
. В закрытой системе знак изменения энергии Гиббса является критерием направленности самопроизвольного процесса при проведении его в изоб.-изот. условиях. При DG=0 система нах. в сост. термод. равн.
Изохорно-изот. проц. в закр. сист. терм-ки возможен при DА<0, невозм, при DА>0, система нах. в термод. равн. при =0.
При const T, p=101,3 кПа:  - Ур-ие Гиббса-Гельмгольца. При равенстве стандартной Е Гиббса нулю в системе устанавливается подвижное ТР, положение которого может смещаться в любую сторону при изменении внешних факторов. DG при 298 К можно рассчитать по стандартным Е Гиббса обр-я исходных веществ и продуктов реакции
- Ур-ие Гиббса-Гельмгольца. При равенстве стандартной Е Гиббса нулю в системе устанавливается подвижное ТР, положение которого может смещаться в любую сторону при изменении внешних факторов. DG при 298 К можно рассчитать по стандартным Е Гиббса обр-я исходных веществ и продуктов реакции  . Стандартной энергией Гиббса образования в-ва называют ст. Е Гиббса р-ции обр-я 1 моль данного соединения из простых в-в, находящихся в термод-ки устойчивых модификациях,кто провед. в станд. термод . услов.
. Стандартной энергией Гиббса образования в-ва называют ст. Е Гиббса р-ции обр-я 1 моль данного соединения из простых в-в, находящихся в термод-ки устойчивых модификациях,кто провед. в станд. термод . услов.
Химический потенциал: для открытой системы G=f(p, T, ni), ni- кол-во в-ва i-го компонента, моль. Масса системы при этом const, но ее состав изменяется. Полный дифференциал :  . Хим. потенциал i-го компонента:
. Хим. потенциал i-го компонента:  . По физ. смыслу : ХП означает изм. G сист. в PT процессе при доб. 1 моль i-го комп. к беск. большому кол-ву смеси, чтобы ее состав был const (nj=const). Для ид. р-ров:
. По физ. смыслу : ХП означает изм. G сист. в PT процессе при доб. 1 моль i-го комп. к беск. большому кол-ву смеси, чтобы ее состав был const (nj=const). Для ид. р-ров: 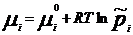 ,
,  .
. 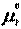 -стандартный хим. потенциал i-го комп. (при отн-ном давлении
-стандартный хим. потенциал i-го комп. (при отн-ном давлении 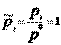 ), ХЭ и-ое – мольная доля I компонента. Второе уравнение справедливо для любых ид-х р-ров, первое – для газовых. Для индивид в-ва станд. хим. пот = станд. Е Гиббса обр-я в-ва. При проведении реакции в PT условиях:
), ХЭ и-ое – мольная доля I компонента. Второе уравнение справедливо для любых ид-х р-ров, первое – для газовых. Для индивид в-ва станд. хим. пот = станд. Е Гиббса обр-я в-ва. При проведении реакции в PT условиях:  . Хим. переменная:
. Хим. переменная:  . (глубина, степень протекания реакции, число пробегов).
. (глубина, степень протекания реакции, число пробегов).  . Получим:
. Получим:  . – общие условия хим. равновесия и самопр. протек. реакции, идущей в закр. системе, при p, T=const.
. – общие условия хим. равновесия и самопр. протек. реакции, идущей в закр. системе, при p, T=const.
Дата добавления: 2015-04-21; просмотров: 256; Мы поможем в написании вашей работы!; Нарушение авторских прав |