
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Факторы влияющие на скорость коррозии.
Факторы влияющие на скорость коррозии металлов. Влияние рН раствора.Пассивация металла чаще всего связана с образованием на го поверхности малорастворимых пленок оксидов и гидроксидов. Реакция среды, т.е. рН раствора, влияет на характер растворимости этих пленок. В том случае если оксиды обладают основными свойствами, защитное действие их в большей степени будет проявляться в щелочных средах, где растворимость этих пленок меньше. Если оксидные (гидроксидные) пленки металлов обладают кислотными свойствами, коррозийная устойчивость в кислых средах. Состав среды. Скорость коррозии в водных растворах зависит от природы растворенных в воде веществ, что связано со следующими факторами:1) растворенные соли гидролизируются, изменяя рН растворов. 2) растворенное в воде вещество может давать с металлом или продуктами его коррозии пленку малорастворимых соединений. 3) некоторые анионы, чаще галогены адсорбируясь на поверхности металла, разрушают оксидную пленку. Большие неприятности связаны с хлоридом натрия! 4) Наличие веществ 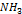 ,
, 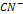 и др.
и др.
44. Методы защиты:
1)Обработка среды в которой протекает коррозия. К подобным методам относят процессы нейтрализации среды, обескислороживание, введение ингибиторов.2)Метод деаэрации. Удаление из раствора кислорода. 3)Легирование металла. Для сталей, работающих в агрессивных газовых и жидких средах. Так же существуют защитные покрытия неметаллические покрытия (лаки, краски, резины, эмали и др.) и химические (спец. создаваемые на поверхности металла химически стойкие соединения: оксиды, фосфаты, сульфаты и др.).
45. Металлические защитные покрытия делятся на 4 типа:
1)Покрытия оксидный слой которых делает металлы пассивным (Al, Zn, Sn, Cr, Pb, Ni). 2)Стойкие химические покрытия (Au, Ag, Cu). 3)Анодные покрытия. Если нанести покрытие другого более электроотрицательного металла, то в случае возникновения условий электрохимической коррозии разрушаться будет покрытие, а не металл. 4) Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает.
46. Электрохимическая защита:
1) Протекторная (Защищаемое от коррозии изделие соединяют с металлическим пластиной из более электроотрицательного металла (протектора). Это равносильно созданию гальвнического элемента, в котором протектор является анодом и будет разрушаться.2) Катодная защита (отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (например, подпочвенная вода), присоединяется к катоду внешнего источника тока В ту же среду помещают металлолом, который соединяют с анодом внешнего источника тока. Металлолом, являясь анодом, подвергается разрушению, предохраняя от разрушения защищаемую конструкцию. На защищаемую конструкцию от выпрямителя подается отрицательный потенциал и, следовательно, на ней возможны процессы только восстановления.3) Анодная защита (используется только для тех металлов, которые при анодной нагрузке способны образовать на своей поверхности пассивные оксидные или солевые пленки, защищающие металл от коррозии, например, железо в серной кислоте. Защищаема конструкция присоединяется к положительному полюсу внешнего источника тока. В ту же среду помещают металлолом с отрицательным полюсом внешнего источника тока.
Дата добавления: 2015-04-21; просмотров: 252; Мы поможем в написании вашей работы!; Нарушение авторских прав |