
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Физические свойства белков
1. В живых организмах белки находятся в твердом и ра
створенном состоянии. Многие белки являются кристаллами, однако, они не дают истинных растворов, т.к. молекула их имеет очень большую величину. Водные растворы белков – это гидрофильные коллоиды, находящиеся в протоплазме клеток, и это активные белки. Кристаллические твердые белки – это запасные соединения. Денатурированные белки (кератин волос, миозин мускулов) являются опорными белками. 2. Все белки имеют, как правило, большую молекулярную массу. Она зависит от условий среды (t°, рН) и методов выделения и колеблется от десятков тысяч до миллионов. 3. Оптические свойства. Растворы белка преломляют световой поток, и чем больше концентрация белка, тем сильнее преломление. Пользуясь этим свойством, можно определить содержание белка в растворе. В виде сухих пленок белки поглощают инфракрасные лучи. Они поглощаются пептидными группами.Денатурация белка – это внутримолекулярная перегруппировка его молекулы, нарушение нативной конформации, не сопровождающиеся расщеплением пептидной связи. Аминокислотная последовательность белка не изменяется. В результате денатурации происходит нарушение вторичной, третичной и четвертичной структур белка, образованных нековалентными связями, и биологическая активность белка утрачивается полностью или частично, обратимо или необратимо в зависимости от денатурирующих агентов, интенсивности и продолжительности их действия. Изоэлектрическая точкаБелки, как и аминокислоты, - амфотерные электролиты, которые мигрируют в электрическом поле со скоростью, зависящей от их суммарного заряда и рН среды. При определенном для каждого белка значении рН его молекулы электронейтральны. Это значение рН называется изоэлектрической точкой белка. Изоэлектрическая точка белка зависит от числа и природы заряженных групп в молекуле. Белковая молекула заряжена положительно, если рН среды ниже величины ее изоэлектрической точки, и отрицательно, если рН среды выше значения изоэлектрической точки данного белка. В изоэлектрической точке белок обладает наименьшей растворимостью и наибольшей вязкостью, в результате чего происходит наиболее легкое осаждение белка из раствора – коагуляция белка. Изоэлектрическая точка – одна из характерных констант белков. Однако если довести раствор белка до изоэлектрической точки, то сам по себе белок все же не выпадает в осадок. Это объясняется гидрофильностью белковой молекулы.
9. Физическо-химические свойства белков определяются их высокомолекулярной природой, компактность укладки полипептидных цепей и взаимным расположением остатков аминокислот. Молекулярная масса варьируется от 5 до 1 млн., а константы седиментации - от 1 до 20 (и выше). Средний удельный объем белковых молекул -0,70-0,75 см3/г, а константы диффузии - 106-108 см2/с. Максимум поглощения белков, в УФ-области спектра, обусловленный наличием ароматических аминокислот, находится вблизи 280 нм. Белки дают ряд цветных реакций, обусловленных наличием определенных аминокислотных остатков или химических группировок. К важнейшим из них относятся: биуретовая реакция (пептидные связи), ксантопротеиновая реакция (ароматические ядра остатков тирозина, триптофана, фенилаланина), Адамкевича реакция (индольное кольцо триптофана), Миллона реакция (фенольный радикал тирозина), Паули реакция (имидазольное кольцо гистидина), Сакагучи реакция (гуанидиновая группа аргинина) и нингидриновая реакция (аминограппа).
10.Все белки принято делить на простые белки ,или протеины, и сложные белки , или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической группы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов. МеталлопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Исходя из химического строения углеводного компонента, выделяют 2 группы:Истинные -- в качестве углеводного компонента наиболее часто встречаются моносахариды. Протеогликаны -- построены из очень большого числа повторяющихся единиц, имеющих дисахаридный характер (гиалуроновая кислота, гипарин, хондроитин, каротинсульфаты). Функции: структурно-механическую (имеются в коже, хряще, сухожилиях); каталитическую (ферменты); защитную; участие в регуляции клеточного деления. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. Такие комплексы ДНК с протаминами обнаружены в сперматозоидах, а с гистонами -- в соматических клетках, где молекула ДНК “намотана” вокруг молекул белка-гистона. Нуклепротеинами по своей природе являются вне клетки вирусы -- это комплексы вирусной нуклеиновой кислоты и белковой оболочки – капсида. Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин «нуклеопротеины» связан с названием ядра клетки, однако ДНП и РНП содержатся и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразные состав, структуру и функции независимо от локализации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП.
11. Все белки принято делить на простые белки ,или протеины, и сложные белки , или протеиды (комплексы белков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической группы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). МеталлопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содержится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота оказывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функций. Кроме того, они являются ценным источником энергетического и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.


12. Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), маг-нийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фотосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстановительные реакции, свето-и цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утилизации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фотосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглощением солнечной энергии). ГЕМОГЛОБИН осн. белок дыхат. цикла, участвующий в переносе О2 от органов дыхания к тканям, а в обратном направлении - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Гемоглобин взрослого человека (НbА) имеет мол. м. 6,49*104 и принадлежит к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из двух и двухсубъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств. структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьмиспиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование тема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина 
МИОГЛОБИН белок мышц позвоночных животных и человека, связывающий переносимый гемоглобином О2 и передающий его окислит. системам клетки. Состоит из одной полипептидной цепи, содержащей 153 аминокислотных остатка (мол. м. 17800), к-рая уложена в плотную глобулу размером 4,5 х 2,5 нм. В спец. полости миоглобина ("кармане") помещается гем, к-рый связан с остальной частью молекулы (глобином), как в гемоглобине. Ок. 75% полипептидной цепи находится в конформации a-спирали (все a-спирали правозакрученные). Между областями спи-рализации находятся 5 неспирализованных участков; такие же участки находятся на концах цепи. Внутр. область молекулы состоит гл. обр. из неполярных остатков лейцина, валина, метионина, фенилаланина и не содержит боковых полярных цепей глутаминовой и аспарагиновой к-т, глута-мина, аспарагина, лизина и аргинина. На наружной стороне молекулы расположены как полярные, так и неполярные аминокислотные остатки. Связывание лигандов сопровождается конформац. изменениями белка, и, наоборот, конформац. изменения вблизи тема изменяют его электронное состояние и реакц. способность (т.наз. электронно-конформац. взаимод.). Ф-ция миоглобина запасать О2 в мышцах при его избытке и освобождать при недостатке основана на способности иона Fe2+ обратимо связывать молекулу О2 с образованием оксимио-глобина. Особенно значительным отличием гемоглобина от миоглобина является кривая насыщения кислородом, которая имеет сигмоидную форму. Мутантные гемоглобины человека. Гемоглобин С или ΗbC — один из мутантных гемоглобинов.Мутация — в этом виде гемоглобина в 6-м положении β-полипептидной цепи глутаминовая кислота замещена на лизин Hemoglobin C Эта мутантная форма снижает пластичность эритроцитов организма.
Гипотеза, объясняющая сохранение аллелей аномальных гемоглобинов: мутации в гене, контролирующем образование гемоглобина, в гетерозиготном состоянии вызывают повышенную, по сравнению с нормальным организмом, выживаемость при заражении малярией. Таким образом, существует положительный естественный отбор на сохранение данных вариантов гемоглобина в популяции.
13. Гемоглобин -- сложный белок, хромопротеид, дыхательный пигмент крови человека, позвоночных и некоторых беспозвоночных животных. Основная функция гемоглобина -- перенос кислорода от органов дыхания к тканям. Альфа-полипептидная цепь заканчивается комбинацией аминокислот валина-лейцина, а бета- полипептидная цепь -- комбинацией валина-гистидина-лейцина. Альфа- и бета-полипептидные цепи в гемоглобиновой молекуле не размещены линейно, это первичная структура. По причине существования интрамолекулярных сил полипептидные цепи скручиваются в форме типичной для белков альфа-геликсовой спирали (вторичная структура). Сама альфа-геликсовая спираль на каждую альфа- и бета-полипептидную цепь огибается пространственно, образуя сплетения овоидной формы (третичная структура). Отдельные части альфа-геликсовых спиралей полипептидных цепей отмечают латинскими буквами от А до Н. Все четыре третично изогнутые альфа- и бета-полипептидные цепи располагаются пространственно в определенном соотношении -- кватернерная структура. Они связаны между собой не настоящими химическими связями, а межмолекулярными силами. Кроме координационной связи, существующей между полипептидными цепями глобина, Fe++ атом гема располагает еще тремя координационными связями, две из которых соединены двумя азотными атомами порфиринового кольца, а третья, в среде с низким парциальным давлением кислорода, связана с одной молекулой воды. В среде с высоким парциальным давлением кислорода (артериальная кровь), третья координационная связь соединена с одной молекулой кислорода, причем получается соединение -- оксигемоглобин. Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно осуществляется перенос кислорода из легких к тканям. Значит, возможность гемоглобина связывать кислород зависит от того, заключаются ли в данном тетрамере другие молекулы кислорода. Если содержатся, то последующие молекулы кислорода присоединяются легче. Таким образом, для гемоглобина свойственна кинетика кооперативного связывания, благодаря которой он объединяет максимальное количество кислорода в легких и отдает максимальное количество кислорода при тех парциальных давлениях кислорода, которые имеют место в периферических тканях. Как нормальные, так и патологические типы гемоглобина различаются не по структуре протопорфиринового кольца, а по построению глобина. Разница может заключаться в изменении целых пар полипептидных цепей в гемоглобиновой молекуле. Такая возможность встречается у гемоглобинов H, F, Бартс, А2 и U. Вместо нормальной структуры гемоглобина А -- альфа-альфа/бета-бета (альфа 2/бета 2), гемоглобин Н имеет структуру бета-бета-бета-бета (бета 4), что значит, что обе альфа-полипептидные цепи замещены новыми -- бета-полипептидными цепями. У гемоглобинов F, Бартс и А2 появляются две новые цепи, обозначаемые гамма и дельта, а у гемоглобина U -- новая цепь, обозначаемая ипсилон. Структура HbF -- альфа-альфа/гамма-гамма (альфа 2/гамма 2), структура гемоглобина Бартс -- гамма-гамма-гамма-гамма (гамма 4), структура HbА2 -- альфа-альфа/дельта-дельта (альфа 2/гамма 2), структура гемоглобина U -- альфа-альфа/ипсилон-ипсилон (альфа 2/ипсилон 2). Патологические гемоглобины, которые состоят из четырех одинаковых полипептидных цепей, обозначают тетрамерами. Тетрамеры альфа и дельта до сих пор in vivo не наблюдались. Существует и другая возможность, которая встречается у большинства типов гемоглобина. Так, например, единственная разница между HbS и HbA состоит в том, что на 6-ом месте в бета полипептидной цепи вместо глутамина находится валин, единственная разница между HbI и HbA в том, что на 16-ом месте в альфа-полипептидной цепи лизин замещен аспарагиновой кислотой. Когда аномалия состоит в замещении аминокислоты в альфа-полипептидной цепи, то говорят об альфа-аномалии, когда состоит в бета-полипептидной цепи -- о бета-цепной аномалии, когда в гамма-полипептидной цепи -- о гамма-цепной аномалии (патологические варианты HbF), когда в дельта-цепи -- о дельта-цепной аномалии (патологические варианты HbA2).
14. Ферменты, или энзимы - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах. Вещество, превращение которого катализирует фермент, получило название с у б с т р а т. Ферменты являются важнейшими компонентами клетки, они тесным образом связаны с разнообразными процессами жизнедеятельности, их роль как биокатализаторов биохимических превращений подобна роли катализаторов в других химических реакциях. Ферменты идеально приспособлены для работы в живой клетке, но после выделения из клетки они не теряют свои каталитические свойства. На этом основано практическое применение ферментов в химической, пищевой, легкой и фармацевтической промышленности. Принцип связывания ферментов с различными структурами клетки в настоящее время используют в биотехнологии. При этом ферменты прикрепляют (иммобилизуют) к поверхности какого-либо твердого носителя (целлюлоза и ее производные, полиакриламид, пористое стекло, нейлон, алюмосиликаты и др.), что позволяет не только сохранить их каталитические свойства, но и повысить стабильность. Такие ферменты получили название и м м о б и л и з о в а н н ы х. Химическая природа и строение ферментов. Активный центр ферментов
Установлено, что все известные в настоящее время ферменты представляют собой белки.
Ферменты обладают теми же физико-химическими свойствами, что и белки. Их молекулярная масса колеблется от десятков тысяч до нескольких миллионов. По форме молекул ферменты относятся к глобулярным белкам. Единицы активности ферментов
С т а н д а р т н а я е д и н и ц а - это такое количество фермента, которое при заданных условиях катализирует превращение одного микромоля субстрата за одну минуту. Катал (символ - кат - это такое количество фермента, которое способно превращать один моль субстрата за одну секунду (при оптимальных условиях).
К производным величинам, характеризующим активность ферментов, относят удельную каталитическую активность ферментов, концентрацию фермента в растворе и другие. Удельную каталитическую активность фермента или ферментативного препарата выражают в каталах на 1 кг белка (кат·кг-1) или чаще в мккат на 1мг белка. Концентрацию фермента в растворе выражают в каталах на 1 литр (кат·л-1) или в других, кратных этому значению величинах.
15. Номенклатура и классификаия ферментов,В настоящее время известно более 2400 ферментов. Каждый фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая - систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментоа окончания “-аза”. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия : амилаза, сахараза, уреаза,пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
В принятой классификации все ферменты на основании катализируемых реакций разделены на шесть классов, расположенных в следующем порядке: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы, 4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Каждый класс подразделяется на подклассы, а каждый подкласс - на подподклассы. Индивидуальный фермент имеет кодовое число (шифр) со стоящими перед ним буквами КФ (англ. ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число указывает к какому из шести классов принадлежит данный фермент. Второе число обозначает подкласс. Третье число обозначает подподкласс, а четвертое - порядковый номер фермента в данном подподклассе. Например, фермент КФ.1.1.1.1 имеет рекомендуемое (рабочее) название алкогольдегидрогеназа, систематическое название алкоголь:НАД оксидоредуктаза. Этот фермент относится к классу оксидоредуктаз (1), действует на СН-ОН группу доноров (1.1), акцептором водорода служит НАД (1.1.1); четвертая цифра шифра - порядковый номер фермента в пределах подподкласса.
16. А к т и в н ы й ц е н т р. Известно, что размеры ферментов намного превышают размеры субстратов или функциональных групп, на которые они действуют. Это дало основание предполагать, что субстрат соединяется не со всей молекулой фермента, а с отдельным его участком, получившим название “а к т и в н ы й ц е н т р”, т.е. та область фермента, в которой происходит связывание и превращение субстрата. В молекуле фермента может присутствовать а л л о с т е р и ч е с к и й центр, представляющий собой участок молекулы, присоединение к которому определенных веществ приводит к изменению третичной структуры молекулы фермента. В результате этого происходит изменение конфигурации активного центра, сопровождающееся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в основе так называемой аллостерической регуляции активности ферментов. Ферменты, активность которых регулируется веществами, присоединяющимися к аллостерическому центру, получили название а л л о с т е р и ч е с к и х ферментов. Вещество, превращение которого катализирует фермент, получило название с у б с т р а т. Ферменты, или энзимы - это биологические катализаторы, образующиеся и функционирующие во всех живых организмах.
17. Важным фактором, от которого зависит скорость ферментативной реакции(равно каталитическая активность фермента) является температура, влияние которой показано на рис 4.5. Из рисунка видно, что с повышением температуры до определенной величины скорость реакции увеличивается. Это можно объяснить тем, что с повышением температуры движение молекул ускоряется и у молекул реагирующих веществ оказывается больше возможности столкнуться друг с другом. Это увеличивает вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую скорость реакции, называется о п т и м а л ь н о й температурой. Каждый фермент имеет свою оптимальную температуру. В общем для ферментов животного происхождения она лежит между 37 и 40ОС, а растительного - между 40 и 50ОС. Однако есть и исключения: a-амилаза из проросшего зерна имеет оптимальную температуру при 60ОС, а каталаза - в пределах 0 - 10ОС. При повышении температуры сверх оптимальной скорость ферментативной реакции снижается, хотя частота столкновений молекул увеличивается. Происходит это вследствие денатурации, т.е. потери ферментом нативного состояния. При температуре выше 80ОС большинство ферментов полностью теряют свою каталитическую активность.
Снижение скорости ферментативной реакции при температурах, превышающих оптимальную, зависит от денатурации фермента. Поэтому важным показателем, характеризующим отношение фермента к температуре, является его термолабильность, т.е. скорость инактивации самого фермента при повышении температуры.
При низких температурах (0 ОС и ниже) каталитическая активность ферментов падает почти до нуля, но денатурация при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается. Важным фактором, оказывающим большое влияние на скорость ферментативной реакции, является рН среды. Для каждого фермента существует оптимальное значение рН, т.е. такая величина рН, или зона рН, при которой катализируемая ферментом реакция протекает с наибольшей скоростью.
 |
18. При низких концентрациях субстрата скорость реакции пропорциональна концентрации субстрата и по отношению к нему - это реакция первого порядка. С увеличением концентрации субстрата приращение скорости с каждым разом уменьшается и, наконец, она становится практически независимой от концентрации субстрата. В этих условиях реакция по отношению к субстрату - нулевого порядка, а весь фермент полностью насыщен субстратом и не может функционировать быстрее. Скорость ферментативной реакции при полном насыщении фермента субстратом называется м а к с и м а л ь н о й с к о р о с т ь ю.
Vmax · [S ]
V =
Кm + [S ]
Это окончательное уравнение, выведенное для односубстратной реакции, называют у р а в н е н и е м М и х а э л и с а - М е н т е н. Данное уравнение позволяет легко измерять максимальную скорость из экспериментальных данных, полученных при любой фиксированной концентрации фермента. График зависимости скорости ферментативной реакции от концентрации субстрата представляет собой гиперболу скорости реакции катализируемой ферментом, от 1/2 Vmax концентрации
субстрата………………………..
Влияние концентрации фермента на скорость ферментативной реакции
При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции зависит от концентрации фермента.
19. И н г и б и т о р а м и называют вещества, вызывающие частичное или полное торможение химических реакций, включая и ферментативные. Различают о б р а т и м о е и н е о б р а т и м о е ингибирование фермента. При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора диализом или иным способом, т.е. при обратимом ингибировании существует равновесие между свободным ингибитором и ферментом. При необратимом ингибировании равновесие между свободным ингибитором и ферментом не устанавливается и активность фермента не удается восстановить диализом. Напротив, если ингибитор присутствует в избытке по сравнению с ферментом, то со временем наступает полное торможение активности фермента. Обратимое ингибирование ферментативных реакций бывает к о н к у р е н т н ы м и н е к о н к у р е н т н ы м.
Конкурентное ингибирование может быть вызвано веществами, похожими по своей структуре на субстрат. Эти вещества, конкурируя с субстратом, соединяются с активным центром фермента, но не подвергаются ферментативному превращению и новые продукты из них не образуются.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным. Неконкурентные ингибиторы связываются обратимо как со свободным ферментом, так и с фермент-субстратным комплексом, образуя неактивные фермент-ингибитор (ЕJ) и (или) фермент-субстрат-ингибитор (ESJ).
20. А к т и в а т о р а м и называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются самые разнообразные вещества. Особенно часто роль активаторов ферментов выполняют ионы металлов: калия, кальция, магния, цинка, меди, железа, марганца, кобальта, а из анионов - хлора. Для проявления максимальной активности ферментов требуется определнная концентрация ионов-активаторов в среде.
Усиление активности ферментов под действием ионов металлов объясняется тем, что в одних случаях ионы металлов выполняют роль кофактора, в других - облегчают образование фермент-субстратного комплекса, в третьих - способствуют прсоединеию кофермента к апоферменту, в четвертых обеспечивают становление четвертичной структуры фермента или же действуют иными путями. Мощное действие на ферменты оказывают вещества, присоединяющиеся к ним в особых участках, удаленных от активного центра, называемых а л л о с т е р и ч е с к и м ц е н т р о м. Эти вещества влияют на активность фермента, вызывая обратимое изменение в структуре его активного центра. Называют такие вещества а л л о с т е р и ч е с к и м и э ф ф е к т о р а м и. Если эти эффекторы увеличивают сродство фермента к субстрату, то их называют а л л о с т е р и ч е с к и м и активаторами, если уменьшают - а л л о с т е р и ч е с к и м и ингибиторами. Ферменты, активность которых регулируется аллостерическими активаторами или ингибиторами называют а л л о с т е р и ч е с к и м и. Большинство аллостерических ферментов представляют собой белки-олигомеры.
Аллостерические ферменты имеют важное значение в регуляции ферментативных процессов в клетке. Это связано с тем, что эффекторами могут быть различные промежуточные продукты обмена веществ, называемые м е т а б о л и т а м и. В частности, установлено, что конечный, а иногда и промежуточный продукт многостадийного процесса распада или биосинтеза может служить аллостерическим ингибитором одной из первых его реакций.
21. Специфическую область применения ферментов в медицине составляет энзимодиагностика. Некоторые ферменты, проферменты и их субстраты в норме циркулируют в крови. В крови присутствуют также нефункциональные ферменты, концентрация которых в плазме на несколько порядков ниже, чем в тканях и органах. Появление этих ферментов в плазме в повышенных концентрациях, как правило, связано с патологией. Обычно заболевание того или иного органа, сопровождающееся разрушением его клеток, приводит к выходу из них ферментов в плазму крови, в которой и тестируется увеличение ферментативной активности. Так, повышение активности фруктозо-1,6-дифосфатальдолазы в сыворотке крови наблюдается при инфекционном гепатите, раке печени и инфаркте миокарда. Симптомом мышечной дистрофии является повышение в плазме крови активности креатинкиназы-важнейшего фермента, обеспечивающего образование необходимого для поддержания мышечной деятельности.Известно,что активность аспартатаминотрансферазы (АСТ) возрастает в сыворотке крови при болезнях сердца, а аланинаминотрансферазы (АЛТ)-при болезнях печени. Нередко в энзимодиагностике используют анализ соотношения активности нескольких ферментов. Так, при остром гепатите наблюдается повышенное соотношение активности амилаза/липаза; при злоупотреблении алкоголем и связанным с этим риском возникновения заболеваний сердца и печени наблюдается соотношение активности АСТ/АЛТ, превышающее.Широко используется в энзимодиагностике анализ множественных форм (изозимов) ферментов. Например, при инфаркте миокарда в крови резко возрастает активность быстромигрируюших при электрофорезе (анодных) форм лактатдегидрогеназы, а при инфекционном гепатите, напротив, возрастает активность катодных изозимов этого фермента. Кроме лактатдегидрогеназы, на практике используется анализ изоферментов кислой фосфатазы (при раке предстательной железы), щелочной фосфатазы (болезни костей, рахит и др.), креатинкиназы (болезни сердца). В тестировании раковых заболеваний используются изоферменты гексокиназы (по их соотношению удается даже определить стадию развития ракового поражения при гепатомах Морриса), пируваткиназы (опухоли печени, мозга и рабдосаркома), альдолазы (опухоли мозга и печени), фосфофруктокиназы (гепатомы), енолазы (рак мозга), лактатдегидрогеназы (опухоли желудка, щитовидной железы, почек, яичников, матки, молочной железы).Таким образом, области применения ферментов в медицине действительно безграничны. Рассмотренные примеры ясно показывают, какие замечательные и многообещающие перспективы уже сегодня открывает перед будущими врачами медицинская энзимология.
22. Поиск высокоэффективных и нетоксичных методов лечения различных патологических состояний привел к изучению возможностей использования в биологии и медицине сильноточных электрических разрядов. Высокоэнергетические физико-химические факторы на основе наносекундных электрических разрядов (НСЭР), успешно применяемые в новейших технологиях, проявляют уникальные физико-химические свойства. Накопленные теоретические данные дают основания считать возможным применение этих факторов и для деструкции клеток, что обусловило изучение влияния их на системы организма. Во время генерации высоких импульсных напряжений и в сильноточных электрических разрядах наносекундных длительностей за счет высокой напряженности электрического поля в межэлектродном промежутке нарабатывается большое количество электронов, имеющих сравнительно высокую энергию. Эти электроны являются основными участниками плазмохимических реакций. Взаимодействие их с молекулами газов и биологических субстратов приводит к образованию химически активных частиц, таких как (О, О3, ОН–, Н2О2 и т. д., которые являются активными формами кислорода. Они первыми появляются в цепи реакций клеточного метаболизма и участвуют в процессах организма и клетки. Синтез АТФ. Анаэробный (без участия кислорода). Главная роль углеводов и липидов в клеточном метаболизме состоит в том, что их расщепление на более простые соединения обеспечивает синтез АТФ. Несомненно, что те же процессы протекали и в первых, самых примитивных клетках. Однако в атмосфере, лишенной кислорода, полное окисление углеводов и жиров до CO2 было невозможно. У этих примитивных клеток имелись все же механизмы, с помощью которых перестройка структуры молекулы глюкозы обеспечивала синтез небольших количеств АТФ. Речь идет о процессах, которые у микроорганизмов называют брожением. Лучше всего изучено сбраживание глюкозы до этилового спирта и CO2 у дрожжей.

В ходе 11 последовательных реакций, необходимых для того, чтобы завершилось это превращение, образуется ряд промежуточных продуктов, представляющих собой эфиры фосфорной кислоты (фосфаты). Их фосфатная группа переносится на аденозиндифосфат (АДФ) с образованием АТФ. Чистый выход АТФ составляет 2 молекулы АТФ на каждую молекулу глюкозы, расщепленную в процессе брожения. Аналогичные процессы происходят во всех живых клетках; поскольку они поставляют необходимую для жизнедеятельности энергию, их иногда (не вполне корректно) называют анаэробным дыханием клеток. Аэробный (с использованием кислорода). С появлением в атмосфере кислорода, источником которого послужил, очевидно, фотосинтез растений, в ходе эволюции развился механизм, обеспечивающий полное окисление глюкозы до CO2 и воды, – аэробный процесс, в котором чистый выход АТФ составляет 38 молекул АТФ на каждую окисленную молекулу глюкозы. Этот процесс потребления клетками кислорода для образования богатых энергией соединений известен как клеточное дыхание (аэробное). В отличие от анаэробного процесса, осуществляемого ферментами цитоплазмы, окислительные процессы протекают в митохондриях. В митохондриях пировиноградная кислота – промежуточный продукт, образовавшийся в анаэробной фазе – окисляется до СО2 в шести последовательных реакциях, в каждой из которых пара электронов переносится на общий акцептор – кофермент никотинамидадениндинуклеотид (НАД). Эту последовательность реакций называют циклом трикарбоновых кислот, циклом лимонной кислоты или циклом Кребса. Из каждой молекулы глюкозы образуется 2 молекулы пировиноградной кислоты; 12 пар электронов отщепляется от молекулы глюкозы в ходе ее окисления, описываемого уравнением:

23. Обмен веществ (или метаболизм) состоит из двух процессов: ассимиляции (или анаболизма) - синтеза характерных для организма соединений и диссимиляции (или катаболизма) - распада веществ и выведения продуктов этого распада из организма. Совокупность процессов ассимиляции (синтеза) и диссимиляции (распада) составляет основу жизни. Различают общий (внешний) обмен веществ, учитывающий поступления в организм веществ и их выделение, и промежуточный обмен веществ, который охватывает превращения этих веществ в организме.
Первым этапом обмена веществ является превращение поступивших веществ пищи в желудочно-кишечном тракте. Превращение начинается в ротовой полости, однако основные пищеварительные процессы протекают в тонком кишечнике.

24. Окисление биологическое,совокупность реакций окисления, протекающих во всех живых клетках. Основная функция О. б. — обеспечение организма энергией в доступной для использования форме. Реакции О. б. в клетках катализируют ферменты, объединяемые в класс оксидоредуктаз. О. б. в клетках связано с передачей т. н. восстанавливающих эквивалентов (ВЭ) — атомов водорода или электронов — от одного соединения — донора, к другому — акцептору. У аэробов — большинства животных, растений и многих микроорганизмов — конечным акцептором ВЭ служит кислород. Поставщиками ВЭ могут быть как органические, так и неорганические вещества (см. таблицу). Основной путь использования энергии, освобождающейся при О. б., — накопление её в молекулах аденозинтрифосфорной кислоты (АТФ) и др. макроэргических соединений.О. б., сопровождающееся синтезом АТФ из аденозиндифосфорной кислоты (АДФ) и неорганического фосфата, происходит при гликолизе, окислении a-кетоглутаровой кислоты и при переносе ВЭ в цепи окислительных (дыхательных) ферментов, обычно называют окислительным фосфорилированием (см. схему). В процессе дыхания углеводы, жиры и белки подвергаются многоступенчатому окислению, которое приводит к восстановлению основных поставщиков ВЭ для дыхательных флавинов, никотинамидадениндинуклеотида (НАД), никотинамидадениндинуклеотидфосфата (НАДФ) и липоевой кислоты. Восстановление этих соединений в значительной мере осуществляется в трикарбоновых кислот цикле, которым завершаются основные пути окислительного расщепления углеводов (оно начинается с гликолиза), жиров и аминокислот. Помимо цикла трикарбоновых кислот, некоторое количество восстановленных коферментов — ФАД (флавинадениндинуклеотида) и НАД — образуется при окислении жирных кислот, а также при окислительном дезаминировании глутаминовой кислоты (НАД) и в пентозофосфатном цикле (восстановленный НАДФ). Одновременно развивалось направление, где в основу классификации ферментов был положен тип реакции, подвергающейся каталитическому воздейсвию. Наряду с ферментами, ускоряющими реакции гидролиза (гидролазы), были изучены ферменты, участвующие в реакциях переноса атомов и атомных групп (феразы), в изомеризации (изомеразы), расщеплении (лиазы), различных синтезах (синтетазы) и т. д. Это направление в классификации ферментов оказалось наибо-лее плодотворным, так как объединяло ферменты в группы не по надуманным, формальным признакам, а по типу важнейших биохимических процессов, лежащих в основе жизнедеятельности любого организма. По этому принципу все ферменты делят на 6 классов.1. Оксидоредуктазы — ускоряют реакции окисления — восстановления. 2. Трансферазы — ускоряют реакции переноса функциональных групп и молекулярных остатков. 3. Гидролазы — ускоряют реакции гидролитического распада. 4. Лиазы — ускоряют негидролитическое отщепление от субстратов определенных групп атомов с образованием двойной связи (или присоединяют группы атомов по двойной связи). 5. Изомеразы — ускоряют пространственные или структурные перестройки в пределах одной молекулы. 6. Лигазы — ускоряют реакции синтеза, сопряженные с распадом богатых энергией связей.
25. В переносе электронов от субстратов к молекулярному кислороду принимают участие: пиридинзависимые дегидрогеназы, коферментами для которых служат либо НАД либо НАДФ. флавинзависимые дегидрогеназы, роль простетической группы играют флавинадениндинуклеотид и флавинаденинмононуклеотид (ФАД, ФМН) и др. К числу пиридинзависимых дегидрогеназ относятся свыше 150 ферментов, которые катализируют восстановление НАД и НАДФ различными органическими субстратами. Эти реакции можно изобразить так: субстрат-Н2+НАД(НАДФ)субстрат (окисл.)+НАДН2(НАДФН2). Кофермент НАД находится в митохондриях, НАДФ - в цитоплазме. Восстановленные пиридиннуклеотиды НАДН и НАДФН не могут реагировать с кислородом, их электроны должны пройти через промежуточные акцепторы системы переноса электронов (цитохромы) прежде чем они смогут быть переданы на кислород. Фермент, непосредственно переносящий электрон на кислород - оксидаза, а участвующий в отнятии электрона от субстрата и переносе на акцептор -дегидрогеназа. Следующим акцептором атомов водорода является группа флавиновых ферментов, которые осуществляют перенос водородов (протонов и электронов) от восстановленных НАД и НАДФ. НАДН2+флавиновый фермент (ФАД)НАД+ФАДН2. Все дегидрогеназы нуждаются в коферменте для переноса восстановительных эквивалентов. Наиболее широко распространены коферменты динуклеотидного типа, в котором два нуклеозид-5'-монофосфата соединены фосфоангидридной связью. ЛДГ и многие другие дегидрогеназы нуждаются в никотинамидадениндинуклеотиде, сокращенно НАД+ (NAD+) (1). Обе нуклеотидных группы НАД+ построены из 5'-АМФ и нуклеотида, содержащего в качестве основания амид никотиновой кислоты (см. с. 354). Структурно (но не функционально) похожим коферментом является НАДФ+ (NADP+), в котором 2'-ОН-группы рибозы аденина дополнительно связаны с фосфатом. Несмотря на близкое структурное родство НАД+ и НАДФ+ осуществляют различные функции в обмене веществ. В окислительно-восстановительных реакциях пиридиннуклеотидного кофермента участвует только никотинамидное кольцо. Никотинамид является амидом пиридин-3-карбоновой (никотиновой) кислоты. В окисленной форме кольцо имеет ароматический характер и несет положительный заряд. По этой причине кофермент в окисленном состоянии обозначают как НАД+. При окислении лактата дегидрогеназа отщепляет от субстрата (AH2) два атома водорода [т. е. два электрона и два протона (2, середина)]. Однако на НАД+ переносится только гидрид-ион (H-, два электрона и один протон). Акцептором гидрид-иона является атом углерода в пара-положении к атому азота кольца НАД+. В этом месте образуется алифатическая СН2-группа, перестраиваются двойные связи кольца и исчезает положительный заряд (2, внизу). При окислении или восстановлении никотинамидного кольца изменяются также спектральные характеристики кофермента. Поэтому за реакцией можно легко следить фотометрически. Второй протон высвобождается в среду и, следовательно, правильное наименование восстановленной формы кофермента NADH + H+, а не NADH2.
26. Дыхательная электронтранспортная цепь (ЭТЦ, ETC,) — система структурно и функционально связанных трансмембранных белков и переносчиков электронов. ЭТЦ позволяет запасти энергию, выделяющуюся в ходе окисления НАД∙Н и ФАДН2 молекулярным кислородом (в случае аэробного дыхания) или иными веществами (в случае анаэробного) в форме трансмембранного протонного потенциала за счёт последовательного переноса электрона по цепи, сопряжённого с перекачкой протонов через мембрану. Компоненты дыхательной цепи. Дыхательная цепь включает три белковых комплекса (комплексы I, III и IV), встроенных во внутреннюю митохондриальную мембрану, и две подвижные молекулы-переносчики — убихинон (кофермент Q) и цитохром с. Сукцинатдегидрогеназа, принадлежащая собственно к цитратному циклу, также может рассматриваться как комплекс II дыхательной цепи. АТФ-синтаза иногда называется комплексом V, хотя она не принимает участия в переносе электронов. Комплексы дыхательной цепи построены из множества полипептидов и содержат ряд различных окислительно-восстановительных коферментов, связанных с белками. К ним принадлежат флавин [ФМН (FMN) или ФАД (FAD), в комплексах I и II], железо-серные центры (в I, II и III) и группы гема (в II, III и IV). Детальная структура большинства комплексов еще не установлена. Электроны поступают в дыхательную цепь различными путями. При окислении НАДН + Н+ комплекс I переносит электроны через ФМН и Fe/S-центры на убихинон. Образующиеся при окислении сукцината, ацил-КоА и других субстратов электроны переносятся на убихинон комплексом II или другой митохондриальной дегидрогеназой через связанный с ферментом ФАДН2 или флавопротеин (см. с. 166), При этом окисленная форма кофермента Q восстанавливается в ароматический убигидрохинон. Последний переносит электроны в комплекс III, который поставляет их через два гема b, один Fe/S-центр и гем с1 на небольшой гемсодержащий белок цитохром с. Последний переносит электроны к комплексу IV, цитохром с-оксидазе. Цитохром с-оксидаза содержит для осуществления окислительно-восстановительных реакций два медьсодержащих центра (CuA и CuB) и гемы а и а3, через которые электроны, наконец, поступают к кислороду. При восстановлении О2 образуется сильный основной анион О2-, который связывает два протона и переходит а воду. Поток электронов сопряжен с образованным комплексами I, III и IV протонным градиентом. Организация дыхательной цепи. Перенос протонов комплексами I, III и IV протекает векторно из матрикса в межмембранное пространство. При переносе электронов в дыхательной цепи повышается концентрация ионов H+, т. е. понижается значение рН. В интактных митохондриях по существу только АТФ-синтаза позволяет осуществить обратное движение протонов в матрикс. На этом основано важное в регуляторном отношении сопряжение электронного переноса с образованием АТФ. Убихинон благодаря неполярной боковой цепи свободно перемещается в мембране. Водорастворимый цитохром с находится на внешней стороне внутренней мембраны. Окисление НАДН (NADH) комплексом I происходит на внутренней стороне мембраны, а также в матриксе, где происходит также цитратный цикл и β-окисление — самые важные источники НАДН. В матриксе протекают, кроме того, восстановление O2 и образование АТФ (ATP). Полученный АТФ переносится по механизму антипорта (против АДФ) в межмембранное пространство (см. с. 214), откуда через порины проникает в цитоплазму.
27. Окислительное фосфорилирование было бы правильнее назвать
фосфорилированием в дыхательной цепи. Суть его состоит в следующем. Перенос электронов и протонов по окислительно-восстановительной цепи ферментов сопровождается высвобождением значительного количества энергии, большая часть которой трансформируется в энергию фосфатных связей макроэргических соединений, главным образом АТФ. Неиспользованная энергия рассеивается в виде тепла. Для синтеза АТФ необходим АДФ, неорганический фосфат, 8-10 ккал энергии и соответствующие ферменты. АДФ+НзР04+8-10 ккал энергии ® АДФ~Р ® АТФ
При распаде АТФ соответственно высвобождается такое же количество энергии. Процесс синтеза АТФ из АДФ и нес фосфата за счет энергии дыхания (энергии переноса электронов) получил название окислительного фосфорилирования. ХЕМИОСМОТИЧЕСКАЯ ТЕОРИЯ-учение о механизме преобразования энергии в биол. мембранах при синтезе аденозинтрифосфорной к-ты (АТФ). Разработана П. Митчеллом в 1961—66. Согласно исходным представлениям Митчелла, запасание энергии в АТФ происходит вследствие предварительного накопления зарядов на стенках мембраны, создания мембранного потенциала и разности концентраций протонов. Разность электрохимич. потенциалов ионов водорода на сопрягающих мембранах (внутр. мембраны митохондрий, тилакоиды хлоропластов, мембраны бактерий) возникает за счёт энергии, выделяемой при деятельности цепи окислит.-восстановит, ферментов, или за счёт поглощённых квантов света. Трансмембранные электрохимич. потенциалы ионов могут служить источником энергии не только для синтеза АТФ, на и для транспорта веществ, движения бактериальных клеток и др. энергозависимых процессов. Гипотеза П.Митчелла требует соблюдения ряда условий, которые перечислены ниже. 1. Внутренняя митохондриальная мембрана должна быть интактна и непроницаема для протонов, направляющихся снаружи внутрь. 2. В результате активности дыхательной цепи ионы водорода поступают в нее изнутри, из матрикса, а освобождаются на наружной стороне мембраны. 3. Движение ионов водорода, направленное изнутри наружу, приводит к их накоплению, вследствие чего между двумя сторонами митохондриальной мембраны возникает градиент pH. 4. Поддержание такого градиента требует затраты энергии. Эту энергию поставляет перенос электронов по электрон-транспортной цепи. 5. Синтез АТФ поддерживается наличием электрохимического градиента.
28. С ингибированием ферментов связан механизм действия многих токсинов и ядов на организм. Известно, что при отравлениях солями сенильной кислоты смерть наступает вследствие полного торможения и выключения дыхательных ферментов (цитохромная система) тканей, особенно клеток мозга. Токсическое влияние на организм человека и животных некоторых инсектицидов обусловлено торможением активности холинэстеразы – фермента, играющего ключевую роль в деятельности нервной системы.Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментов в организме и регуляции интенсивности метаболизма при патологии.Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксипиридоксин и аминоптерин (см. главу 7), действуют как конкурентные, так называемые коферментные, ингибиторы (или антивитамины), тормозящие многие интенсивно протекающие при патологии биологические процессы в организме. Применение подобных аналогов в медицинской практике (в частности, в дерматологии и онкологии) основано на конкурентном вытеснении коферментов из субстратсвязывающих центров ключевых ферментов обмена.Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. Степень торможения во многих случаях определяется продолжительностью действия ингибитора на фермент. При данном типе ингибирования благодаря образованию стабильной ковалентной связи фермент часто подвергается полной инактивации, и тогда торможение становится необратимым. Примером необратимого ингибирования является действие йодацетата, ДФФ, а также диэтил-n-нитрофенилфосфата и солей синильной кислоты. Это действие заключается в связывании и выключении функциональных групп или ионов металлов и молекуле фермента.
29. Подготовка энергии к использованию, т. е. генерирование (извлечение) энергии из пищевых веществ осуществляется в процессе дыхания, под которым понимают окисление (расщепление) молекул-энергоносителей, т. е. «топливных» молекул, при котором роль конечного акцептора электронов выполняет О у а донором электронов является органическое или неорганическое соединение. Процесс подготовки энергии к использованию протекает в три последовательные стадии. На первой стадии поступающие в клетки крупные молекулы полисахаридов гидролизуются до простых Сахаров. На этой стадии происходит разложение и других энергоносителей. В частности, жиры разлагаются на глицерол и жирные кислоты, белки гидро-лизуются до аминокислот. Однако на этой стадии высвобождение запасенной в пищевых веществах энергии все еще не происходит. На второй стадии происходит распад малых молекул до еще более простых структур, играющих уже ключевую роль в метаболизме. Глюкоза превращается в ацетильную часть ацетил-КоА, являющегося производным кофермента А. В результате этих реакций образуются молекулы АТФ, но их еще мало. На уровне ацетил-КоА в метаболический путь могут вступать также жирные кислоты и аминокислоты. Наконец, на третьей стадии происходит полное окисление ацетильного компонента ацетил-КоА до СОу На этой стадии образуется основная часть АТФ. Процесс генерирования энергии в животных клетках (извлечения ее из субстрата) осуществляется с участием митохондрий и начинается с гликолиза (от греч. glycos -- сахар и lysis -- растворение), который представляет собой окисление глюкозы, заканчивающееся превращением этого углевода в пировиноградную кислоту и образованием АТФ. Уже давно установлено, что для дыхания в качестве акцептора электронов необходим кислород. Однако на первых этапах расщепления Сахаров кислорода не требуется. Окисление глюкозы начинается в анаэробных условиях дыхания (при отсутствии кислорода) с частичного расщепления ее шестиуглеродной молекулы и заканчивается образованием двух трехуглеродных молекул пировиноградной кислоты Превращения глюкозы можно описать следующим уравнением: C6H12O6 + 2Ф + 2АДФ 2СН3СНОНСООН + 2АТФ + 2Н2О. Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА-синтетазой:

В результате реакции образуется ацил-КоА, являющийся активной формой жирной кислоты. Считают, что активация жирной кислоты протекает в 2 этапа. Сначала жирная кислота реагирует с АТФ с образованием ациладенилата, представляющим собой эфир жирной кислоты и АМФ. Далее сульфгидрильная группа КоА действует на прочно связанный с ферментом ациладенилат с образованием ацил-КоА и АМФ.
30. Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г. Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива»: углеводов, жирных кислот и аминокислот. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций (рис. 10.9). Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.

Рис. 10.9. Цикл трикарбоновых кислот (цикл Кребса). Первая реакция катализируется ферментом цит-рат-синтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:
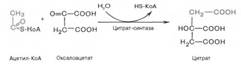
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:

Третья реакция. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изо-цитратдегидрогеназы. В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. 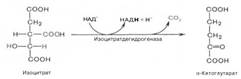
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.
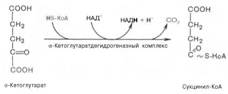
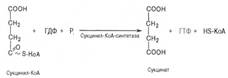
Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. 
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат).
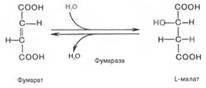
Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:

Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление («сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий.
31. Углеводы составляют большую часть пищи человека, около 60-70% пищевого рациона. В среднем количество углеводов в суточном рационе человека составляет 450—600 г. Организм человека и животных получает углеводы с различными пищевыми веществами, главным образом, растительного происхождения. Окисление углеводов в тканях является одним из основных источников энергии, необходимой организму для осуществления разнообразных функций.
Избыток углеводов в пище ведет к превращению их в жиры. Избыточное введение углеводов может привести к нежелательному ожирению у человека, т. е. отложению жира в жировых депо. Недостаточное потребление углеводов для человека также нежелательно. Оно может закончиться нарушением обмена веществ. ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ УГЛЕВОДОВ Распад углеводов начинается в ротовой полости. В слюне содержится фермент, называемый µ-амилазой (птиалином, диастазой), расщепляющий крахмал. Расщепление идет до декстринов, а при более длительном воздействии - до мальтозы. В желудке углеводы не подвергаются перевариванию, так как там нет соответствующего фермента. Основное переваривание углеводов происходит в двенадцатиперстной кишке и в дальнейших отрезках тонких кишок под влиянием µ-амилазы, поступающей в двенадцатиперстную кишку с соком поджелудочной железы. Главным, конечным продуктом гидролиза крахмала µ-амилазой является мальтоза, которая затем расщепляется на две молекулы глюкозы под действием фермента мальтазы. Мальтаза, а также и другие гликозидазы - сахараза и лактаза, вырабатываемые в железах слизистой оболочки тонких кишок, расщепляют дисахариды до моносахаридов. Сахараза гидролизует сахарозу на глюкозу и фруктозу, а лактаза - лактозу до глюкозы и галактозы. Клетчатка (целлюлоза) из-за отсутствия целлюлазы в животном организме не разлагается ферментами пищеварительных соков. Из кишечника в кровь всасываются только моносахариды. Скорость всасывания у разных моносахаридов различна. Полагают, что они всасываются в виде моносфорных эфиров, что дает возможность взаимопревращению в стенке кишечника гексоз, в частности, превращению фруктозы и галактозы в глюкозу. Моносахариды с током крови по системе воротной вены попадают в печень. В печени часть глюкозы превращается в гликоген. Печень способна как синтезировать гликоген, так и расщеплять его с образованием глюкозы. Углеводы принято делить на моносахариды, олигосахариды и полисахариды. Моносахариды обычно представляют собой полигид-роксиальдегиды (альдозы) или полигидроксикетоны (кетозы) с линейной цепью из 3-9 атомов С, каждый из к-рых (кроме карбонильного) связан с группой ОН. Простейший моноса-харид, глицериновый альдегид, содержит один асим. атом С и известен в виде двух оптич. антиподов (D и L). Прочие моносахариды имеют неск. асим. атомов С; их рассматривают как производные D- или L-глицеринового альдегида и относят к D- или L-ряду в соответствии с абс. конфигурацией асим. атома С, наиб. удаленного от карбонильной группы. Различия между изомерными моносахаридами в каждом ряду обусловлены относит, конфигурацией остальных асим. центров.

Олигосахариды содержат в своем составе от 2 до 10-20 моносахаридных остатков, связанных гликозидными связями. Наиб, распространены дисахариды, выполняющие ф-цию запасных B-B: сахароза в растениях, трегалоза в насекомых и грибах, лактоза в молоке млекопитающих. Известны многочисл. гликозиды олигосахаридов, к к-рым относят разл. физиологически активные в-ва, напр, гликозиды сердечные, нек-рые сапонины (в растениях), мн. антибиотики (в грибах и бактериях), гликолипиды. Полисахариды- высокомол. соед., линейные или разветвленные молекулы к-рых построены из остатков моносахаридов, связанных гликозидными связями. В состав полисахаридов могут входить также заместители неуглеводной природы (остатки алифатич. к-т, фосфат, сульфат). В свою очередь цепи высших олигосахаридов и полисахаридов могут присоединяться к полипептидным цепям с образованием гликопротеинов.
32. Глюкоза, прежде чем превратиться в гликоген, подвергается фосфорилированию. Эта реакция происходит с участием фермента гексокиназы (фосфотрансферазы), катализирующего перенос фосфорного остатка с АТФ на глюкозу.
1. Глюкоза+АТФ- ¾® Глюкозо-6-фосфат+АДФ. гексокиназа
Далее глюкозо-6-фосфат превращается в глюкозо-1-фосфат при участии фермента фосфоглюкомутазы.
2. Глюкозо-6-фосфат ¾¾¾ Глюкозо-1-фосфат ¾¾¾®
фосфоглюкомутаза
Глюкозо-1-фосфат в присутствии фермента гликозилтрансферазы (пирофосфорилазы) взаимодействует с уридинтрифосфатом (УТФ) с обра
Дата добавления: 2015-04-21; просмотров: 278; Мы поможем в написании вашей работы!; Нарушение авторских прав |