
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Активность
Сущность каталитического действия наглядно видна из сравнения энергетических профилей протекания каталитической и некаталитической реакции АàВ (Рис 1-3).

Рис. 1-3. Энергетические профили каталитической и некаталитической реакции А à В.
На координате реакции в точках 0 и 1 находятся, соответственно, исходное вещество А и продукт реакции В. В стабильном состоянии молекулы А и В существуют в так называемых потенциальных ямах. Превращение А в В можно представить как перевал через точку пересечения стенок потенциальных ям. Энергия исходного реагента А должна увеличиться на величину Е (энергия активации некаталитической реакции), что приводит к появлению переходного состояния АВ. Только после этого А может попасть в потенциальную яму вещества В, что и приводит к появлению продукта В.
При внесении в систему катализатора (К) последний взаимодействует с А с образованием промежуточного вещества Р, которое, в свою очередь превращается в продукт В с регенерацией К. При этом энергетический профиль каталитической реакции проходит уже через два максимума с энергиями активации Е1 и Е2.
Согласно общей термодинамической теории скоростей реакций, предельная удельная скорость реакции k0 экспаненциально зависит от  :
:
 (1.1)
(1.1)
Таким образом, поскольку Е1 и Е2 меньше Е, то участие катализатора в химическом превращении приводит к экспоненциальному возрастанию скорости реакции.
Активность катализатора это мера того, как (в какой степени) тот или иной катализатор ускоряет данную реакцию.
Самый очевидный способ определения активности вытекает из представлений о кинетике химических реакций. Скорость реакции (r) по какому либо из веществ (например по реагенту А) определяют как изменение количества вещества в единицу времени в единице реакционного объема (или на единице массы катализатора):
 , моль/(л.с)- для гомогенного катализатора (1.2)
, моль/(л.с)- для гомогенного катализатора (1.2)
или
 , моль/(кг.с)-для гетерогенного катализатора (1.3)
, моль/(кг.с)-для гетерогенного катализатора (1.3)
где: dnA – изменение количества вещества (моль), d  - приращение времени (с), V - объем реакционной массы (л).
- приращение времени (с), V - объем реакционной массы (л).
Согласно закону действующих масс, скорость реакции равна произведению константы скорости (k) и концентраций реагентов в соответствующих степенях (f(Ci)):
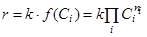 (1.4)
(1.4)
Показатели степени при концентрациях (ni), входящих в кинетическое уравнение, называют порядком реакции по данному реагенту. Часто порядок по реагенту совпадает с его стехиометрическим коэффициентом в химическом уравнении реакции.
Константа скорости реакции зависит от температуры по уравнению Аррениуса:
k = k0.exp(-E/(RT)) (1.5)
Согласно уравнениям 1.4 и 1.5 активность катализаторов можно характеризовать:
- величиной скорости реакции
- величиной константы скорости
- величиной энергии активации
Очевидно, что первые два параметра имеет смысл сравнивать только при одинаковых условиях проведения реакции (температура, концентрации участников реакции).
При сравнении каталитической активности по значениям скорости реакции чаще всего используют значения скорости в начальный момент времени - "нулевой точке" (r0). Эти значения численно равны тангенсу угла наклона касательной (tga), проведенной в нулевой точке к кинетической кривой. Например, на рисунке 1-4 изображены три кинетические кривые для реакции АàB, катализируемой тремя разными катализаторами (К1, К2 и К3). В начальной точке к трем графикам построены касательные. Соответствующие значения r0 вычисляют следующим образом:
 (1.6)
(1.6)
Так как в данном примере r10 > r20 > r30 , то катализаторы можно расположить в следующий ряд по активности: К1 > К2 > К3 .

Рис. 1-4. Кинетические кривые реакции АàВ в экспериментах с различными катализаторами: 1 - К1, 2 - К2, 3 - К3.
Константы скорости, как меру активности катализаторов, имеет смысл сравнивать только при одинаковой температуре. Вычислить значение константы скорости можно, согласно уравнению (1.4), делением найденного экспериментально значения скорости реакции (r) на произведение концентраций реагентов в соответствующих степенях.
Важной мерой активности катализатора является число превращений (Turnover Number - TON). Это число молекул вещества реагирующего в единицу времени на одном активном центре катализатора:
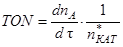 (1.7)
(1.7)
где: n*КАТ - количество активных центров катализатора.
Число превращений может быть также вычислено как отношение скорости реакции к концентрации активных центров:
 (1.8)
(1.8)
Эта характеристика удобна для гомогенного катализа, так как в этом случае можно точно измерить концентрацию активных центров (фактически, концентрацию катализатора).
Для гетерогенного катализатора это не так просто, так как количество доступных активных центров зависит от множества факторов, таких как структура катализатора, удельная поверхность, дисперсность и т.д.
Для сравнения активности гетерогенных катализаторов, для экспресс оценки их эффективности (так называемого скрининга), для оптимизации условий эксплуатации, для изучения дезактивации наиболее удобны следующие характеристики:
- конверсия при постоянных условиях;
- объемная скорость при постоянной конверсии;
- удельная производительность катализатора;
- температура, требуемая для достижения равной конверсии.
Степенью конверсии или просто конверсией (Х) исходного вещества называют отношение количества прореагировавшего вещества к исходно взятому его количеству.
Для периодического реактора: ХА=(nA,0-nA)/nA,0 (1.9)
Для непрерывного реактора: ХА=(FA,0-FA)/FA,0 (1.10)
где F - мольный поток вещества А, моль/с.
Объемная скорость (U) является важной эксплуатационной характеристикой для непрерывных реакторов. Вычисляют ее как отношение объемного потока на входе в реактор (W0) к объему реактора (VКАТ) или к массе загруженного в него гетерогенного катализатора (mКАТ):
 ,[1/с] или [м3/кг.с] (1.11)
,[1/с] или [м3/кг.с] (1.11)
Так как время пребывания в реакторе (t0) можно вычислить как:
 (1.12)
(1.12)
то объемная скорость равна величине, обратной времени пребывания в реакторе (t0):
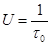 , [1/с] (1.13)
, [1/с] (1.13)
На рисунке 1-5 представлены результаты испытания двух катализаторов(Кат1 и Кат2) в виде зависимостей Х от U и t0. Видно, что при одних и тех же нагрузках реактора t0,1 (U1) с катализатором Кат1 достигается степень конверсии Х1 , а с катализатором Кат2 - конверсия Х2. Причем Х1 > Х2. Если сравнивать эксперименты при одинаковой степени конверсии Х1, то на катализаторе Кат1 она достигается при t0,1 (U1), а на катализаторе Кат2 при t0,2 (U2). При этом t0,1 < t0,2 (U1 > U2). Следовательно активность катализатора Кат1 выше активности Кат2.

Рис. 1-5. Сравнение активностей двух катализаторов (Кат1 и Кат2) по зависимостям степени конверсии от времени пребывания (объемной скорости).
Следующей важной характеристикой активности является удельная производительность катализатора (g), равная количеству продукта реакции (в молях или кг) производимому в единицу времени единицей объема или единицей массы гетерогенного катализатора:
 , (кг или моль)/((л или кг)с) (1.14)
, (кг или моль)/((л или кг)с) (1.14)
где: GПРОД - массовый поток продукта на выходе из реактора, кг/с; FПРОД - мольный поток продукта на выходе из реактора, моль/с; VКАТ (mКАТ)- объем (масса) загруженного в реактор катализатора, л(кг).
Эта величина удобна для сравнения каталитических реакторов различных конструкций и размеров и очень часто применяется для характеристики активности промышленных катализаторов.
Так же важной характеристикой активности катализаторов является температура, необходимая для достижения одинаковой конверсий. Чем ниже требуемая температура тем активнее катализатор. Однако, этим методом нужно пользоваться достаточно осторожно, так как при изменении температуры в широких пределах может измениться не только кинетика реакции, но и маршрут ее протекания.
Дата добавления: 2015-01-29; просмотров: 1208; Мы поможем в написании вашей работы!; Нарушение авторских прав |