
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Оксиды серы.
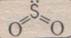 SO2 - оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
SO2 - оксид серы (IV), сернистый газ. Бесцветный газ с резким запахом, на воздухе не горит, легко растворяется в воде, ядовит.
Химические свойства: кислотный оксид, характерны восстановительные свойства.
Как восстановитель:
SO2 + O2 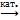 SO3, катализатор V2O5
SO3, катализатор V2O5
Как кислотный оксид сернистый газ взаимодействует со щелочами:
SO2+ NaОН →NaНSO3 и Na2SO3 + H2O (соли гидросульфиты и сульфиты).
С водою образуется сернистая (сульфитная) кислота.
SO2+ H2O ↔ H2 SO3 Это слабый электролит. Нестойкая, существует только в водных растворах, легко окисляется кислородом воздуха до серной кислоты: H2 SO3 + O2 → H2 SO4.
 Обесцвечивает органические красители.
Обесцвечивает органические красители.
Получение:
1). Горение серы: S + O2 →SO2
2). Обжиг сульфидов: ZnS + O2 → ZnO + SO2 и т.д.
Большое количество сернистого газа образуется при горении органических соединений (каменный уголь).
Применение:
1). Производство серной кислоты.
2). Производство сульфитов и гидросульфитов.
3). В с/х для уничтожения насекомых и микроорганизмов.
4). В текстильной промышленности для отбеливания тканей, соломки и т.д.
5). При консервировании фруктов и ягод.
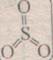 SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
SO3 – оксид серы (VI), серный ангидрид. Молекула существует только в парах, при понижении температуры полимеризуется. При н.у. это бесцветная жидкость, летучая, «дымит» на воздухе, кристаллизуется при 17оС, кипит при 66оС. Легко растворяется в воде, токсичен.
Химические свойства: сильный окислитель, кислотный оксид.
Как кислотный оксид:
SO3+ H2O →H2 SO4 +Q, взаимодействует с водой, образуя серную кислоту, при этом выделяется большое количества тепла.
SO3+ NaОН →NaНSO4 и Na2SO4 + H2O, т.е. образует гидросульфаты и сульфаты
Получение: в промышленности SO2 + O2 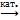 SO3, катализатор V2O5
SO3, катализатор V2O5
Применение: как промежуточный продукт при производстве серной кислоты, в лаборатории как сильное водопоглощающее средство.
Дата добавления: 2015-02-09; просмотров: 370; Мы поможем в написании вашей работы!; Нарушение авторских прав |