
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Серная (сульфатная) кислота и ее соли.
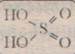 H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,- нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
H2 SO4 –ббесцветная маслянистая жидкость, плотность 98% раствора 1,84 г/см,- нелетучая и запаха не имеет. Чрезвычайно гигроскопична, легко поглощает воду. При растворении выделяется большое количество тепла.
Химические свойства: 1. Сильная кислота, распадается на ионы по двум ступеням практически на 100%, образует два ряда солей.
H2SO4 ↔ H+ + HSO4- - гидросульфат –ион
HSO4- ↔ H+ + SO4 2- - сульфат- ион
Разбавленная кислота H2 SO4 обладает всеми общими свойствами кислот: изменяет окраску растворов индикаторов); взаимодействует с основаниями, основными оксидами и солями (реакции ионного обмена, не ОВР!):
H2SO4+2 KOH → K2SO4+ 2H2O;
2H+ +SO42- +2K+ + 2OH- = 2K++SO42- + 2H2O; H++ OH- = H2O
H2SO4+ KOH → KНSO4 + H2O
3H2SO4+ Al2O3 → Al2(SO4)3+ 3H2O;
2H+ +3SO42- + Al2O3 → 2Al3+ + 3SO42- + H2O ; 2H+ + Al2O3 → 2Al3+ + H2O
H2SO4+ Na2CO3→ Na2SO4+ H2CO3 → Na2SO4+ H2O + CO2↑;
2H+ + SO42- + 2Na+ + CO3→ 2Na+ + SO42- + H2O + CO2↑; 2H+ + CO3→ H2O + CO2↑;
Во всех этих реакциях главную роль играют ионы водорода, а SO42- просто присутствует в растворе. Специфической реакцией иона SO42- (т.е. серной кислоты и всех ее солей) является реакция с солями бария.
H2SO4+ BaCl2 → 2HCl + BaSO4↓
2H+ + SO42-+ Ba2+ +2Cl- → 2H+ + 2Cl- + BaSO4↓
SO42-+ Ba2+ → BaSO4↓
Na2SO4+ Ba(NO3)2 → 2NaNO3+ BaSO4↓
2Na+ + SO42-+ Ba2+ +2NO3 - → 2Na+ + 2NO3 - + BaSO4↓
SO42-+ Ba2+ → BaSO4↓
Эту реакцию называют «качественной реакцией» на серную кислоту и ее соли, потому что в ней образуется характерный мелкокристаллический белый осадок BaSO4. Реакцию используют в лабораторной практике для определения наличия в растворе иона SO42-.
При взаимодействии с металлами серная кислота может вести себя по-разному, в зависимости от концентрации и активности металла.
В разбавленной H2SO4 окислителем является ион Н+, поэтому разбавленная серная кислота взаимодействует только с металлами стоящими в ряду напряжений до водорода, причем, одним из продуктов реакции будет газ водород.
H2SO4(разб.)+ Zn → H2 ↑+ ZnSO4
Zn0 – 2e- → Zn+2 H+ + e- → H0
Но если мы возьмем концентрированную кислоту, то в роли окислителя выступит S+6 , и вместо водорода мы получим продукт ее восстановления – какое-то соединение серы. Какое? Это зависит от активности металла, температуры, концентрации кислоты. Обычно образуется смесь таких веществ. Но, упрощая, можно считать, что чем активнее металл, тем более глубоко идет процесс восстановления, и степень окисления серы в продукте реакции будет ниже. Следует также отметить, что с концентрированной H2SO4 взаимодействуют все металлы, кроме золота и платины, но на холоду железо, алюминий и хром пассивируются (не реагируют из-за образования прочной пленки на поверхности металла), а некоторые металлы не реагируют и с разбавленной серной кислотой (если при этом образуется нерастворимая соль).
H2SO4(конц.)+ Zn → ZnSO4 + H2О + S Zn0 – 2e- → Zn2+ S+6 +6e- → S0
H2SO4(конц.)+ Cu → ZnSO4 + H2О + SO2 Cu0 – 2e- → Cu2+ S+6 +2e- → S+4
H2SO4(конц.)+ Ca → CaSO4 + H2О + CaS Ca0 – 2e- → Ca2+ S+6 +8e- → S-2
H2SO4(конц.)– сильный окислитель, и может окислять не только металлы, но и неметаллы и даже их соединения, обугливает органические вещества (т.к. забирает воду, например, у углеводов)
H2SO4(конц.)+ C → СО2↑ + H2О + SO2↑
C0 – 4e- → C4+ S+6 +2e- → S+4
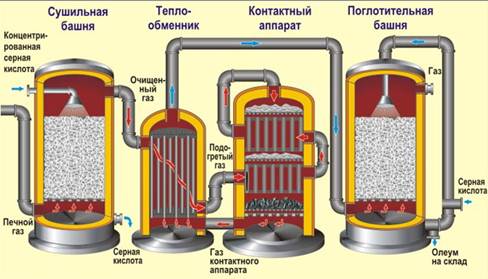
 Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
Получение серной кислоты. В промышленности процесс получения серной кислоты обычно включает в себя три стадии. Сырьем является FeS2 (пирит, железный колчедан).
1) обжиг колчедана (принцип теплообмена, в «кипящем слое», воздух обогащен кислородом):
FeS2 + O2 → Fe2O3 + SO2 + 13746кДж
2) каталитическое окисление сернистого газа (4500С, катализатор V2O5 оксид ванадия (V), принцип противотока):
SO2 + O2 ↔ SO3 + 197,9кДж
 3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
3) гидратация оксида серы (VI) (принцип противотока, принцип теплообмена, орошение концентрированной серной кислотой)
SO3+ H2O →H2 SO4 + 130,6 кДж
Конечным продуктом является «олеум» - раствор SO3 в концентрированной H2 SO4.
В производстве серной кислоты часто используют сернистый газ, получаемый при обжиге цветных руд, горении топлива или свободной серы. Т.е. первая стадия может быть немного другой, а вот две последние – всегда одинаковы.
Применение. Серная кислота – «хлеб» химической промышленности.
 1) получение сульфатов, которые широко используются в народном хозяйстве, например:
1) получение сульфатов, которые широко используются в народном хозяйстве, например:
- K2SO4 и (NH4)2 SO4 - сульфаты калия и аммония, в с/х как минеральные удобрения
- CuSO4∙5H2O – медный купорос, в с/х как средство борьбы с болезнями растений, в легкой промышленности как краситель, в строительстве как противогрибковое средство, в гальванопластике (покрытие слоем меди)
FeSO4∙ 7H2O – железный купорос, в с/х средство борьбы с вредителями растений, в легкой промышленности при крашении тканей.
CaSO4∙ 2H2O – минерал гипс, в строительстве используют «жженый гипс» 2CaSO4∙ H2O под названием «алебастр» в состав шпаклевок, в медицине - слепки, шины, в художественно- прикладном творчестве.
Na2SO4∙ 10H2O – глауберова соль, в медицине как слабительное, в производстве стекла
BaSO4 –в медицине, (рентген желудка), в производстве бумаги, резины как наполнитель
2) в цветной металлургии (гидрометаллургия, получение меди, никеля и т.д.) и обработке металлов (печатные платы, гальваника, аккумуляторы и т.д.)
3) неорганический синтез (производство минеральных удобрений, пигментов, кислот…) и органический синтез (производство красителей, ВВ, полимеров…)
4) производство бумаги
5) производство соды (стекло, СМС)
Соли серной кислоты не обладают окислительными свойствами, вступают в обычные реакции ионного обмена.
Дата добавления: 2015-02-09; просмотров: 2253; Мы поможем в написании вашей работы!; Нарушение авторских прав |