
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Методические указания и контрольные задания к контрольной работе №2 (для самостоятельной работы студентов).
На 1 курсе заочной сокращенной формы обучения и 2 курсе заочной полной формы обучения студенты изучают один из важных разделов аналитической химии-физико-химические методы анализа. Изучение этого современного и эффективного раздела аналитики углубляет знания студентов, полученные при изучении разделов качественного и количественного химического методов анализа и дает новые представления о высокочувствительных методах анализа, возможности их автоматизации и т.д.
Курс физико-химических методов анализа состоит из двух разделов:
а) теоретические вопросы; б) лабораторный практикум.
Рекомендуется следующий порядок освоения курса:
1) самостоятельная работа с учебниками и учебными пособиями;
2) в качестве отчета о проделанной работе студент выполняет контрольную работу, представляющую собой ряд теоретических вопросов и задач, в срок, установленный учебным графиком;
3) отработка лабораторного практикума;
4) после успешного выполнения контрольной работы и лабораторного практикума студенты сдают экзамен.
Номер варианта контрольной работы соответствует последней цифре учебного номера шифра. Например, студент, имеющий учебный шифр 1098-2712-05, при выполнении контрольной работы включает следующие вопросы и задачи: 8,18,28,38,48,58,68.
При выполнении контрольной работы необходимо использовать литературные источники, перечень которых приведен в списке литературы.
Отвечать на вопросы следует четко, по существу, излагая материал своими словами.
При решении задач необходимо помнить, что все расчеты требуют обоснования, графики должны быть выполнены на миллиметровой бумаге.
Ограничиваться только записью формул и подстановкой числовых данных нельзя.
Решение задач, как и ответы на вопросы, следует мотивировать. Списывание работы с чужих тетрадей недопустимо.
Работа должна быть написана чернилами, разборчиво и аккуратно, в тетради необходимо оставить поля для замечаний рецензента, страницы тетради следует пронумеровать, работу подписать и поставить дату.
В конце работы должен быть приведен список использованной литературы.
Студент должен детально ознакомиться со всеми замечаниями рецензента и внести исправления в соответствии с рецензией.
Контрольная работа № 2
Физико-химические методы анализа.
1. Что такое доверительный интервал и доверительная вероятность (надежность) результата анализа? Как находят коэффициент Стьюдента для данных условий задачи?
2. При определении сахарозы поляриметрическим методом получены следующие результаты: 36,62; 36,81; 36,53; 36,66%.
Определить доверительный интервал и представить окончательный результат анализа.
3. Произведите сложение и вычитание, указанных в каждой строчке чисел, выразив каждое из них, включая результаты, правильным числом значащих цифр:
а) 12,69+356,7+1,344
б) 0,0025+0,0025+0,1045
в) 0,444+5,63+54,3+543,0
г) 1,642+0,283+2,83
д) 107,96+23,45-2,24
е) 6,83 
4. Три повторных анализа образца хлорида дали среднее значение содержания хлорида 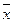 =72,10% и стандартное отклонение S=0,40%. Определить границы доверительного интервала, в которых могут находиться результаты отдельного определения при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
=72,10% и стандартное отклонение S=0,40%. Определить границы доверительного интервала, в которых могут находиться результаты отдельного определения при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
5. При определении хлоридов в питьевой воде нефелонометрическим методом получены следующие результаты (мг/дм3): 0,30; 0,32; 0,33; 0,34; 0,38. Является ли результат 0,38 промахом и следует ли его учитывать при статистической обработке экспериментальных данных?
6. При титровании 5 порций по 10 мл одного и того же раствора израсходованы следующие объемы кислоты (в мл) : 2,35; 2,66; 2,83; 2,65; 2,96. Определите (промахи) с помощью Q-теста.
7. Какого рода ошибки опыта Вам известны? Чем обусловлены и как устраняются ошибки различного рода?
8. По данным спектрального анализа пробы при 4 параллельных определениях найдено среднее содержание примесей W=0.36%. Среднее квадратическое отклонение равно при этом 0,018%. Найти доверительный интервал результата при доверительной вероятности Р=0,95. (Указание: применить критерий Стьюдента для малых выборок).
9. Как определить правильность и воспроизводимость химического анализа? Приведите примеры.
10. Принятое значение содержания хлорида в стандартном образце 36,64%. Анализ в производственной лаборатории дал среднее значение 36,91% и стандартное отклонение 0,03% из трех определений. Определить, имеется ли систематическая ошибка в использованном методе анализа. (Указание: применить критерий Стьюдента при Р=0,95).
Раздел 2. Эмиссионный спектральный, атомно-абсорбционный, флуоресцентный методы анализа.
11. Какова природа и происхождение атомных эмиссионных спектров, почему атомные спектры имеют линейчатый характер?
12. Приведите примеры практического применения эмиссионного спектрального анализа. Какова чувствительность и точность?
13. Вычислить длину волны линии  , если на экране спектропроектора она удалена от первой линии железа на 1,5 мм, а второй на 2,5 мм.
, если на экране спектропроектора она удалена от первой линии железа на 1,5 мм, а второй на 2,5 мм.  =3042,66 А0;
=3042,66 А0;  =3045,80 А0.
=3045,80 А0.
14. Порцию исследуемой воды объемом 25,0 мл разбавили дистиллированной водой в мерной колбе на 500,0 мл и фотометрировали в пламени так же, как и стандартные растворы, приготовленные из СаСо3. Результаты фотометрирования приведены в таблице:
| Параметры | Стандартные растворы | Образец | |||||
| Концентрация Са, мг/л Интенсивность фототока: J | |||||||
| 78,5 | 108,5 | 76,9 | 101,8 |
Построить градуировочный график и определить концентрацию (мг/л) кальция в исследуемой воде.
15. На чем основан качественный люминесцентный анализ? Привести примеры использования качественного люминесцентного анализа в пищевой промышленности (флуоресцентные индикаторы).
16. Образец, содержащий 2,9674 г цинка растворили в кислоте в 100 мл, и анализировали методом атомной абсорбции. Определить содержание цинка в исследуемом образце (%).
Результаты исследования приведены в таблице:
| Параметры | Стандартные раствора цинка | Образец | ||||
| С, мг/л Абсорбция | 1,0 0,11 | 3,0 0,30 | 5,0 0,54 | 6,0 0,67 | 7,0 0,79 | 0,37 |
17. Образец, содержащий 1,2456 г натрия растворили в колбе на 100,0 мл и анализировали, используя линию натрия (590 нм) методом атомной флуоресценции. Определить содержание натрия в исследуемом образце (мг/л). Результаты исследований приведены в таблице:
| Параметры | Стандартные растворы | Образцы | ||||
| CNa,мг/л Эмиссия флуоресценции | 0,5 | 1,0 | 2,0 | 2,5 | 4,0 |
18. Рассчитать процентное содержание марганца в стали методом трех эталонов по следующим данным сравнения спектральных линий марганца (2939,11 А0) и железа (2944,40 А0):
СMn(%)………………0.59 0.74 1.43 X
SMn........................0.896 1.020 1.49 1.105
SFe 0.764 0.748 0.763 0.760
19. При анализе алюминиевого сплава на кремний по методу одного эталона получили почернение (S) линий гомологической пары в спектрах эталона (SSi=2.09 и SAl= 0.37 при CSi=0.95%) и анализируемого образца (SSi=0.86 и SAl= 0.34). Определить процентное содержание кремния в образце, если S=0 при CSi=0.45%.
20. Рассчитать процентное содержание хрома в стали методом трех эталонов по следующим данным сравнения спектральных линий хрома и железа:
СCr(%)………… 0.50 1.23 4.17 X
SCr........................0.07 0.29 0.86 0.73
SFe 0.27 0.15 0.27 0.33
Раздел 3. Рефрактометрический метод анализа
21. Для построения градуировочного графика при определении содержания пропилового спирта в воде были получены следующие данные по шкале рефрактометра:
Содержание спирта,% 0 5 10 15 20 25 30
Показания
Рефрактометра 7,7 9,9 12,1 17,8 23,8 31,0 42,5
Построить градуировочный график и определить содержание пропилового спирта, если по шкале рефрактометра составили 12,8 и 28,5 деления.
22. Вычислить мольную рефракцию четыреххлористого углерода, если показатель преломления n20D=1.4603 г/см3. Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций, и связей (d=1,6040 г/см3).
23. Вычислить мольную рефракцию уксусной кислоты, если показатель преломления n20D=1.3690, а плотность 1.2493 г/см3. Сравните найденную рефракцию с вычисленной по таблицам атомных рефракций.
24.В чем заключается аддитивность атомной и мольной рефракции?
25. Сущность рефрактометрического метода анализа.
26. Для определения состава водных растворов пропанола были определены показатели преломления стандартных растворов, приведенные ниже:
Содержание пропанола, % 0 10 20 30 40
Показатель преломления 1,3330 1,3431 1,3523 1,3591 1,3672
Построить градуировочный график и определить содержание пропанола в растворах, показатели преломления которых: а) 1,3480; б) 1,3645.
27.Вычислить мольную рефракцию бромоформа CHBr3.
28. Вычислить мольную рефракцию бензола C6H6, молекула которого состоит из 6 атомов углерода и 6 атомов водорода: а) по правилу аддитивности; б) по опытным данным: n20D=1,5204. d=0,869 г/см3.
29. Углеводород С10Н16 2,5,8-декатриен имеет показатель преломления 1,4638 и плотность, d=0,8495 г/см3. Сравнить полученную мольную рефракцию с рассчитанной по формуле этого соединения.
30. Приведите график зависимости показателя преломления от концентрации раствора и поясните его.
Раздел 4. Фотометрический метод анализа
31. Навеску 0,6383 г сплава, содержащего медь, после растворения обработали аммиаком и получили 1000 мл окрашенного раствора, оптическая плотность которого при толщине слоя кюветы 2см равна 0.255. Молярный коэффициент погашения равен 423. Определить процентное содержание меди в сплаве.
32. Вычислить молярный коэффициент поглощения раствора меди, если оптическая плотность раствора, содержащего 0.830 г меди в 200мл при толщине слоя кюветы 5см равна 0.15.
33. Для определения меди в цветном сплаве из навески 0.1950 г после растворения обработки аммиаком было получено 500мл окрашенного раствора, оптическая плотность которого в кювете толщиной 10см была 0.167. Определить процентное содержание меди в сплаве ,если молярный коэффициент погашения равен 423.
34. Оптическая плотность раствора , содержащего 0.420 мг меди в 200мл при толщине слоя кюветы 1см равна 0.15. Вычислите молярный коэффициент поглощения меди.
35. Навеску 0.9000 г сплава, содержащего медь, после растворения обработали и получили 1000 мл окрашенного раствора, оптическая плотность которого при толщине слоя 2 см равна 0.24. Молярный коэффициент погашения равен 423. Определить процентное содержание меди в сплаве.
36. Молярный коэффициент погашения комплекса бериллия с ацетилацетоном в хлороформе равен 31.500. Определить процентное содержание бериллия в сплаве, если его навеска была растворена в 500мл. Оптическая плотность раствора ( после соответствующей обработки) при толщине слоя кюветы 5см равна 0.695.
37. При фотометрическом определение титана с хромотроповой кислотой в растворе, содержащем 11.496 мкг титана в 10мл, кювете толщиной слоя в 2см, была получена оптическая плотность, равная 0.245. Определить молярный коэффициент погашения окрашенного соединения.
38. Молярный коэффициент погашения комплекса бериллия с ацетилацетоном в хлороформе равен 31.600. Определить процентное содержание бериллия в навеске 2.9500г растворённом в 250мл, если оптическая плотность раствора в кювете 1см равна 0.260.
39.Определить молярный коэффициент погашения окрашенного соединения полученного при фотометрическом определение титана с хромотроповой кислотой, если оптическая плотность раствора , содержащего 125мкг титана в 250 мл при толщине слоя кюветы 10см равна 0.52.
40. Определить молярный коэффициент погашения окрашенного соединения полученного при фотометрическом определение железа (111) с сульфосалициловой кислотой, если оптическая плотность раствора, содержащего в 200мл 250мкг железа, равнялась 0.224 при толщине слоя кюветы 2 см.
Раздел5. Потенциометрический метод анализа.
41. Вычислить значение потенциала цинкового электрода, погруженного в раствор соли ZnSO4 полученный путём растворения 1.5950 г этой соли в дистиллированной воде, в мерной колбе ёмкостью 100мл, при температуре 300С.
42. Чему будет равен потенциал платинового электрода, погруженного в раствор H2SO4 , содержащий в 1 л 0.1580 г KMnO4 и 15.1000 г MnSO4 при 200С.
43. Определить концентрацию ионов меди в растворе , если известно, что при 300С значения потенциала медного электрода, погруженного в раствор CuSO4 составляет 0.280 В.
44. Расчитать рН раствора уксусной кислоты по следующим данным: индикаторный электрод – водородный; электрод сравнения- каломельный ( 0.1000 N КЭ ). Температура 300С, ЭДС = 0.498 В.
45. Расчитать рН раствора уксусной кислоты по следующим данным: индикаторный электрод – хингидронный; электрод сравнения- хлорсеребряный ( нас. ХС ). Температура 200С, ЭДС = 0.004 В.
46. Потенциометрическое определение активной и общей кислотности в растворе. Система электродов .Приборы.
47. Вычислить потенциал при титрование 0.0100 N раствора НСООН 0.1000 N раствором КОН в точке эквивалентности. Индикаторный электрод- хингидронный; электрод сравнения- насыщенный каломельный электрод ( нас. КЭ ), температура 30о,С.
48. Вычислить значение потенциала кадмиевого электрода в 0,01 М растворе его соли СdSO4 при 300С.
49. Построить кривую титрования при 200С 100 мл 0,1000 N раствора CH3COOH 1,000 N раствором KOH и определить объем титранта в точке эквивалентности. Индикаторный электрод-хингидронный; электрод сравнения-хлорсеребряный (1N. XC). Расчетные точки: 0;50;90;99;99,9;100;100,1;101;110% от точки эквивалентности.
50. Вычислить молярную концентрацию соли ZnSO4 при температуре 200С, если потенциал цинкового электрода, помещенного в раствор ZnSO4, составляет – 1,498 В. (Е0Zn2+ / Zn = -1.44 В)
Раздел 6. Кондуктометрический метод анализа
51. Определите удельную и эквивалентную электропроводимость 1 М раствора хлорида калия в ячейке с 2 электродами площадью 2,0 см2 и расстоянием между ними 15 мм, если сопротивление раствора составляет 50 Ом.
52. Определить удельное сопротивление, удельную и эквивалентную электропроводимость 0,01 М раствора нитрата натрия в ячейке с электродами площадью 1,6 см2 и расстоянием между ними 8 мм, если сопротивление раствора составляет 30 Ом.
53. Вычислите удельную и эквивалентную электропроводимость 0,02 М раствора нитрата серебра, если к ячейке с круглыми электродами диаметром 1,6 см и расстоянием между ними 10 мм приложено напряжение 0,8. В при силе тока 5 мА.
54. Определите сопротивление 0,1 М раствора NaNO3 в ячейке с квадратными электродами площадью 1 см2 и расстоянием между ними 5 мм, если эквивалентная электропроводимость раствора равна 100 см2/Ом∙экв.
55. Вычислите сопротивление 0,1 М раствора соляной кислоты в ячейке с электродами площадью 6,25 см2 и расстоянием между ними 20мм, если удельная электропроводимость раствора равна 0,4 Ом-1∙см-1.
56. Вычислить силу тока в ячейке, содержащей 0,1 н раствор хлорида калия с электродами площадью 4 см2 и расстоянием между ними 0,5 см, если прилагаемое напряжение составляет 400 мВ, а удельная электропроводность 1,167 Ом-1∙см-1.
57. Определите силу тока в ячейке, содержащей 0,1 N раствор нитрата натрия, с электродами площадью 2,0 см2 и расстояние между ними 10 мм, если прилагаемое напряжение равно 6,25 В и эквивалентная электропроводимость 200 см2/Ом∙экв.
58. При титровании 50,00 мл соляной кислоты 1,0000 N раствором гидроксида калия получены следующие результаты:
Объем 1,0000 N раствора KOH, V, мл 3,2 6,0 9,2 15,6 20,0 23,5
Удельная электропроводимость, æ, Ом-1∙см-1 3,20 2,50 1,85 1,65 2,35 2,95
Постройте градуировочный график и вычислите нормальность HCl.
59. При титровании 100,00 мл серной кислоты 2,0000 N раствором гидроксида натрия получены следующие результаты:
Объем 2N раствора NaOH,
V, мл 2,5 7,5 10,5 17,5 22,5 27,5
Удельная электропро- 4,50 3,15 2,10 2,12 3,45 4,60
водимость, Ом-1∙см-1
Постройте градуировочный график и вычислите нормальность серной кислоты.
60. При титровании 50,00 мл раствора уксусной кислоты 0,5000 N раствором гидроксида натрия получены следующие результаты:
Объем 0,5000 N раствора
NaOH,V, мл 8 9 10 11 13 15 17
Сопротивление R, Ом 75,0 67,8 62,3 57,0 52,9 52,3 52,1
Электропроводимость W,Ом-1
Рассчитайте электропроводимость раствора CH3COOH, постройте градуировочного график и вычислите нормальность раствора уксусной кислоты.
Раздел 7. Хроматографический метод анализа.
61. К 100,00 мл 0,1000 N соляной кислоты добавили 5 г катионита в Na+ - форме. После установления равновесия концентрация ионов уменьшилась до 0,0150 N. Определите статистическую обменную ёмкость для ионов водорода.
62. Рассчитать Rf (коэффициент пробега) для 3-х окрашенных веществ при хроматографировании их на пластинке в закреплённом слое силикагеля по следующим данным: расстояние до центра 3-х пятен от стартовой линии соответственно равно : 3,0 см; 5,8 см; 7,6 см; расстояние от стартовой линии до линии фронта растворителя равно 15 см.
63. При определении метилового спирта методом газовой хроматографии получены следующие хроматографические пики в зависимости от содержания:
m мг 0.3 0.6 0.9 0.12 0.15
h мм 9 19 28 38 47
Для исследуемой пробы этого раствора объёмом в 0.02 мл получен пик высотой = 33мм. Определить содержание метилового спирта в исследуемом растворе (в %), если плотность раствора 0.85 г/см3.
64. Рассчитать % состав смеси по данным, полученном при газохроматографическом разделении смеси:
| Газ | S | К |
| Пропан | 1,13 | |
| Бутан | 1,11 | |
| Пентан | 1,11 | |
| Циклогексан | 1,08 | |
| S- площадь пика, мм2; К- поправочный коэффициент |
65. При определении диоксидифенилметана в пищевых продуктах используют метод тонкослойного хроматографического разделения и количественного определения веществ по площади пятна S и интенсивности фототока J. Для стандартных образцов были получены данные:
Концентрация диоксидифенилметана
С, мкг/ 0.02 мл 1.25 2.56 6.40 18.2 33.1 77.3
Площадь пятна Sмм2 9 17 29 55 80 120
Интенсивность фототока
отражения J, мА 2.3 2.8 3.4 4.3 5.1 7.2
Для построения градуировочного графика используется зависимость
Lg(S∙J)- lgC.
Обработали 150 г овощей 100мл спирта, который затем упарили до 10 мл. От 0.02 мл этого раствора при хроматографии получено пятно площадью 35.0 мм2 с интенсивностью фототока отражения 2.5 мА. Определить содержание диоксидифенилметана в овощах (мкг/кг).
66.Для определения никеля в ферритах методом бумажной хроматографии по площади пятна на бумаге, пропитанной диметилглиоксимом с водой в качестве растворителя, были получены следующие площади пятен в зависимости от концентрации никеля:
С, мг/0.2 мл 0.12 0.45 0.90 1.20 1.65
S, мм2 26 44 66.5 83 105
При анализе феррита навеску 500 мг растворили в кислоте и разбавили до 25.0 мл. Пипеткой на хроматографическую бумагу нанесли 0.20 мл раствора и после хроматографического разделения определили площадь пятна, которая оказалась равной 52.5 мм2. Определить содержание никеля в феррите (%).
67. При определение метилового спирта методом газовой хроматографии были получены следующие пики в зависимости от содержания:
m, мг 0.2 0.4 0.6 0.8 1.0
h, мм 18 36 48 66 83
Для 0.02 мл исследуемого раствора получен пик высотой = 57 мм. Определить содержание спирта в исследуемом растворе (%), если плотность раствора 0.95 г/см3.
68. Смесь катионов, содержащаяся в молоке, при разделении в тонком слое оксида алюминия с помощью ацетона, содержащего 8% воды и 8% конц HCL дала после проявления с помощью K4[Fe(CN)6] 3 пятна со значением Rf :0.27, 0.58 0.70 соответственно.
Пробы катионов – свидетелей, помещённых на ту же пластинку, имеют следующие значения Rf: Ni2+- 0.26; Co2+- 0.44; Cu2+- 0.57; Fe3+- 0.69.
Определить катионы , входящие в состав молока, а так же их нормальную концентрацию в продукте по формуле С= KDS, если известно что К= 0.2; а площади пятен на хроматограмме для Ni2+ , Co2+, Cu2+, Fe3+ равны соответственно 40мм2 42мм2 50мм2 45мм2, а их оптические плотности D: 0.0125, 0.0120, 0.020, 0.0165.
69. При газохроматографическом разделении двух метильных производных жирных кислот время удерживания для первого составило 3,45 мин, для второго 3,76 мин; время удерживания несорбирующегося компонента 15 сек. Ширина первого пика составляет 1,3 см, второго 1,5 см. Вычислить разрешающую способность колонки.
70. В 1-ую из серии одинаковых хроматографических колонок (диаметр 0.3 см высота 10 см), наполненную смесью Al2 O3 и раствором K4 [Fe(CN)6 ], внесли 0.5 мл пробы, полученной экстрагированием гречневой крупы. Во 2-ую колонку было внесено 0.5 мл контрольного раствора FeCl3 , содержащего 1 мг Fe3+ в 1 мл. В третью внесено 0.5 мл раствора, содержащего 2.0 мг железа Fe3+ в 1 мл, в четвертую 0,5 мл раствора, содержащего 3 мг Fe3+ в 1 мл, в пятую 0,5 мл раствора содержащего 4 мг Fe3+ в 1 мл , в шестую 0,5 мл раствора содержащего 5 мг Fe3+ в 1 мл.
Длина пробега окрашенной зоны составила для пробы -5 см (1-я колонка), во 2й -1.5см в3й- 3см в 4й- 4.5см в 5й- 6.0см в 6й- 7.5см. Определить содержание Fe3+ в мг/ мл в экстракте гречневой крупы.
ПРИЛОЖЕНИЕ
Рефракция атомов и связей.
| Атом и связь | R, см3/моль |
| Углерод Водород Хлор Бром Иод Фтор Кислород гидроксильный Кислород карбонильный Азот аминогруппы Двойная связь С=С | 2,42 1,10 5,97 8,86 13,90 0,997 1,53 2,21 2,32 1,73 |
Рекомендуемая литература
1. Васильев В.П. Аналитическая химия. Физико-химические методы анализа. - М.: высшая школа, 1989, Т. 2, 384 с.
2. Логинов Н.Я., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. - М.: Просвещение, 1979,479 с.
3. Ляликов Ю.С. Физико-химические методы. -М.: Химия, 1973, 536 с.
4. Крешков А.П. Основы аналитической химии. - М.: Химия, 1970, 471 с.
5. Бончев П.Р. Введение в аналитическую химию. - Л.: Химия, 1978,496 с.
6. Ляликов Ю.С., Булатов М.И. и др. Сборник задач по физико-химическим методам анализа. - М.: Химия, 1972, 220 с.
7. Цитович и.Е. Курс аналитической химии. - М.: Высшая школа, 1994, 495 с.
8. Основы аналитической химии. Практическое руководство (под ред. Ю.А. Золотова). М.: Высшая школа, 2002, 460 с.
9. Коренман Я.И. Практикум по аналитической химии. М.: Колос, 2005, 237с.
10. Коренман Я.И., Суханов П.Т. Задачник по аналитической химии. Воронеж: ВГТА, 2004, 339 с.
Вопросы к экзамену.
1. Понятия аналитическая химия и химический анализ.
2. История развития аналитической химии.
3. Метрология в аналитической химии.
4. Виды погрешностей химического анализа.
5. Математическая обработка результатов анализа.
6. Способы пробоподготовки в анализе пищевых объектов.
7. Растворы. Способы выражения концентрации: молярная, нормальная, титр раствора.
8. Качественный анализ. Понятие дробного и систематического качественного анализа.
9. Качественный анализ катионов.
10. Кислотно-основная классификация.
11. Реакция обнаружения отдельных катионов.
12. Качественный анализ анионов.
13. Разделение анионов на аналитические группы. Групповые реагенты.
14. Реакции обнаружения анионов.
15. Количественный химический анализ.
16. Классификация химических методов анализа.
17. Гравиметрический метод анализа.
18. Требования, предъявляемые к осадкам и весовым формам в гравиметрии.
19. Титриметрические методы анализа, классификация методов по характеру реакции, лежащей в основе титрования.
20. Требования, предъявляемые к титриметрическим реакциям.
21. Способы титрования (прямое, обратное, заместительное)
22. Приготовление первичных и вторичных стандартных растворов.
23. Способы установления конечной точки титрования. Индикаторы. Индикаторные ошибки.
24. Расчет результатов титриметрического анализа.
25. Расчет содержания определяемого вещества по нормальности, по титру стандартного раствора, по титру, выраженному по определяемому веществу.
26. Расчет содержания определяемого вещества методом обратного титрования.
27. Характеристика метода кислотно-основного титрования.
28. Протолитическая теория кислот и оснований (теория Бренстеда, Лоури и Льюиса)
29. Равновесие в водных растворах кислот и оснований.
30. Сильные и слабые кислоты и основания, расчет рН.
31. Буферные растворы. Ионная сила. Буферная емкость. Расчет рН.
32. Титрование сильных и слабых одноосновных кислот и оснований.
33. Кривые титрования. Графический способ изображения.
34. Кислотно-основные индикаторы. Теория кислотно-основных индикаторов.
35. Выбор индикаторов для титрования.
36. Показатель титрования рТ
37. Сущность редоксиметрических методов анализа, Классификация методов по названию титранта.
38.Требования, предъявляемые к реакциям, применяемым в редоксиметрии.
39. Редокс- индикаторы.
40. Примеры определения окислителей и восстановителей редоксиметрическим методом анализа.
41. Перманганатометрия, сущность метода.
42. Приготовление первичных и вторичных стандартных растворов в перманганатометрии.
43. Йодометрия, характеристика метода.
44. Осадительное титрование. Сущность метода. Примеры.
45. Аргентометрия, роданометрия.
46. Комплексонометрическое титрование. Характеристика метода.
47. Применение комплексных соединений в анализе.
48. Применение комплексонов в анализе катионов.
49. Индикаторы применяемые в комплексонометрии.
50 Примеры определения кальция, магния, железа и др.; жёсткости воды комплексонометрическим методом анализа.
51. Физико-химические методы анализа. Классификация
52. Сущность потенциометрического метода анализа.
53. Приборы. Система электродов ( индикаторные и электроды сравнения).
54. Прямая потенциометрия.
55. Потенциометрическое титрование.
56. Ионометрические методы анализа. Примеры определения.
57. Кондуктометрия. Сущность метода. Приборы.
58. Прямая кондуктометрия, кондуктометрическое титрование.
59. Вольтамперометрические методы анализа.
60. Поляграфия. Приборы.
61. Амперометрическое титрование.
62. Кулонометрический метод анализа.
63. Законы электролиза.
64. Оптические методы анализа, Классификация.
65. Спектрофотоэлектроколориметрический метод анализа. Теоретические основы метода.
66. Оптическая плотность растворов. Закон Бугера-Ламберта-Бера.
67. Спектры поглощения.
68. Метод градуировочного графика.
69. Приборы. Техника выполнения анализа.
70. Рефрактометрический метод анализа. Сущность метода.
71. Атомная, молекулярная рефракция.
72. Приборы и техника выполнения рефрактометрического метода анализа.
73. Пламенно- фотометрический метод анализа. Сущность метода.
74. Приборы и техника выполнения метода.
75. Эмиссионный спектральный анализ. Характеристики электромагнитного излучения.
76. Основы качественного и количественного анализа.
77. Приборы, техника выполнения.
78. Сущность атомно-абсорбционного метода анализа.
79. Приборы, техника выполнения.
80. Люминесцентный метод анализа.
81. Флуориметрический метод определения витаминов.
83. Хроматографические методы анализа. Классификация.
84. Экстракция и хроматография как метод разделения веществ.
85. Степень, скорость, кратность экстракции.
86. Бумажная хроматография.
87. Тонкослойная хроматография.
88. Газо-жидкостная хроматография.
89. Гель- хроматография.
90. Приборы, техника выполнения.
Роева Наталья Николаевна
Касьяненко Галина Рудольфовна
Дата добавления: 2015-04-15; просмотров: 376; Мы поможем в написании вашей работы!; Нарушение авторских прав |