
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
БУФЕРНЫЕ РАСТВОРЫ
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ИМЕНИ ИММАНУИЛА КАНТА
Аналитическая химия
Методические указания
Калининград
ЧАСТЬ 1
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Индивидуальные задания выдаются студентам с целью закрепления теоретического материала по наиболее важным разделам аналитической химии, а также выработки практических навыков при выполнении расчетных задач.
К выполнению индивидуальных задач следует приступить после изучения соответствующего раздела курса и разбора решений примеров по данной теме
Студент выполняет один вариант, номер которого дается на кафедре. Задания выполняются в отдельной тетради. Отвечать на вопросы и решать задачи необходимо в той последовательности, в какой она приведена в методических указаниях. В конце работы необходимо привести список используемой литературы.
РАВНОВЕСИЕ В ГОМОГЕННЫХ СИСТЕМАХ
Вычислить рН растворов
1.40 г едкого натра растворили в 2 л воды.
2. Гидроксида натрия, массовая доля 0,08%.
3. Азотная кислота, массовая доля 0,1%
4. Азотная кислота, ρ = 1,005 г / см3.
5. Хлористоводородная кислота, массовая доля 0,18%.
6. Гидроксид лития, массовая доля 0,09%.
7. Серная кислота, ρ = 1,01 г / см3.
8. 0,63 г гидроксида калия растворили в 500 см3 воды.
9. 5,6 л аммиака растворили в 250 см3 воды.
10. Серная кислота, массовая доля 0,05%.
11. Гидроксид цезия 0,1%.
12. К 50 см3 0,15 М раствора соляной кислоты добавили 25 см3 0,2 N NaOH
13. К 25 см3 0,2 М раствора азотной кислоты прибавили 50 см3 0,15 М LiOH.
14. К 100 см3 0,08 N раствора соляной кислоты прибавили 50 см3 0,1 N KOH
15. К 15 см3 015 N раствора серной кислоты добавили 25 см3 0,09 N NaOH
16. К 2 дм3 воды прибавили 1 см3 азотной кислоты (ρ = 1,4 г / см3).
17. К 1,5 дм3 воды прибавили 0,5 см3 соляной кислоты (ρ = 1,12 г / см3).
18. К 500 см3 воды прибавили 0,05 см3 01% раствора гидроксида калия.
19. К 250 см3 воды прибавили 0,05 см3 раствора серной кислоты (ρ=1,78 г/ cм3).
20. К 1 дм3 воды прибавили 0,5 см3 гидроксида калия с концентрацией 0,15%.
21. 4,6 г муравьиной кислоты растворили в 500 см3 воды.
22. 12,2 г бензойной кислоты (C6H5COOH) растворили в 2 дм3 воды.
23. 1,12 дм3 аммиака растворили в 250 см3 воды.
24. 6,6 г уксусной кислоты растворили в 1000 см3 воды.
25. Муравьиная кислота, 0,15% раствор.
БУФЕРНЫЕ РАСТВОРЫ
Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие. Для буферного раствора, содержащего слабую кислоту и ее соль
рН= рКа + lg Cсоли – lg Cкислоты
а для смеси из слабого основания и его соли
рН = 14 – рКв + lg Соснования – lgCсоли,
Пример 1: К 15 мл 0,03 М раствора муравьиной кислоты добавили 12 мл 0,15 М формиата калия. Вычислить рН раствора (КHCOOH= 1,8 ∙10-4;
рКHCOOH= 3,75)
Решение: Найдем концентрацию кислоты и ее соли после смешивания растворов.
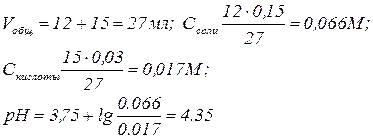
Пример 2: Сколько г CH3COONa надо добавить к 200 см3 0,2 М раствора соляной кислоты, чтобы рН стала равной 4,5? рKукс кисл = 4,78
Решение: CH3COONa + HCl = CH3COOH + NaCl
Концентрация уксусной кислоты, образовавшейся в результате этой реакции, равна концентрации соляной кислоты:
С(HCl) = 0,2 M , а С(CH3COO–) = Х– 0,2 М
рH = pKa + lgCсоли– lgCкислоты
4,5 = 4,76 + lg (Х– 0,2) – lg 0,2 Х= 0,3099 М
Количество CH3COONa на 200 см3 воды (В) составит:
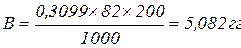
Вычислить рН буферных растворов, полученных при сливании растворов:
26. 50 см30,1% C6H5COOH и 150 см3 0,3% С6H5COONa
27. 30 см3 0,05 М H2CO3 и 70 см3 0,15 М Na2CO3
28. 40 см3 0,05% С6H5COOH и 110 см3 0,1% С6H5COOK
29. 10 см3 0,02 М HNO3 и 40 см3 0,05 М KNO2
30. 20 см3 0,15% H2SO3 и 80 см3 0,1% Na2SO3
31. 60 см3 0,01 М CH3COOH и 40 см3 0,05 М CH3COOK
32. 150 см3 0,02% CH3CH2COOH и 50 см3 0,1% CH3CH2COOK
33. 70 см3 0,01 М NH4Cl и 30 см3 0,05 М NH4OH
34. 170 см3 0,1 М KH2PO4 и 150 см3 0,05 М K2HPO4
35. 50 см3 0,05% Na2CO3 и 150 см3 0,1% NaHCO3
36. 130 см3 0,02 М NaH2PO4 и 20 см3 0,05 М Na2HPO4
37. 80 см3 0,1% Na2SO3 и 120 см3 0,05% H2SO3
38. 60 см3 0,03 М CH3COOK и 40 см3 0,02 М CH3COOH
39. 90 см3 0,05% NH4OH и 110 см3 0,1% NH4Br
40. Сколько см3 0,5% раствора формиата натрия надо добавить к 50 см3 0,1 М раствора муравьиной кислоты, чтобы получить раствор с рН = 3,8?
41. Сколько грамм карбоната натрия надо добавить к 50 см3 0,2 М гидрокарбоната натрия, чтобы получить раствор с рН= 9,8?
42. Сколько см3 0,4 М раствора нитрита аммония надо добавить к 20 см3 0,15 М раствора аммиака, чтобы получить раствор с рН =9,1?
43. Сколько см3 1% гидроксида натрия надо добавить к 50 см3 0,25 М фосфорной кислоты, чтобы получить раствор с рН = 2,5?
44. Сколько см3 0,1 М гидроксида калия надо добавить к 50 см3 0,25 М дигидрофосфата калия, чтобы получить раствор с рН = 6,8?
45. Сколько грамм ацетата натрия надо добавить к 150 см3 0,15 М раствора соляной кислоты, чтобы получить раствор с рН = 4,3?
Дата добавления: 2015-04-15; просмотров: 406; Мы поможем в написании вашей работы!; Нарушение авторских прав |