
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПРОИЗВОДСТВО БЕЛКА ОДНОКЛЕТОЧНЫХ
Мировой дефицит белка оценивается в 15–30 млн. т в год. Белковый дефицит может быть устранен интенсификацией сельскохозяйственного производства, использованием ресурсов Мирового океана, органическим или микробиологическим синтезом белков.
Микробиологический синтез белка имеет ряд преимуществ: высокую скорость роста микробных клеток по сравнению с растительными и животными, «мягкие» условия процесса биосинтеза (температура 30–45°С, рН 4–6, атмосферное давление), возможность применения дешевого сырья в виде отходов производств, независимость накопления биомассы от климатических условий.
В развитых западных странах в кормопроизводстве широко используется белок сои. Мировой уровень производства соевых бобов составляет более 120 млн. т в год. Большая часть территории бывшего СССР малопригодна для эффективного возделывания этой культуры, что и предопределило быстрое развитие крупнотоннажной отрасли по получению микробного белка. Крупнейшие в мире заводы, производящие сухую микробную биомассу, были построены в Республике Беларусь. Повышение цен на энергоносители до уровня мировых привело к резкому снижению рентабельности и сокращению производства микробного белка.
Потребность в кормовом белке для животноводства и птицеводства по Республике Беларусь на 2010 г. оценивается в 120 тыс. т при фактическом уровне производства около 6 тыс. т в год.
Из-за высоких энергетических затрат на производство сухой биомассы микробный белок не может конкурировать с более дешевым белком сои. Однако все развитые страны располагают отработанными на промышленных установках технологическими процессами производства микробного белка на различных видах сырья.
Качество белоксодержащего продукта оценивается прежде всего по содержанию истинного белка и по его аминокислотному составу. Микробная биомасса содержит 42–50% истинного белка от сухой массы и превосходит по этому показателю соевую муку (35–37%), не уступая по содержанию незаменимых аминокислот. Повышает кормовую ценность микробной биомассы высокое содержание витаминов группы В.
Питательная среда для культивирования продуцентов белка одноклеточных должна содержать источник углерода (субстрат), азот, фосфор, калий в доступной для микробных клеток форме и микроэлементы (Fe, Mg, Mn, Zn и др.). В промышленных условиях применяют разнообразные субстраты: углеводы различного происхождения (в составе гидролизатов растительного сырья, сульфитных щелоков, свеклосахарной мелассы), углеводороды (фракция н-парафинов С11–С18), спирты (этанол, метанол), метан (в составе природного газа), а также жидкие отходы пищевой промышленности (молочную сыворотку, послеспиртовую барду, картофельный сок и др.).
Технология производства белка одноклеточных мало зависит от вида используемого субстрата. Существенные различия имеют место только на стадии культивирования продуцентов белка, аппаратурное оформление которой и технологический режим процесса определяются видом применяемого источника углерода.
Типовая технологическая схема производства сухой микробной массы включает следующие операции: приготовление питательной среды, получение посевного материала, производственная ферментация, сгущение микробной суспензии в центробежных машинах, термообработка суспензии с целью получения легкоусваиваемого плазмолизата, концентрирование биомассы упариванием под разряжением, сушка концентрата с получением порошкообразного или гранулированного продукта, фасовка и упаковка товарного продукта.
В качестве продуцентов кормового белка широко используют дрожжи (точнее дрожжеподобные грибы), реже применяют бактерии и очень редко – мицелиальные грибы. Предпочтение отдают дрожжевым культурам, как наиболее изученным и не требующим, в отличие от бактерий, асептических условий культивирования. Массовое развитие посторонних микроорганизмов (бактерий) при нестерильном выращивании дрожжей ограничивается пониженным значением величины рН ферментационной среды (4,2–4,5), которое не оказывает негативного влияния на скорость накопления биомассы продуцентом белка. В то же время кислая среда не препятствует размножению «диких» дрожжей. Состояние популяции считают удовлетворительным, если доля основной культуры дрожжей составляет не менее 80%.
Бактериальные культуры отличаются высоким выходом белка от ассимилированного субстрата, но необходимость обеспечения асептических условий культивирования резко повышает энергетические и капитальные затраты, а малые размеры бактериальных клеток осложняют реализацию технологической операции по сгущению микробной суспензии.
Использование мицелиальных грибов в крупнотоннажном производстве белка ограничивается их низкой удельной скоростью роста (0,12–0,15 ч–1).
Важнейшими характеристиками культур – продуцентов белка – являются: выход биомассы от ассимилированного субстрата (экономический коэффициент), удельная скорость роста популяции, содержание белка в биомассе и продуктивность культуры по абсолютно сухой биомассе (АСБ), г АСБ/(дм3·ч).
Для промышленных продуцентов белка выход биомассы на различных субстратах колеблется в пределах 33–100% и определяется главным образом физиологическими особенностями штамма, долей углерода в молекуле субстрата и доброкачественностью питательной среды. Чем больше доля углерода в молекуле субстрата, тем выше ожидаемый выход биомассы.
В производственных условиях накопление биомассы продуцентов белка осуществляют непрерывным культивированием в режиме хемостата, когда скорость роста и плотность популяции ограничена концентрацией лимитирующего субстрата, поступление которого в ферментатор регулируется изменением скорости протока среды.
Продуценты белка нуждаются в обеспечении растворенным в ферментационной среде кислородом, потребность в котором высокая и сильно зависит от природы субстрата. Чем больше восстановлена молекула субстрата, тем выше потребность в кислороде на ее окисление. Например, потребность в кислороде на синтез 1 кг абсолютно сухой биомассы при культивировании продуцентов белка на глюкозе составляет в среднем 0,9 кг, на н-парафинах – 2,2 кг, на метане – 5 кг.
Скорость растворения кислорода в жидкой фазе определяется конструкцией системы воздухораспределения ферментатора. Для каждого конкретного типа ферментатора существует предельное значение скорости растворения кислорода, которому соответствует критическая концентрация биомассы продуцента. Концентрация биомассы в ферментаторе не может быть выше критической из-за недостатка кислорода. Исходя из величины критической концентрации, определяют паспортную производительность ферментатора по биомассе. Рабочая концентрация микробной массы в ферментаторе должна быть близка к критической. Из уравнений материального баланса ферментации можно рассчитать предельную концентрацию субстрата Сн, %, в приточной среде
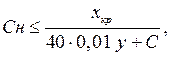
где xкр – критическая концентрация биомассы, кг/м3;
y – экономический коэффициент, %;
Cк – остаточная концентрация субстрата в микробной суспензии, %.
В прямой пропорциональной зависимости от потребности в кислороде находится еще одна важная характеристика ферментационного процесса – удельное тепловыделение. Количество биологического тепла, выделяющегося в процессе синтеза 1 кг АСБ при культивировании продуцентов белка на глюкозе составляет в среднем 13 МДж, на н-парафинах – 28 МДж, на метане – 60 МДж.
Тепловыделения настолько велики, что в летнее время года существует проблема отвода биологического тепла в ферментаторах охлаждающей водой для поддержания оптимальной температуры процесса. В связи с этим важной характеристикой производственного штамма продуцента белка является высокая оптимальная температура культивирования.
Представленные факторы важнейшие (но не все) из числа определяющих эффективность ферментационного процесса при биосинтезе микробной массы. Рассмотрим характерные особенности производства кормового белка на различных видах сырья.
Наибольшим потенциалом в производстве микробного белка обладают растительные целлюлозосодержащие материалы. Растительное сырье является ежегодно возобновляемым и при рациональном природопользовании практически неисчерпаемым, что и определяет перспективность использования его в микробиологическом синтезе. На практике отработаны технологические процессы производства микробного белка с использованием в качестве сырья древесных отходов в виде щепы и опилок, подсолнечной лузги, стержней кукурузных початков, торфа, хлопковой шелухи. Принципиально в производство могут быть вовлечены любые растительные материалы, например, льняная кастра, солома, камыш, тростник и др. Широкое использование растительного сырья в биотехнологии ограничивает необходимость предварительного гидролиза целлюлозосодержащих материалов в присутствии катализаторов (минеральных кислот, ферментов) и большие затраты (прежде всего энергетические) на этот процесс.
Основными компонентами растительного сырья являются целлюлоза, гемицеллюлозы и лигнин. Промышленная ценность сырья (табл. 7.1) определяется содержанием углеводного комплекса (целлюлоза + гемицеллюлозы), в котором основная доля принадлежит целлюлозе.
Таблица 7.1
Основные компоненты растительного сырья
| Компоненты | Содержание в % от абсолютно сухого вещества | ||||
| древесина | сельскохозяйственные отходы | ||||
| сосна | береза | стержни кукурузных початков | пшеничная солома | подсолнечная лузга | |
| Полисахариды: – легкогидролизуемые (гемицеллюлозы) | 17,8 | 26,5 | 37,9 | 23,4 | 21,9 |
| – трудногидролизуемые (целлюлоза) | 47,7 | 39,4 | 33,4 | 39,0 | 28,7 |
| Лигнин | 24,7 | 19,7 | 15,2 | 24,5 | 28,2 |
| Минеральные вещества | 0,2 | 0,1 | 1,1 | 5,9 | 2,2 |
| Теоретический выход моносахаридов | 72,5 | 73,2 | 79,3 | 64,6 | 52,8 |
Степень полимеризации целлюлозы древесины составляет 3000–8000. Макромолекулы целлюлозы за счет межмолекулярных водородных связей образуют обособленные структуры (микрофибриллы) диаметром 3·10–9 м. Причем плотность упаковки макромолекул в продольном направлении неодинакова. Плотно упакованные участки (160–200 элементарных звеньев) чередуются с участками с рыхлой структурой (15–25 элементарных звеньев). Каждая макромолекула целлюлозы проходит через 10–20 плотных и рыхлых участков микрофибриллы. Содержание рыхлой фракции в древесной целлюлозе составляет 10–15%. Надмолекулярная структура целлюлозы определяет ее реакционную способность.
Участки с рыхлой упаковкой макромолекул целлюлозы гидролизуются легко (катализатор имеет доступ к макромолекулам), гидролиз плотно упакованных участков протекает медленно, в гетерогенных условиях (катализатор действует на поверхности микрофибриллы, доступ внутрь ограничен).
Гемицеллюлозы в отличие от целлюлозы имеют нерегулярное строение, хотя большинство компонентов гемицеллюлоз можно отнести к полисахаридам со скрытой регулярностью строения. Основными полисахаридами гемицеллюлозной части лиственной древесины являются 4-о-метилглюкуроноксилан и глюкоманнан. Гемицеллюлозы хвойной древесины представлены главным образом галактоглюкоманнаном и арабиногалактаном. Макромолекулы гемицеллюлоз построены из остатков различных моносахаридов. Степень полимеризации гемицеллюлоз преимущественно 100–250 (70–600). Макромолекулы имеют боковые цепи. В основных цепях преобладают 1–4 β-гликозидные связи, в точках разветвления 1–2 β- (реже 1–3 β- и 1–6 β-гликозидные связи).
Гидролиз гемицеллюлоз протекает быстро, в гомогенных условиях.

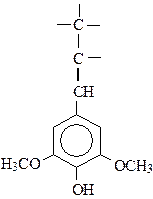 Лигнин – инкрустирующий биополимер с дальним порядком регулярности строения. Макромолекула лигнина построена из фенилпропановых структур:
Лигнин – инкрустирующий биополимер с дальним порядком регулярности строения. Макромолекула лигнина построена из фенилпропановых структур:

гваяцильный тип сирингильный тип п-гидроксифенильный тип
Содержание лигнина в одревесневшей растительной ткани составляет 18–30% (содержится в первичной оболочке клеток и межклеточном веществе). Лигнин выполняет в основном механические функции (инкрустирующий полимер), придавая жесткость растительной ткани, прочность древесине и биологическую стойкость. В макромолекулах лигнина фенилпропановые структурные звенья связаны между собой разнообразными химическими связями (главным образом простыми эфирными и углерод-углеродными связями). Большинство авторов считают, что нет строгого порядка в чередовании типа этих связей (известна модель фрагмента лигнина по Фрайденбергу). Для лигнина характерна гетерогенность (неоднородность) структуры, которая проявляется в наличии низкомолекулярной (в небольшом количестве) и высокомолекулярной фракций.
Макромолекулы лигнина связаны между собой поперечными связями в различных направлениях, образуя трехмерную пространственную сетку. Имеются химические связи между лигнином и гемицеллюлозными полисахаридами растительной ткани (образуется суперсетчатая структура).
При гидролизе растительного сырья лигнин образует негидролизуемый остаток и затрудняет доступ катализатора к полисахаридам.
В производственной практике апробированы различные методы гидролиза растительных материалов:
– гидролиз разбавленным раствором серной кислоты (0,5–0,6%);
– гидролиз концентрированной серной кислотой (≥ 75%);
– ферментативный гидролиз;
– автогидролиз.
Механизм гидролиза состоит в том, что ион гидроксония (H3O+), образующийся в результате диссоциации серной кислоты в воде, протонирует гликозидный кислород в макромолекуле полисахарида, что приводит к активации и разрыву гликозидной связи. По месту разрыва связи присоединяется молекула воды.
Наиболее отработан в промышленных масштабах гидролиз разбавленной серной кислотой при температуре 180–190°С. Процесс проводят в периодически действующих гидролизаппаратах объемом 50–80 м3 в режиме перколяции (протока) варочного раствора (0,5–0,6% H2SO4) через слой гидролизуемого материала (смесь щепы и опилок). Длительное промышленное использование метода и разработанные приемы совершенствования перколяционного процесса не привели к преодолению его главных недостатков: большие затраты энергии (пара) на поддержание температуры процесса (180–190°С); низкая биологическая доброкачественность гидролизата, содержащего продукты распада моносахаридов (фурфурол, гидроксиметилфурфурол), ингибирующие рост дрожжей – продуцентов белка; невысокий выход моносахаридов (46–48% от абсолютно сухой древесины).
При гидролизе концентрированной серной кислотой процесс проводят при температуре 50°С. В концентрированной серной кислоте целлюлоза переходит в растворенное состояние и легко гидролизуется. Благодаря низкой температуре реакционной среды распад образующихся моносахаридов минимальный, биологическая доброкачественность получаемого гидролизата высокая. Однако, несмотря на имеющиеся преимущества, рассматриваемый метод гидролиза отягощен рядом недостатков, которые до настоящего времени технологически не устранены: большой расход кислоты на единицу массы сырья; сложность равномерного распределения концентрированной кислоты в большом объеме гидролизуемого материала; необходимость подсушивания сырья для удаления влаги, разбавляющей кислоту; реверсия части моносахаридов в присутствии концентрированной кислоты (водоотнимающий агент) с образованием олигосахаридов, которые дрожжами-продуцентами белка не ассимилируются.
Автогидролиз отличается тем, что катализатором процесса является уксусная кислота, образующаяся в результате отщепления ацетильных групп гемицеллюлоз в присутствии воды в условиях высокотемпературоной обработки (200–230°С). Промышленного значения этот процесс пока не имеет.
Наибольшие перспективы в переработке растительного сырья связывают в настоящее время с ферментативным гидролизом, осуществляемым с использованием ферментных препаратов, обладающих целлюлазной активностью. Ферментативный гидролиз протекает при низкой температуре (40–50°С), что, помимо энергосбережения, практически исключает распад образующихся моносахаридов и накопление в гидролизате токсичных для продуцентов белка соединений.
Однако при разработке технологического процесса выявлены недостатки метода, которые до настоящего времени не удается преодолеть: низкая скорость гидролиза целлюлозы, связанная с ее надмолекулярной структурой и блокированием углеводного комплекса лигнином (продолжительность процесса ферментативного гидролиза около 50 часов); ингибирование ферментов конечными продуктами гидролиза; большой расход ферментного препарата при его высокой стоимости.
Таким образом, единственным методом гидролиза растительного сырья, реализованным в промышленных масштабах, остается высокотемпературный (180–190°С) гидролиз разбавленной серной кислотой.
Основной углеродсодержащий субстрат в гидролизатах – углеводы, представленные пентозными (ксилоза и арабиноза) и гексозными (глюкоза, манноза и галактоза) моносахаридами, объединяемыми под общим названием редуцирующие вещества (РВ), а также органические кислоты (главным образом уксусная и левулиновая). Содержание РВ в гидролизате − 3,0–3,5%.
Перед биохимической переработкой гидролизаты подвергают кондиционированию: нейтрализация известковым молоком до рН 4,2–4,4, удаление токсичных соединений продувкой воздухом, охлаждение до температуры ферментации, обогащение гидролизного сусла биогенными элементами (азот, фосфор, калий).
Промышленные продуценты белка на гидролизатах – дрожжеподобные грибы Candida scottii, Hansenula anomala, Trichosporon cutaneum. Наиболее продуктивна культура C. scottii: выход сухой биомассы составляет 48–50% от РВ, удельная скорость роста лежит в пределах 0,25–0,28 ч-1, размножается почкованием, очень хорошо флотируется. Оптимальная температура роста 38–39°С.
Дрожжи ассимилируют прежде всего моносахариды и уксусную кислоту, которые по предпочтительности для дрожжевых клеток располагаются в следующем ряду: глюкоза > уксусная кислота > манноза > ксилоза > галактоза > арабиноза.
Выращивание дрожжеподобных грибов осуществляют в ферментаторах эрлифтного типа объемом 600 или 1300 м3 с децентрализованной системой распределения воздуха.
Жидкие н-парафины. Под этим термином понимают фракцию углеводородов нормального строения (СnН2n + 2) с числом атомов углерода от 9 до 24, выкипающую в температурных пределах 200–340°С. Промышленные продуценты белка с высокой скоростью ассимилируют углеводороды С11–С18 и практически не ассимилируют «тяжелые» н-парафины С20–С24, парафины разветвленного строения, ароматические углеводороды.
В качестве продуцентов белка на средах с н-парафинами используют дрожжеподобные грибы рода Candida (C. guilliermondii, C. parapsilosis, C. salmonicola, C. maltosa), которые отличаются высоким выходом биомассы (96–98%) от ассимилированного субстрата. Оптимальная температура культивирования продуцентов 30–32°С.
Жидкие н-парафины практически нерастворимы в воде, что исключает применение малоэнергоемких ферментаторов эрлифтного типа. Чтобы обеспечить высокую скорость ассимиляции н-парафинов, их эмульгируют в воде мешалкой турбинного типа до капель размером не более 3 мкм. Промышленный ферментатор АДР-900-76 объемом 900 м3 оснащен 13-ю турбинными мешалками, мощность привода каждой из них 315 кВт. По сравнению с углеводными средами накопление дрожжевой биомассы на жидких н-парафинах отличается значительными энергетическими затратами на диспергирование субстрата, более высокой потребностью в кислороде воздуха для окисления углеводородов и большими тепловыделениями.
Сухой белоксодержащий продукт, полученный на жидких н-пара-финах, получил торговое название паприн. Характерная особенность паприна состоит в том, что он содержит до 2% «тяжелых» углеводородов (С20–С24), проникших внутрь клеток, но не ассимилированных дрожжами. Присутствие углеводородов снижает качество паприна как кормовой добавки.
Природный газ. Основу природного газа составляет метан (92–98%). Природный газ имеет невысокую стоимость, легко транспортируется, не содержит примесей, ингибирующих рост продуцентов белка, которые способны накапливать биомассу с выходом до 86% от субстрата.
В промышленном производстве биопротеина на природном газе наибольшую значимость как продуцент белка имеет облигатный метилотроф Methylococcus capsulatus, который в отличие от других бактериальных культур с высокой скоростью накапливает биомассу при повышенной температуре (42°С) и пониженной величине рН среды (5,5–5,7). Специфика субстрата и условий культивирования продуцента белка позволяют осуществлять ферментационный процесс в нестерильных условиях. Переработка газообразного субстрата с очень низкой растворимостью в воде (0,02 г/дм3) обусловила применение ферментаторов специальной конструкции, предусматривающей размещение в одном аппарате различных систем диспергирования газовой и жидкой фаз: барботаж газов (метан и технический кислород) в жидкости через диспергирующие контактные тарелки; эжекция газов в жидкость под давлением, создаваемым циркуляционными насосами; эжекция газов в жидкость по принципу «падающей струи». Производительность ферментатора типа ФКЭР (ферментатор колонный эжекционный с рециркуляцией газовой и жидкой фаз) объемом 750 м3 достигает 120 т/сут по товарному продукту.
Серьезный недостаток метана – образование взрывоопасных смесей с воздухом (или техническим кислородом). Предел взрываемости смеси метана с техническим кислородом широкий и составляет 6–60% об. Снижает взрывоопасность ферментационного процесса присутствие в газовой фазе метаболита – диоксида углерода, содержание которого достигает 30% об. и более. В производственных условиях безопасность ферментации обеспечивается автоматическим регулированием содержания кислорода в отработанном газе (на выходе из ферментатора) на уровне не более 9% об.
Сухая бактериальная биомасса (торговое название гаприн) имеет высокое содержание истинного белка (50–55%). Из-за сильного аллергического действия гаприн производят не в порошкообразном, а только в гранулированном виде.
Метанол. Производство белка одноклеточных на спиртах (метаноле, этаноле) очень перспективно. К преимуществам этих субстратов относятся высокая чистота, отсутствие канцерогенных примесей, хорошая растворимость в воде, высокая летучесть, исключающая накопление субстрата в готовом продукте. Присутствие в молекулах спиртов атома кислорода уменьшает потребность в нем и, соответственно, тепловыделения при ферментации (по сравнению с н-парафинами и метаном), что в целом снижает затраты на производство продукта. Однако необходимо учитывать высокую токсичность метанола для обслуживающего персонала, существующую вероятность образования взрывоопасных смесей паров метанола с воздухом, а также возможные потери спирта при ферментации из-за его высокой летучести.
В качестве продуцентов белка на средах с метанолом могут быть использованы как дрожжи, так и бактерии. Из дрожжевых культур рекомендованы Candida boidinii, Hansenula polimorpha, которые в оптимальных условиях развития (температура 34–36°С, рН 4,2–4,5) накапливают биомассу с выходом 30–33% от ассимилированного субстрата при скорости протока 0,12–0,16 ч-1. Дрожжи не требуют асептических условий культивирования (в этом их преимущество), но сильно уступают бактериальным штаммам по скорости роста и выходу биомассы.
Бактериальные культуры Pseudomonas methylotropha, Pseudomonas clara развиваются при температуре 32–34°С, рН 6,0–6,4 и ассимилируют метанол с выходом биомассы 70% при скорости протока 0,2–0,3 ч-1. Большие затраты на поддержание асептики при культивировании бактерий нивелируют их явные преимущества перед дрожжами.
Хорошая растворимость метанола в воде обусловливает возможность применения ферментаторов эрлифтного типа. При концентрации в среде выше 15 г/дм3 метанол вызывает гибель клеток.
Этанол. Как субстрат имеет те же достоинства и недостатки, что и метанол. Отличается меньшей токсичностью и легкостью ассимиляции широким кругом микроорганизмов. Последнее обстоятельство серьезно затрудняет культивирование дрожжевых продуцентов белка в нестерильных условиях из-за развития посторонних микроорганизмов («диких» культур дрожжей). Для промышленного производства микробной биомассы на этаноле рекомендуется использовать дрожжи Candida utilis или Hansenula anomala, выращивать их с соблюдением условий асептики в ферментаторах с высокими массообменными характеристиками при аэрации техническим кислородом или обогащенным кислородом воздухом. Выход сухой дрожжевой массы от ассимилированного этанола (экономический коэффициент) составляет около 70%. При концентрации в среде более 30 г/дм3 проявляется стерилизующее действие этанола. Зарубежные специалисты считают, что этанол наиболее пригоден как субстрат для культивирования дрожжей с целью получения белковых концентратов или изолятов пищевого назначения.
Биоконверсия целлюлозолигниновых (ЦЛ) материалов. Теоретически представляет интерес получение белоксодержащих кормовых препаратов прямым твердофазным культивированием микроорганизмов, обладающих целлюлолитический и лигнолитической активностью, на целлюлозо-лигниновых материалах. Однако при синтезе белка на нерастворимых ЦЛ-субстратах возникает ряд проблем. Практически в природе не существуют микроорганизмы, способные осуществить этот процесс с высокой скоростью и экономичностью. Наиболее перспективными продуцентами белка на ЦЛ-материалах являются мицелиальные грибы (Trichoderma viride, Trichoderma lignorum, Chaetomium cellulolyticum). При глубинном культивировании грибов на пшеничной соломе, подвергнутой термощелочной обработке, количество белка составляет 15–19% от сухого вещества через 60–72 ч ферментации. Эффективность конверсии полисахаридов в белок возрастает при использовании ассоциаций культур. Например, при культивировании ассоциации Trichoderma viride + Endomycopsis fibuligera методом твердофазной ферментации на термообработанной соломе содержание белка достигает 12%.
Резистентность природных ЦЛ-материалов к действию различных гидролизующих агентов определяется двумя факторами: кристалличностью природной целлюлозы и защитной матрицей, образованной лигнином, в которую погружены целлюлозные фибриллы.
По данным исследователей, целлюлолитические микроорганизмы способны утилизировать ЦЛ-субстраты, если содержание лигнина в них не превышает 18–20%. То же относится и к действию анаэробных бактерий в желудке жвачных животных, которые утилизируют целлюлозу только при низком содержании лигнина в корме. Увеличение доступности субстрата может быть достигнуто механическим помолом и делигнификацией субстрата. Биодеградация лигнина протекает медленно и существенно отдичается от деградации других биополимеров. Этот процесс еще недостаточно изучен.
Послеспиртовая барда. Производство этанола из углеводсодержащего сырья сопровождается образованием крупнотоннажного отхода – послеспиртовой барды, количество которой во много раз превосходит выход продукта и достигает 135–150 м3 на 1000 дал (декалитров абсолютного (безводного)) этанола. Основным сырьем для производства высококачественного этанола является зерно злаков (пшеница, рожь, тритикале). При масштабах производства этанола в Республике Беларусь 11,4 млн. дал в год общий объем послеспиртовой барды составляет 1,5 млн. м3.
В настоящее время на предприятиях отрасли барда является обременительным отходом, создающим угрозу экологической обстановке вокруг предприятия.
Зерновая послеспиртовая барда содержит 6–8% сухих веществ, которые включают 26–28% сырого протеина, 13–14% клетчатки, 6,0–7,5% жира, 40–50% безазотистых экстрактивных веществ, 7,6–7,8% минеральных веществ. Около 50% сухих веществ находятся в барде в растворенном состоянии, а вторая половина – в виде взвешенных веществ (дробина). В барде присутствуют мертвые клетки дрожжей-продуцентов этанола (источник протеина), органические кислоты, аминокислоты, витамины, микро- и макроэлементы. Наличие протеина и биологически активных веществ придает барде самостоятельную кормовую ценность, в связи с чем основным методом утилизации послеспиртовой барды в отечественной практике является реализация натуральной барды в качестве кормовой добавки. Однако барда не подлежит длительному хранению (развиваются гнилостные процессы), имеет место сезонность спроса на барду, существенны затраты на доставку ее потребителю. Кроме того, перевариваемость сырого протеина барды низкая и составляет около 52%. Этот показатель может быть увеличен до 85–89% обогащением барды белком в результате аэробного культивирования на барде микроорганизмов. При этом резко возрастает кормовая ценность барды, появляется возможность получения полноценной кормовой белково-витаминной добавки. Этот метод микробиологической переработки барды применяется на ряде спиртовых заводов Российской Федерации, а также на Бобруйском заводе биотехнологий.
Несмотря на то, что накоплен достаточно большой мировой опыт переработки барды, главным препятствием для реализации имеющихся технологий являются большие энергетические затраты на производство сухих продуктов в связи с высокой влажностью барды.
В качестве продуцентов белка на зерновой послеспиртовой барде используют дрожжеподобные грибы родов Candida, Crypticoccus, Rhodotorula, Trichosporon. Наиболее пригоден штамм Trichosporon cutaneum BKR Y-495, который характеризуется способностью к гидролитическому расщеплению углеводных компонентов зерновой барды и высокой степенью ассимиляции углеводов и органических кислот. Этот штамм устойчив при непрерывном культивировании без соблюдения условий асептики (рН 4,0–4,5), продуктивность его по биомассе достигает 2,2 г/(дм3∙ч).
Накопление посевного материала Trichosporon cutaneum производят в лабораторном ферментаторе и в дрожжерастильных аппаратах отделения чистой культуры (инокулятор, дрожжанка) с применением разбавленной в 2 раза водой и обогащенной питательными солями зерновой барды при температуре 33–35°С.
Технология производства кормовой белково-витаминной добавки на зерновой послеспиртовой барде предусматривает выращивание продуцентов белка на натуральной барде (рис. 7.2) или после предварительного отделения дробины (частиц оболочек зерна).
Горячая зерновая барда поступает из брагоректификационного отделения с температурой 95–98°С в приемник-стерилизатор 1, в котором выдерживается в течение 30–40 мин для более полного уничтожения микробиоты. Приемник оборудован перемешивающим устройством, предотвращающим осаждение мертвых дрожжей-продуцентов этанола и взвешенных веществ барды.
После выдержки горячая зерновая барда охлаждается в кожухотрубчатом теплообменнике 2 до температуры 60–65°С и поступает в сборник-смеситель 4, в котором смешивается с раствором питательных солей. Для обеспечения роста продуцента белка зерновая барда обогащается азотом (1,5 г/дм3 NH4H2PO4) и калием (0,3 г/дм3 KCl).
В сборнике-смесителе барда при необходимости разбавляется водой. Разбавление зерновой барды повышает удельную скорость роста культуры, уменьшает пенообразование, однако одновременно увеличивает объем жидкостного потока подлежащей концентрированию дрожжевой суспензии.
Доохлаждение питательной среды до температуры ферментации (33–35°С) производится в кожухотрубчатом теплообменнике 7.
Дрожжи выращивают в ферментаторе эрлифтного типа 9 с децентрализованной системой воздухораспределения. Расход воздуха составляет 50–60 м3/(м3∙ч). В процессе культивирования дрожжей на зерновой барде рН среды повышается за счет потребления органических кислот. Требуемую величину рН (4,0–4,4) поддерживают подачей серной кислоты в трубчатый смеситель 8.
Продуктивность культуры Trichosporon cutaneum BKR Y-495 по биомассе на зерновой барде составляет 1,8–2,0 г/(дм3∙ч). Концентрация абсолютно сухой биомассы в дрожжевой суспензии 8–12 г/дм3.
Значительное количество поверхностно-активных веществ (белков, аминокислот) придает суспензии способность к интенсивному пенообразованию, поэтому она поступает в деэмульгатор 10, в котором осуществляется отделение и гашение пены с использованием механического и химического пеногасителей.


Рис. 7.2. Технологическая схема производства белково-витаминной добавки на натуральной зерновой послеспиртовой барде:
1 – приемник-стеризизатор барды; 2 – поверхностный конденсатор; 3 – теплообменник; 4 – сборник питательной среды;
5 – вибросито; 6 – мерник раствора солей; 7 – трубчатый смеситель; 8 – ферментатор; 9 – деэмульгатор; 10 – дегазатор;
11 – сборник дрожжевой суспензии; 12 – сепаратор; 13 – сборник отработанной культуральной жидкости;
14 – плазмолизатор; 15 – фильтр сетчатый; 16 – сушилка распылительная; 17 – основная группа циклонов;
18 – продуктовый циклон; 19 – вентилятор; 20 – бункер белково-витаминной добавки
Наличие в барде твердых включений в виде дробины затрудняет сепарационное концентрирование дрожжевой суспензии. В связи с этим дробина отделяется на вибросите с отверстиями размером 0,22–0,25 мм. Освобождение барды от дробины до осуществления стадии выращивания дрожжей считают менее целесообразным по причине значительных потерь субстрата с отделяемой фракцией. Сход с вибросита (дробина) смешивается с дрожжевым концентратом, поступающим на термолиз. Выход фильтрата составляет 75–85% от дрожжевой суспензии.
Дрожжевую суспензию концентрируют сепарацией в две ступени. При этом сепараторы второй ступени работают по методу круговой сепарации со сгущением суспензии до 300–400 г/дм3 по биомассе 75%-ной влажности. Термолиз дрожжевого концентрата производят в течение 45 мин при 85–90°С в плазмолизаторе 18, обогреваемом глухим или острым паром. Сушку термолизованного дрожжевого концентрата в смеси с дробиной осуществляют в распылительной сушилке с дисковым распылителем 19. Следует отметить, что присутствие дробины способствует накоплению отложений на внутренних поверхностях сушилки.
Для обеспечения охраны окружающей среды технологической схемой предусматривается оснащение приемника-стерилизатора барды и сборника-плазмолизатора обратными холодильниками. Газовые выбросы из ферментаторов, от сепараторов и сборников дрожжевой суспензии, а также отработанный теплоноситель из сушилки очищают в установках «мокрой» очистки газов.
Жидкий отход производства белково-витаминной добавки – отработанная культуральная жидкость со станции сепарации – частично может быть использован для приготовления питательной среды в основном производстве или направляется для очистки на локальные очистные сооружения предприятия.
Молочная сыворотка. Является крупнотоннажным отходом молокоперерабатывающих производств. Годовой объем молочной сыворотки по Республике Беларусь составляет около 1 млн. т. До настоящего времени не решена проблема полной переработки сыворотки с получением ценных продуктов, что негативно сказывается на экологической обстановке. По химическому составу (табл. 7.2) молочная сыворотка представляет собой полноценную питательную среду для культивирования микроорганизмов – продуцентов белка.
Таблица 7.2
Химический состав молочной сыворотки, %
| Вид сыворотки | Сухие вещества | Белок | Жиры | Лактоза | Минеральные вещества |
| Подсырная | 6,2-6,5 | 0,4-1,0 | 0,05-0,4 | 4,5-4,8 | 0,5-0,7 |
| Творожная | 6,0-6,5 | 0,5-1,0 | 0,2-0,3 | 4,0-4,7 | 0,6-0,7 |
Кроме основного субстрата –лактозы сыворотка содержит органические кислоты, моносахариды, витамины. В качестве продуцентов белка на молочной сыворотке используют дрожжеподобные грибы Trichosporon cutaneum, Candida utilis, Candida humicola. Подготовка сыворотки к микробиологической переработке заключается в денатурации белков термообработкой (85°С, 10–15 мин) с последующим отделением осадка (фильтрованием, центрифугированием).
Дрожжеподобные грибы ассимилируют прежде всего органические кислоты (молочную, уксусную), а затем лактозу, которая является трудноассимилируемым сахаром. При переработке натуральной сыворотки дрожжевая биомасса отличается низким содержанием белка (около 20%). Внесение в сыворотку источников азота в виде мочевины или сульфата аммония в количестве до 1% незначительно увеличивает выход биомассы (примерно на 10%), но резко повышает (в 2–2,5 раза) содержание белка в продукте.
Микробиологическую переработку молочной сыворотки ограничивает рассредоточенность сырья, не позволяющая организовать крупномасштабное промышленное производство кормового продукта.
Дата добавления: 2015-04-16; просмотров: 1354; Мы поможем в написании вашей работы!; Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Положения концепции Бен-Нахмана | | | ШымКЕНТ, 2008 |