
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 4. при гидролизе смесью ЕсоRIи ВатHIв отличие от ЕсоRI-фрагментов размером 850 и 500 п
при гидролизе смесью ЕсоRIи ВатHIв отличие от ЕсоRI-фрагментов размером 850 и 500 п. н. Значит, два EcoRI-сайта находятся на расстоянии 300 п. н. друг от друга и между ними нет ВатHI-сайта, а в ЕсоRI-фрагментах длиной 850 и 500 п.н. есть по одному ВатHI-сайту. Фрагмент размером 950 п. н., который образуется при обработке ДНК рестриктазой ВатHI, при двойном гидролизе расщепляется EcoRI на три фрагмента (250+3004400 - 950 п.н.). Значит, два ВатHI-сайта находятся на расстоянии 250 и 400 п. н. по разные стороны от сайтов для EcoRI. ВатHIрасщепляет EcoRI-фрагмент длиной 850 п. н. на фрагменты длиной 250 и 600 п, н., а один из сайтов для EcoRl находится на расстоянии 250 п. н. от сайта для ВатHI, значит, фрагмент 600 п. н.
| ДОПОЛНЕНИЕ 4.1 | ||
| Гель-электрофорез Для разделения белков и нуклеиновых кислот широко применяется метод гель-электрофореза. Его принцип заключается в следующем. Исследуемый препарат (раствор белка, ДНК или РНК) вносят в лунку, расположенную у края геля - полужидкой среды с сетчатой пространственной структурой (обычно для электрофореза используют тонкие пластины геля). Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают электрический ток, они перемещаются в электрическом поле. Молекулы одинакового размера (и одинакового заряда) движутся единым фронтом, образуя в геле дискретные невидимые полосы. Чем меньше размер молекул, тем быстрее они движутся. Постепенно исходный препарат, состоящий из разных макромолекул, разделяется на зоны, распределенные по длине пластинки. За ходом электрофореза следят по перемещению в геле красителя -заряженного низкомолекулярного вещества, которое вносят в каждую лунку перед началом электрофореза. Когда краситель достигает конца пластины, электрофорез останавливают, а гель окрашивают красителем, прочно связывающимся с белками или нуклеиновыми кислотами. Если образец представляет собой дискретный набор макромолекул разного размера, то после электрофореза получается набор четких полос, рас- | положенных одна под другой. Если же распределение молекул по размеру более или менее непрерывно, то получается смазанная картина. По интенсивности окраски полос можно судить о концентрации макромолекул в образце. Чтобы определить относительную молекулярную массу разделенных фрагментов, одновременно проводят электрофорез маркерных макромолекул с известными молекулярными массами. Набор маркеров должен охватывать весь диапазон молекулярных масс в данной системе. Образец маркерных молекул вносят в отдельную лунку, расположенную вблизи одного из краев пластинки (или в две лунки у двух разных краев). Логарифм относительной молекулярной массы маркера линейно связан с его электрофоретической подвижностью Rf — величиной, равной отношению расстояний, пройденных маркерной молекулой и красителем (фронтом растворителя). Построив график зависимости логарифма относительных молекулярных масс маркеров от Rf, можно найти относительную молекулярную массу каждого компонента образца. Относительная мол. масса белков измеряется в дальтонах, двухцепочечных нуклеиновых кислот - в числе пар нуклеотидов, одноцепочечных — в числе нуклеотидов. Для разделения белков обычно используют полиакриламидный гель (ПААГ), Он образуется при сополимеризации акрилами- | да и бисакриламида, использующегося в качестве сшивки линейных полимеров акриламида. Размер ячеек в полиакриламидной «сетке» зависит от концентрации акриламида и соотношения между количеством акриламида и бисакриламида. Белок перед электрофорезом часто обрабатывают анионным детергентом додецилсульфатом натрия (ДСН), что позволяет проводить фракционирование в зависимости только от одного параметра — молекулярной массы, а зависимость от конформации, плотности упаковки полипептидной цепи и др. исключается. Электрофорез в ПААГ-ДСН позволяет разделять белки с мол. массой от 20 до 200 кДа. Для электрофоретического разделения нуклеиновых кислот среднего размера обычно применяют агарозные гели. Агароза -это особо чистая фракция, получаемая из агара или непосредственно из агарообразующих морских водорослей. В 1,0% агарозном геле можно разделять молекулы ДНК размером от 600 до 20 000 п. н. Для фракционирования более крупных молекул ДНК (миллионы пар оснований), денатурированной ДНК и РНК приходится использовать специальные системы электрофореза. Иногда для решения специальных задач для разделения ДНК применяют поли акриламидные гели. Так, в 20% полиакриламидном геле можно разделить фрагменты ДНК, состоящие всего из шести оснований и различающиеся лишь одним нуклеотидом. |
Технология рекомбинантных ДНК 55
| Рис. 4.4. Картирование сайтов рестрикции. А. Результаты гель-электрофореза фрагментов ДНК, полученных ее расщеплением указанными ферментами. Очищенную ДНК гидролизовали рестриктазами EcoRIи BamHIраздельно, а затем их смесью, проводили гель-электрофорез и визуализировали продукты окрашиванием бромистым этидием. Числа слева от горизонтальных полос -длина фрагментов в парах оснований. Б. Рестрикционная карта, построенная по электрофоретическим данным. Числа — расстояние между сайтами узнавания соответствующих ферментов. | 
|
должен содержать один из концов исходной молекулы ДНК. Далее, мы видим, что ВатHIрасщепляет ЕсоRI-фрагмент длиной 500 п. н. на два фрагмента размером 100 и 400 п. н. и что один из EcoRI-сайтов отделен от BamHI-caйтa 400 п. н.; значит, фрагмент длиной 100 п. н, должен содержать другой конец исходной молекулы. Карта на рис. 4.4,Б иллюстрирует четкое соответствие между положением сайтов рестрикции и размерами фрагментов, получающихся при каждом гидролизе.
Расщепление рестрицирующими эндонуклеазами имеет еще одно применение. Когда два разных образца ДНК обрабатывают одной и той же рестриктазой с образованием фрагментов с липкими концами, а затем смешивают эти образцы, то благодаря комплементарному спариванию липких концов фрагментов разных образцов могут образовываться новые комбинации генов -рекомбинантные ДНК (рис, 4.5).
Для осуществления молекулярного клонирования недостаточно одних только ферментов рестрикции. Во-первых, водородные связи между теми четырьмя основаниями, которые образуют липкие концы, недостаточно прочны, чтобы удержать два объединившихся фрагмента ДНК, Необходим какой-то инструмент для устранения разрыва в сахарофосфатном остове молекyлы, т. е. для восстановления связи между 3'-гидроксильной концевой группой одной цепи и 5'-фосфатной группой другой. Таким инструментом является ДНК-лигаза бактериофага Т4. Этот фермент катализирует образование фосфодиэфирных связей между концами полинуклеотидных цепей, которые уже удерживаются вместе благодаря спариванию липких концов. Кроме того, ДНК-лигаза Т4 «сшивает» тупые концы, которые сближаются друг с другом после того, как объединяемые фрагменты связываются с ферментом (рис. 4,6). Во-вторых, объеди-
56 ГЛАВА 4

|
| Рис. 4.5, Отжиг комплементарных липких концов фрагментов, образующихся при расщеплении двух разных образцов ДНК рестрицирующей эндонуклеазой BатHI. Четыре фрагмента, представленных на рисунке, могут соединиться друг с другом с образованием шести разных молекул ДНК (на рисунке показаны не все возможные комбинации). Фрагменты удерживаются вместе водородными связями, образующимися между четырьмя основаниями липких концов, но эти связи недостаточно прочны, чтобы молекулы в растворе оставались стабильными длительное время. |
нение разных молекул ДНК само по себе бесполезно, если вновь образованные комбинации (рекомбинантные ДНК) не будут реплицироваться в клетке-хозяине. Таким образом, если одна часть рекомбинантной молекулы ДНК несет нужный ген, который предполагается клонировать, то другая должна содержать информацию, необходимую для репликации в клетке рекомбинантной ДНК. Чтобы решить эту проблему, используют клонирующие векторы. В-третьих, при рестрикции ДНК образуется смесь разнообразных фрагментов, и после их лигирования с векторной ДНК образуется множество различных комбинаций. Необходимо уметь распознавать те реципиентные клетки, которые содержат ДНК с нужной нуклеотидной последовательностью. Для этого используют различные системы скрининга.
Плазмидные векторы
Плазмиды -- это внехромосомные автономно реплицирующиеся цвухцепочечные кольцевые молекулы ДНК. Плазмиды есть практически у
Технология рекомбинантных ДНК 57
| Рис. 4.6. ДНК-лигаза Т4 образует фосфодиэфирные связи между 5'-фосфатными и 3'-гидроксилъными группами в месте разрыва в остове двухцепочечнои ДНК. А. Лигирование липких концов, Б. Нитрование тупых концов. | 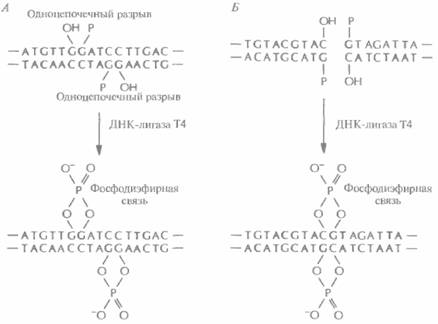
|
всех бактерий. Одни из них содержат информацию, обеспечивающую их собственный перенос из одной клетки в другую (F-плазмиды), другие несут гены устойчивости к антибиотикам (R-плазмиды) или специфические наборы генов, ответственных за утилизацию необычных метаболитов (плазмиды деградации). Есть плазмиды, в которых не обнаружены гены, выполняющие какие-то определенные функции (критические плазмиды; от англ, cryptic — скрытый, латентный). Размеры плазмид варьируют от менее 1 до более 500 т.п.н. Каждая из них содержит сайт начала репликации (ori), без которого репликация плазмиды в клетке-хозяине была бы невозможна.
Некоторые плазмиды представлены в клетке 10—100 копиями; они называются высококопийными. Низкокопийные плазмиды присутствуют в клетке в числе 1—4 копий. На долю плазмидной ДНК обычно приходится 0,1—5,0% суммарной клеточной ДНК. Если две или более плазмиды не могут сосуществовать в одной и той же клетке, то говорят, что они принадлежат к одной группе несовместимости. Плазмиды, относящиеся к разным группам несовместимости, беспрепятственно существуют в одной клетке, независимо от числа копий. У некоторых микроорганизмов в одной клетке было обнаружено до 8—10 разных плазмид, при этом каждая из них выполняла свои функции, была представлена характерным для нее числом копий и относилась к своей собственной группе несовместимости. Одни плазмиды несут специфичный сайт инициации репликации и могут реплицироваться только в клетках одного вида. У других плазмид этот сайт менее специфичен, и они реплицируются в самых разных бактериальных клетках. Соответственно различают плазмиды с узким и с широким спектром хозяев.
Как автономно реплицирующиеся генетические элементы плазмиды обладают всеми основными свойствами, которые позволяют использовать их в качестве вектора для переноса клонируемой ДНК. Но довольно часто природные (немодифицированные, несконструированные) плазмиды бывают лишены некоторых обязательных для «высококачественного" вектора свойств. К таким важным свойствам относятся: 1 ) небольшой размер, поскольку эффективность переноса экзогенной ДНК в Е. coli значительно снижается при длине плазмиды более 15 т. п. н.; 2) наличие уникального сайта рестрикции, в который может быть осуществлена вставка; 3) наличие одного или более селективных генетиче-
58 ГЛАВА 4
ских маркеров для идентификации реципиентных клеток, несущих рекомбинантную ДНК. Поэтому плазмидные векторы приходится создавать с помощью генной инженерии.
Плазмидный вектор pBR322
В 80-е годы плазмидный вектор pBR322 был одним из самых популярных универсальных векторов. Обычно обозначение плазмидного вектора включает строчную букву p (от англ, plasmid) и еще несколько букв, имеющих отношение к описанию вектора или к истории его создания. Так, буквы BR в обозначении плазмиды pBR322 указывают на авторство Ф. Боливара и Р. Родригеса, сконструировавших эту плазмиду, а число 322 — цифровое обозначение, взятое из их исследовательских протоколов. Длина плазмиды pBR322 — 4361 п. н. Она несет два гена устойчивости к антибиотикам (рис. 4.7), ампициллину (Ampr) и тетрациклину (Tetr), a также уникальные сайты для BamHI, HindIIIи SalIв генеТеtr, один PstI-сайт в гене Аmрr, один сайт для EcoRI, находящийся за пределами кодирующих последовательностей, и сигнал начала репликации, обеспечивающий репликацию исключительно в E. coli. Плазмида реплицируется с образованием большого числа копий, в другие бактериальные клетки переносится с трудом.
Как работает клонирующий вектор pBR322? Если очищенную кольцевую плазмиду pBR322

|
| Рис. 4.7. Генетическая карта плазмидного вектора pBR322. Гены устойчивости к тетрациклину (Tetr) и ампициллину (Аmрr) содержат уникальные сайты узнавания для HindIII, SalI, BamHI и PstI. EcoRI-сайт расположен вне этих генов. Длина вектора — 4361 п. н. |
обработать рестриктазой, расщепляющей ее в единственном сайте, расположенном в одном из генов устойчивости к тому или другому антибиотику, то образуется линейная молекула с липкими концами. Такие молекулы смешивают с донорной ДНК, содержащей нужный ген и предварительно обработанной такой же рестриктазой. Поскольку липкие концы этих двух ДНК взаимно комплементарны, они спариваются с образованием гибридных молекул. Далее смесь обрабатывают ДНК-лигазой фага Т4 в присутствии АТР, в результате чего образуется множество разных комбинаций фрагментов, а также нежелательные продукты, в частности объединившиеся между собой фрагменты до-норной ДНК и исходные плазмидные ДНК, Чтобы уменьшить количество последних, обрабатывают рестрицированную плазмидную ДНК щелочной фосфатазой, отщепляющей от линеаризованной молекулы 5'-фосфатные группы: ДНК-лигаза не может сшить концы дефосфорилированной линейной плазмидной ДНК (рис. 4.8). Что касается собственно рекомби-нантных молекул ДНК, то хотя в них и имеются два одноцепочечных разрыва, ее фрагменты удерживаются вместе двумя фосфодиэфирными связями, образовавшимися с помощью ДНК-лигазы между дефосфорилированной плазмидной ДНК и рестрицированной донорной ДНК (рис. 4,8). После репликации в трансформированной клетке одноцепочечные разрывы устраняются системой лигирования клетки-хозяина.
Трансформация и отбор
Теперь необходимо ввести рекомбинантную ДНК в клетку-хозяина. Этот процесс называется трансформацией. Для его осуществления используют специально разработанные приемы, например подвергают клетки высокотемпературному воздействию и обрабатывают их хлористым кальцием (СаС12), Однако эффективность трансформации все же остается невысокой, обычно трансформируется не более одной клетки из тысячи. Таким образом, большинство клеток после проведения трансформации не содержат рекомбинантной ДНК. В некоторых из них появляется воссоединившаяся кольцевая плазмидная ДНК, избежавшая дефосфорилирования щелочной фосфатазой, в других — неплаз-
Технология рекомбинантных ДНК 59

|
| Рис. 4.8. Встраивание чужеродной ДНК в плазмидный вектор. Плазмидную ДНК, обработанную рестриктазой и щелочной фосфатазой, смешивают с рестрицированной донорной ДНК, содержащей нужный ген, и добавляют ДНК-лигазу. Два из четырех одно цепочечных разрыва при этом устраняются, и конструкция оказывается стабильной благодаря образовавшимся фосфодиэфирным связям. После введения гибридной ДНК в клетку-хозяина происходит ее репликация и образуются новые кольцевые молекулы уже без разрывов. |
мидная ДНК и лишь в некоторых — плазмида со встроенным фрагментом чужеродной ДНК (гибридная плазмида).
Как мы уже говорили, внехромосомная ДНК, не содержащая точки начала репликации, не может реплицироваться в бактериальной клетке. Таким образом, проникновение в клетку экзогенной ДНК, еще не означает, что она будет поддерживаться в хозяйской клетке. Далее, для сохранения рекомбинантной ДНК в клетке-хо-
60 ГЛАВА 4
зяине в первоначальном виде необходимо, чтобы в клетке отсутствовали гены, кодирующие синтез рестриктаз, которые могут привести к ее деградации, и чтобы клетка имела фенотип RecA– (такие клетки неспособны к общей рекомбинации, так что экзогенная ДНК не будет модифицироваться в результате гомологичной рекомбинации).
Затем необходимо идентифицировать клетки, содержащие рекомбинантную ДНК. Способ идентификации должен быть как можно более простым, поскольку приходится проверять огромное число клеток. В системе pBR322, в которой чужеродная ДНК встраивается в сайт ВаmHI, специфическая идентификация состоит из двух этапов. Сначала клетки после трансформации высевают на питательную среду, содержащую ампициллин. В таких условиях могут вырасти только те клетки, в которых присутствует интактный ген Аmрr — или в составе интактной плазмиды pBR322, или в составе гибридной плазмиды; нетрансформированные клетки чувствительны к ампициллину. Сайт BamHI расположен в гене Tetr плазмиды pBR322 (рис. 4.7); встраивание в этот ген фрагмента ДНК прерывает кодирующую последовательность, и устойчивость к тетрациклину утрачивается. Таким образом, клетки, несущие гибридную плазмиду, устойчивы к ампициллину, но чувствительны к тетрациклину, а клетки, получившие интактную плазмиду pBR322, несут ген Tetr и устойчивы как к ампициллину, так и к тетрациклину.
На втором этапе проводят разделение этих двух вариантов. Клетки, выросшие на среде с ампициллином, переносят на среду с тетрациклином методом перепечатки. Клетки, образующие колонии на чашках с тетрациклином, содержат интактную плазмиду pBR322, поскольку, как мы уже говорили, они устойчивы и к ампициллину, и к тетрациклину. Клетки, не выросшие на чашках с тетрациклином, чувствительны к этому антибиотику, значит, они содержат гибридную плазмиду pBR322.
Среди колоний, выросших на среде с ампициллином, выделяют те, которые оказались чувствительны к тетрациклину, и из каждой колонии получают индивидуальные клеточные клоны или (чаще делают именно так) объединяют все колонии, устойчивые к ампициллину и чувствительные к тетрациклину, и культивируют их вместе. Далее можно провести дополнительный скрининг и идентифицировать те клетки, которые несут гибридную плазмиду pBR322 со специфической вставкой. Присутствие сайтов HindIII и SalI в гене Tetr и сайта PstI в гене Аmрr плазмиды pBR322 позволяет изменить локализацию клонированных фрагментов чужеродной ДНК. Если для встраивания используется сайт PstI, то отбор проводится по той же схеме, но в другом порядке, т. е. сначала высевают клетки на среду с тетрациклином, а затем — с ампициллином.
Другие плазмидные векторы
Идея использовать pBR322 как вектор для клонирования была вполне удачной, но эта плазмида содержит лишь несколько сайтов рестрикции, а отбор трансформированных клеток занимает много времени. Это привело к необходимости разработки альтернативных систем клонирования. Например, плазмида pUC19 длиной 2686 п. н. содержит: ген устойчивости к ампициллину; регулируемый сегмент гена β-галактозидазы (lacZ') лактозного оперона E. coli, ген lacI, кодирующий репрессор, который контролирует экспрессию гена lacZ'; полилинкер — короткую последовательность с множеством уникальных сайтов узнавания для эндонуклеаз (EcoRI, SacI, КрпI, ХтаI, SmaI, BamHI, XbaI, SalI, HinсII, AccI, BspMI, PstI, SphI и HindIII); точку начала репликации плазмиды pBR322 (рис. 4.9).

|
| Рис. 4.9. Генетическая карта плазмидного вектора pUC19. Плазмида состоит из 2686 пар нуклеотидов и содержит уникальные сайты узнавания для ЕсоRI, SacI, KpnI, XmaI, SmaI, BamHI, XbaI, SalI, HincII, АсcI, PsiI, BspMI, SphI и HindIII, локализованные в полилинкере; ген устойчивости к ампициллину; сайт инициации репликации, функционирующий в Е. coli; ген lacI, контролирующий синтез репрессора, который блокирует транскрипцию гена lacZ' в отсутствие индуктора ИПТГ. |
Технология рекомбинантных ДНК 61

|
| При расщеплении ДНК рестриктазой RT образуются фрагменты с липкими концами |
| J.E. Mertz, R. W. Davis Proc. Natl. Acad. Sci. USA 69: 3370-3374, 1972 |
| Технология рекомбинантных ДНК включает создание вектора — «переносчика» клонируемой ДНК, специфическое встраивание в него этой ДНК с образованием химерной конструкции, введение конструкции в клетку-хозяина и идентификацию клеток, несущих рекомбинантную ДНК. Незаменимым рабочим инструментом в этих манипуляциях являются рестрицирующие эндонуклеазы типа 11. Их применяют как при создании векторов (см., например, Bolivar et al., Gene 2: 95—113, 1977), так и при встраивании в них нужных генов, В 1968 г, М. Мезелсон и др. (Nature 217: 1110— 1114) показали, что способность одного из штаммов E. coli сдерживать размножение инфи- | цирующего его вируса (бактериофага) обусловливается наличием в клетке фермента, который расщепляет фаговую ДНК. Позже Мерц и Дэвис установили, что этот фермент, рестриктаза RI (получившая название EcoRI), расщепляет молекулу ДНК в специфическом сайте с образованием комплементарных («липких») концов. Линейные молекулы, образовавшиеся при расщеплении кольцевой ДНК рестриктазой EcoRI, часто вновь замыкаются в кольцо благодаря спариванию комплементарных концов. Объединившиеся фрагменты удерживаются вместе водородными связями; их концы можно ковалентно сшить, добавив фермент ДНК- | лигазу, в результате чего получится кольцевая, ковалентно замкнутая молекула. У всех молекул ДНК, расщепленных одной эндонуклеазой, имеются одинаковые концы из 4—6 нуклеотидов, а сайт узнавания состоит из шести нуклеотидных пар. Мерц и Дэвис сделали вывод, что «...последовательно используя два фермента — рестриктазу RI и ДНК-лигазу, можно «перекомбинировать» любые две молекулы ДНК с RI-сайтами и получить гибридную молекулу». Это открытие стало ключевым в развитии технологии рекомбинантных ДНК, поскольку, по словам этих же ученых, указало «простой путь ...создания специфических рекомбинантных молекул ДНК in vitro». |
При отборе трансформированных клеток руководствуются следующими соображениями. Если клетки, содержащие немодифицированную плазмиду pUC19, выращивать в присутствии изопропил-β-D-тиогалактопиранозида (ИПТГ), который является индуктором lac-оперона, то продукт гена lad не сможет связаться с промоторно-операторной областью гена lacZ', и как следствие будут происходить транскрипция и трансляция плазмидного фрагмента гена lacZ'. Продукт этого фрагмента свяжется с белком, кодируемым хромосомной ДНК, и в результате образуется активная ß-галактозидаза. Последовательность с множеством сайтов рестрикции (полилинкер) встроена в ген lacZ' так, что она не влияет на продукцию функциональной β-галактозидазы, и если в среде присутствует ее субстрат 5-бром-4-хлор-3-индолил-β-D-галактопиранозид (X-Gal), то он будет гидролизоваться под действием этого фермента с образованием продукта синего цвета, окрашивающего колонии клеток, содержащих немодифицированную плазмиду pUC19.
Для клонирования в pUC19 донорную ДНК расщепляют одной из рестриктаз, чей сайт находится в полилинкере; плазмидную ДНК гидролизуют такой же рестриктазой, а затем обрабатывают щелочной фосфатазой. Обе ДНК смешивают в присутствии ДНК-лигазы Т4 и используют образовавшийся продукт для трансформации клеток, которые могут синтезировать ту часть ß-галактозидазы (LacZα), которая соединяется с продуктом гена lacZ' с образованием активного фермента. Обработанные клетки высевают на питательную среду с ампициллином, ИПТГ и субстратом для ß-галактозидазы. Нетрансформированные клетки не могут расти в присутствии ампициллина, а клетки, несущие интактную плазмиду, образуют на среде с ампициллином колонии синего цвета. Клетки-хозяева, несущие гибридную плазмиду, образуют на той же самой среде белые колонии, поскольку обычно при встраивании в полилинкер чужеродной ДНК
ПРОПУЩЕНА СТР. 62
ПРОПУЩЕНА СТР. 63
64 ГЛАВ А 4
последовательности ДНК. Эту проблему можно решить, используя другую рестриктазу.
Следующий после создания библиотеки этап — это поиск клона (клонов), несущего искомую последовательность ДНК. Для этого используют три широко известных метода: гибридизацию с меченым ДНК-зондом с последующим радиоавтографическим анализом, иммунологический скрининг и скрининг по активности белка, кодируемого геном-мишенью.
Скрининг с помощью гибридизации
Нужную нуклеотидную последовательность в образце ДНК можно обнаружить с помощью ДНК-зонда, спаривающегося только с искомой последовательностью. Для этого ДНК сначала переводят в одноцепочечную форму, подвергнув ее тепловой обработке или воздействию щелочью. В этих условиях водородные связи между основаниями разрываются и цепи расходятся

|
| Рис. 4.11. ДНК-гибридизация. Исследуемую ДНК подвергают денатурации и фиксируют на твердой подложке, например на нитроцеллюлозном или найлоновом фильтре. Меченый ДНК-зонд (обычно длиной от 100 до 1000 п. н.) тоже денатурируют, наносят на фильтр с исследуемой ДНК и проводят их отжиг. Для удаления негибридизовавшегося ДНК-зонда фильтр промывают и визуализируют метку. Если гибридизация между зондом и исследуемой ДНК не произошла, то никакой метки на фильтре не обнаруживается. (Метка на рисунке обозначена цветной звездочкой.) |
Технология рекомбинантных ДНК 65
| ДОПОЛНЕНИЕ 4.2 | ||
| Радиоавтография Этот метод широко применяется для локализации радиоактивного материала в клетке, срезе ткани или на пластине геля после электрофореза смеси макромолекул. Для регистрации радиоактивных зон на исследуемый образец накладывают рентгеновскую пленку, в которой поддействием радиоактивного излучения из бромида серебра образуется металлическое серебро. «Засвеченные» участки, соответствующие радиоактивным зонам, наблюдаются визуально после проявления пленки. Одним из вариантов радиоавтографии является флюорография. В этом случае в исследуемый образец импрегнируют сцинтиллятор и вновь накладывают рентгеновскую пленку. Метод основан на том, что низкоэнергетические ß-частицы, образующиеся при распаде изотопа (например, трития), взаимодействуют с молекулами сцинтиллятора, при | этом энергия радиоактивного распада преобразуется в световую энергию, которая и регистрируется рентгеновской пленкой, чувствительной к синей области спектра. Все операции при радиоавтографии необходимо проводить в темноте, чтобы не засветить пленку. Очень важной областью применения радиоавтографии является обнаружение радиоактивного ДНК-зонда после его гибридизации с препаратом ДНК, подвергнутым электрофоретическому разделению. К сожалению, провести гибридизацию в самом геле невозможно, поскольку зонд не может в него проникнуть. Поэтому ДНК после электрофореза переносят на нитроцеллюлозный или найлоновый фильтр по методу Саузерна (Саузерн-блоттинг) или с помощью элюции. Расположение молекул ДНК на фильтре в точности соответствует таковому в геле. Перенесенную на фильтр ДНК подвергают | денатурации и фиксируют, а затем проводят гибридизацию с радиоактивным ДНК-зондом, Гибридизационный сигнал регистрируют радиоавтографическими методами. Перенос ДНК из геля на фильтр носит название Саузерн-блоттинга в честь Эдвина Саузерна, который изобрел этот метол. Использующиеся в литературе термины «Нозерн-блоттинг» и «Вестерн-блоттинг» относятся к переносу РНК и белков соответственно. Эти названия — в переводе «северный» и «западный» -не имеют никакого отношения к сторонам света и были придуманы остроумными коллегами Саузерна (Southern — южный). Тем самым они как бы напутствовали Саузерна на разработку новых методов переноса макромолекул, а также четко обозначили, о переносе каких макромолекул идет речь. Кроме того, все увидели, что шутить умеют не только физики, но и биологи. |
(происходит денатурация). Если теперь медленно снизить температуру, то произойдет их воссоединение (ренатурация). При этом, если в растворе присутствует одноцепочечный ДНК-зонд, он тоже будет ренатурировать с ДНК, специфически спариваясь с комплементарными участками. В результате образуется гибридная ДНК, т. е. двухцепочечная молекула, цепи которой принадлежат двум разным ДНК.
Процедура ДНК-гибридизации состоит в следующем. ДНК-мишень подвергают денатурации и одноцепочечные молекулы необратимо «пришивают» к твердой подложке (нитроцеллюлозному или найлоновому фильтру). Эту процедуру обычно проводят при высокой температуре. Затем фильтр инкубируют с одноцепочечным ДНК-зондом, меченным радиоизотопом или другой меткой. Если нуклеотидные последовательности зонда и ДНК-мишени комплементарны, то происходит их спаривание (т. е. гибридизация) (рис. 4.11). Гибридные молекулы можно визуализировать радиоавтографическим (дополнение 4.2) или другим методом, зависящим от природы метки. Если комплементарность между зондом и ДНК-мишенью отсутствует, то гибридизации не происходит, и мы получаем отрицательный результат. Обычно размер зонда варьирует от 100 до 1000 п. н. и более, хотя можно использовать как более крупные зонды, так и зонды меньшего размера. Для гибридизации, т. е. для образования стабильного комплекса, необходимо, чтобы на участке длиной 50 нуклеоти-дов совпадало более 80% из них, но это зависит от условий реакции.
Меченые ДНК-зонды можно получить разными способами. Один из них, называемый методом случайных праймеров, основан на применении смеси синтетических олигонуклеотидов (олигомеров), содержащих все возможные комбинации из шести нуклеотидов. Некоторые из этих олигонуклеотидов оказываются комплементарными последовательностям ДНК-мише-
Дата добавления: 2015-04-16; просмотров: 285; Мы поможем в написании вашей работы!; Нарушение авторских прав |