
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 5 3 страница
встречается в природных белках довольно редко, этот подход можно использовать для отделения многих других продуктов, кодируемых клонированными генами.
Применение химерных белков
В некоторых случаях конечным продуктом, который предполагается использовать, является сам химерный белок. Например, нередко возникает необходимость в получении антител, узнающих конкретный участок белковой молекулы. Чтобы решить эту задачу, можно встроить в подходящий вектор сегмент ДНК, кодирующий белковый домен, к которому будут вырабатываться нужные антитела. Образующийся в результате химерный белок и будет служить антигеном. Антитела к стабилизирующему его белковому компоненту, происходящему от хозяйской клетки, можно удалить абсорбцией их на чистом стабилизирующем белке, и тогда останутся только антитела, связывающиеся с нужной аминокислотной последовательностью.
Один из клонирующих векторов системы слияния, сконструированных для получения специфических антител, содержит 5'-концевой сегмент гена ompF E. coli, кодирующего один из наружных мембранных белков, и прилегающую к нему часть гена lacZ (ß-галактозидазы) E. coli (рис. 6.7). Этот сегмент содержит информацию, необходимую для инициации транскрипции и трансляции химерного гена, а также для секреции химерного белка. Несмотря на то что укороченный ген lacZ, лишен кодонов для первых восьми аминокислот, кодируемый им белок сохраняет ферментативную активность. В такой форме ß-галактозидаза способна функционировать независимо от того, какие пептиды присоединены к ее N-концу. Ген lacZ встроен в вектор таким образом, что он попадает «не в ногу» с рамкой считывания лидерной последовательности ompF, поэтому активная ß-галактозидаза не образуется. Однако если рамка считывания какого-либо клонированного фрагмента ДНК согласуется с таковой для генов ompF и LacZ, то образуется трех компонентны и химерный белок, состоящий из OmpF-фрагмента, белка, кодиру-
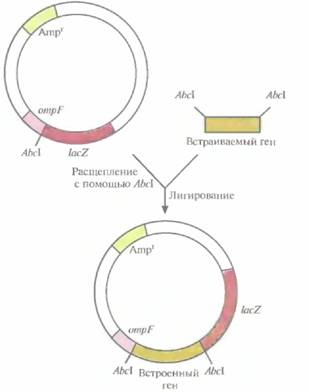
| Рис. 6.7. Клонирующий вектор системы слияния. Он содержит ген устойчивости к ампициллину (Атрг) в качестве селективного маркера, 5 '-концевой сегмент гена ompF, колирующий N-конец наружного мембранного белка, сайт для рестрицирующей эндонуклеазы AbcIи укороченный ген ß-галактозидазы (lacZ). Ген, который хотят клонировать, встраивают в АbcI-сайт. После транскрипции и трансляции этой генетической конструкции образуется трехкомпонентный химерный белок. |
114 ГЛАВА 6
| Таблица 6.3. Очистка химерных белков, продуцируемых Е. соli1' | |||
| Компонент химерного белка, связывающийся с антителом2' | Размер | Антитело | Условия элюирования |
| ZZ | 14 кДа | IgG | Низкий pH |
| Гистидиновый «хвост» | 6-10 аминокислот | Ni2+ | Имидазол |
| Strep-tag | 10 аминокислот | Стрептавидин | Иминобиотин |
| PinPoint | 13кДа | Сгрептавидин | Биотин |
| МБР | 40кДа | Амилоза | Мальтоза |
| ß-Лактамаза | 27кДа | Фенилборат | Борат |
| GST | 25кДа | Глутатион | Восстанавливающий реагент |
| Flag | S аминокислот | Специфическое моноклональное антитело | Низкая концентрация кальция |
| 1) По данным работы Nygren et al., 1994, Tnnds Biolecfutol, 12: 184-188, | |||
| 2) ZZ - фрагмент белка A Staptyjaaxcus aufeus, Strep-lag - пептид, обладающий сродством к стрептавидину; PinPoint - белковый фрагмент, биотинилированный в Е, coli In vivo; MBP — мальтозосвязываюший белок; GST — глутатион S-трансфераза; Flag — пептид, узнаваемый энтерокиназой. |
емого клонированным геном, и функционально активной С-концевой части ß-галактозидазы. Он может использоваться как антиген для выработки антител, дающих перекрестную реакцию с белком клонированного гена, или как инструмент для получения небольших фрагментов специфических белков.
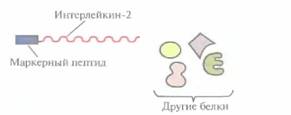
Химерные белки используются не только для стабилизации полипептидов, но и для упрощения процедуры очистки рекомбинантных белков (табл. 6.3). Так, плазмидная конструкция Saccharomyces cerevisiae, содержащая ген человеческого интерлейкина-2 с присоединенным к нему сегментом ДНК, кодирующим маркерный пептид Asp-Туг- Lys-Asp-Asp-Asp-Asp-Lys (он продается под названием Flag), выполняет двоякую функцию: обеспечивает стабилизацию продукта гена интерлейкина-2 и облегчает его очистку. Интерлейкин-2 — это биологический фактор, стимулирующий рост Т-клеток и синтез В-клеточных антител. Химерный белок, образующийся после экспрессии этой генетической конструкции в дрожжевых клетках, может быть очищен за один прием с помощью иммуноаффинной хроматографии. Для этого моноклональные антитела к маркерному пептиду фиксируют на полипропиленовом носителе и пропускают через колонку химерный белок, который связывается с этими антителами (рис. 6.8). Маркерный пептид — небольшая молекула, на его образование расходуется лишь малая часть клеточных ресурсов. Химерный белок обладает такой же биологической активностью, что и нативный интерлейкин-2. Однако если он предназначен для применения в клинике, то маркерный пептид необходимо удалить. Таковы требования государственных служб, контролирующих использование фармацевтических препаратов. Для этого можно использовать бычью энтерокиназу.
Многие белки, продуцируемые Е. соli, накапливаются в клетках в форме нерастворимых биологически неактивных телец включения. И хотя из таких структур часто удается получать в небольших количествах биологически активный белок, для этого приходится проводить продолжительную солюбилизацию. Плохая растворимость белков in vivo часто обусловливается их неправильной укладкой, и эту проблему пытались решить различными способами. Так, известно, что химерные белки, одним из компонентов которых является тиоредоксин, белок мол, массой 11,7 кДА, остаются в растворе, даже если на их долю приходится 40% суммарного клеточного белка. Имея это в виду, ген-мишень встроили в полилинкер сразу вслед за геном тиоредоксина, так чтобы оба этих гена попали под контроль pL-npoмотора в плазмидном векторе E. соli (рис. 6.9). В хромосоме хозяйских клеток E. соli, использующихся в этой системе, присутствует генетическая конструкция, детерминирующая образование репрессора cI — копия гена cI, находящаяся под транскрипционным контро-
Оптимизация экспрессии генов, клонированных в прокариотических системах 115
1. Смесь секретированных белков
 2. Подготовка колонки для иммуноаффинной хроматографии
2. Подготовка колонки для иммуноаффинной хроматографии
 3. Наслаивание смеси белков
3. Наслаивание смеси белков
|
4. Элюирование химерного белка
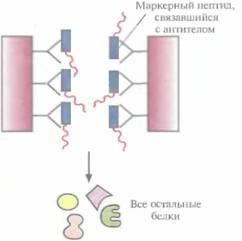
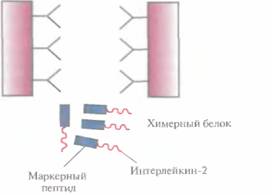 Рис. 6.8. Очистка химерного белка с помощью иммуноаффинной хроматографии. Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
Рис. 6.8. Очистка химерного белка с помощью иммуноаффинной хроматографии. Антитела к маркерному пептиду химерного белка фиксируют на твердом носителе и пропускают через колонку химерный белок. Маркерный пептид, входящий в состав химерного белка, связывается с антителами, а все остальные белки свободно проходят через колонку. Очищенный химерный белок элюируют из колонки.
|
лем промотора trp. В отсутствие триптофана (рис. 6.9, А) репрессор образуется в количестве, достаточном для блокирования транскрипции с pL-промотора, и химерный белок не синтезируется. Когда в среду добавляют триптофан (рис. 6.9, Б), trp- промотор выключается и белок-репрессор не синтезируется, а гены химерного белка транскрибируются с плазмидного pL-промотора. Синтезируемый химерный белок, состоящий из тио-редоксина и белка-мишени, концентрируется в основном в особых областях с внутренней стороны плазматической мембраны Е. соli, называемых зонами адгезии, и высвобождается из клеток при осмотическом шоке. Далее белок-мишень можно отщепить от химерного белка с помощью энтерокиназы. Химерный белок, содержащий тиоредоксин, можно очистить еще одним способом. Если белок-мишень остается стабильным лри повышении температуры, то, поскольку тиоредоксин не разрушается при нагревании вплоть до 80 °С, химерный белок можно инкубировать при высоких температурах и освободиться от большинства других клеточных белков, разрушающихся при этих условиях.
Включение белков в поверхностные структуры
Для скрининга обширных (до 5-1010 клонов) библиотек комплементарных ДНК (кДНК), кодирующих редко встречающиеся белки, были разработаны специальные системы слияния. Обьгчно кДНК встраивают в гены поверхностных белков (белков филаментов или пилей) нитчатых бактериофагов (например, М13) или бактерий и после транскрипции и трансляции получают химерные белки, входящие в состав поверхностных структур этих микроорганизмов. Здесь их идентифицируют иммунологическими методами. Часто для слияния используют ген поверхностного белка pIII фага М13, который связывается с F-пилями Е. coli и инициирует инфекцию. Для клонирования кДНК и других
116 ГЛАВА 6
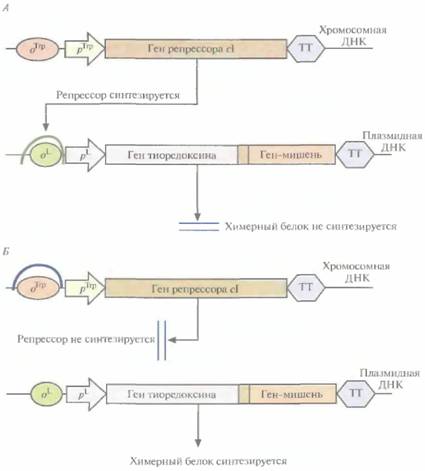
| Рис. 6.9. Экспрессия плазмидного вектора с генетической конструкцией «ген тиоредоксина— ген белка-мишени» в отсутствие (А) и в присутствии (Б) триптофана. Стрелки, помеченные рТrp и pL-, указывают направление транскрипции. Сокращения и обозначения: oТгр оператор, с которым связывается репрессор tip: о1 - оператор, с которым связывается репрессор cI; pΤrp - trp-промотор, pL -левый промотор бактериофага λ; ТТ - сигнал терминации транскрипции. Между генами тиоредексина и белка-мишени находится нуклеотидная последовательность, которая кодирует пептид, расщепляемый энтерокиназой. Подковообразными кривыми изображено связывание репрессоров с соответствующими операторами. |
кодирующих последовательностей была сконструирована плазмида (фагмида), содержащая небольшой фрагмент ДНК M13, который обеспечивал ее упаковку in vitro в фаговые частицы. ген белка pIII под контролем какого-нибудь регулируемого бактериального промотора (например, lac-промотора Е. coli) и сайт клонирования вблизи 5'-конца гена рIII. После репликации рекомбинантного фага М13 в E. coli белок-мишень оказывался сшитым с N-концом фагового белка, и содержащие его бляшки можно было идентифицировать иммунологическими методами. Рекомбинантные фагмиды, выделенные из таких бляшек, могут служить источником соответствующей кДНК. Эта весьма эффективная селективная система позволяет обнаруживать кДНК редких, но очень важных белков.
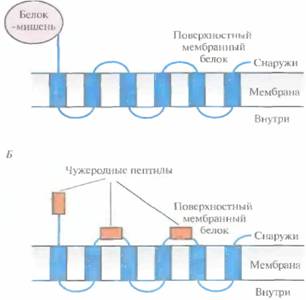
Библиотеки, содержащие гены поверхностных бактериальных белков, можно использовать и для идентификации клонов, несущих специфические нуклеотидные последовательности. Чтобы включить искомый белок в поверхностные структуры грамотрицательной бактерии, например E. coli, сшивают его гены и гены белков этой структуры. В качестве бактериальных белков используются белок наружной мембраны А (ОгпрА) и пептидом и кансвязан-ный липопротеин (PAL) E. coli, а также белок F наружной мембраны Pseudomonas aeruginosa (OprF). При этом белок-мишень обычно находится либо на С-, либо на N-конце химерного белка, но иногда короткие полипептиды включаются в середину молекулы бактериального белка (рис. 6.10).
Оптимизация экспрессии генов, клонированных в прокариотических системах 117
|
| Рис. 6.10. Химерные белки, состоящие из поверхностного бактериального белка и чужеродного белка-мишени, присоединенного к его N- или С-концу (А) либо включенного в экспонируемые участки молекулы (Б). В обоих случаях чужеродные пептиды или белок оказываются на поверхности бактериальной клетки. |
Системы слияния с локализацией белков-мишеней на поверхности бактериальных клеток можно использовать также для суперпродукции некоторых белков и пептидов. Так, в одной из работ в участок, кодирующий основной белок наружной мембраны Pseudomonas aeruginosa (OprF), был встроен ген антигенного детерминанта возбудителя малярии Plasmodiutn falciраrит. Бактериальные клетки, синтезирующие соответствующий химерный белок, давали положительную реакцию с моноклональными антителами к P.falciparum. Следовательно, поверхностные химерные белки можно использовать в качестве вакцин (гл. 11).
Однонаправленное тандемное расположение генов
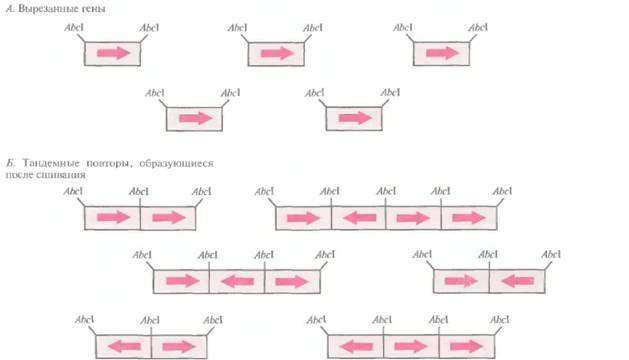
Обычно уровень генной экспрессии пропорционален числу копий транскрибируемого гена в хозяйских клетках. Отсюда следует, что с увеличением числа копий плазмиды должно увеличиваться и количество продукта встроенного в эту плазмиду гена. Однако помимо клонируемого гена плазмида содержит и другие транскрибируемые последовательности, например гены устойчивости к антибиотикам, и по мере увеличения ее копийности энергетические ресурсы клетки будут во все большей степени направляться на образование белков, кодируемых плазмидой, и метаболическая активность хозяйской клетки упадет. Выходом из этой ситуации могло бы стать встраивание в малокопийную плазмиду нескольких копий интересующего исследователя гена. Однако при этом возникает одна техническая проблема — расположение генов в такой ориентации, чтобы все они могли правильно транскрибироваться и транслироваться. Простое сшивание «конец-в-конец» приводит к случайной ориентации генов, так что одни из них экспрессируются, а другие, находящиеся в противоположной ориентации, — нет (рис. 6.11).
Чтобы решить эту проблему можно использовать рестрицирующий фермент AvaI, который узнает последовательность CTCGGG и разрезает ДНК с 5'-конца от остатка Т. Процедура состоит в следующем. Плазмиду, содержащую эту последовательность, разрезают с помощью AvaI и. используя ДНК-полимеразу I, достраивают липкие концы. Затем к обоим ее тупым концам пристраивают EcoRI-линкер (GAATTC), вновь замыкая кольцо. Получившаяся плазмида содержит сегмент ДНК с двумя AvaI-сайтами, фланкирующими EcoRI-сайт и перекрывающимися с ним (рис. 6.12, А и Б), т. е. последовательность CTCGGG AATTCTCGGG (здесь подчеркнутые основания — сайты узнавания для AvaI). Нужный ген вместе с трансляционными старт-и стоп-сигналами встраивают в EсоRI-сайт и затем вырезают из плазмиды с помощью AvaI (рис. 6.12, В). Такие фрагменты имеют неидентичные липкие концы, и поэтому при последующем сшивании соединяются в одной ориентации. Подобный набор однонаправленных тандемных копий гена может быть встроен в экспрессирую-щий вектор. При этом тандемная последовательность может находиться в двух ориентациях относительно промотора, так что ее экспрессия будет происходить только в 50% случаев.
118 ГЛАВА 6
|
| Рис. 6.11. Образование случайно ориентированных тандемных повторов. А. Клонированные гены вырезают из клонирующего вектора с помощью рестрицируюшей эндонуклеазы АbсIи отделяют от векторной ДНК. Б. Создают условия, при которых происходит сшивание вырезанных генов. Поскольку нуклеотидные последовательности обоих выступающих концов генов одинаковы, последние могут соединяться в любой ориентации. В результате образуются тандемные повторы из случайно ориентированных последовательностей. |
Другой подход основан на использовании синтетических ориентированных адаптеров -коротких олигодезоксинуклеотидов, присоединенных к концам линеаризованной плазмидной ДНК и к концам фрагментов ДНК с клонируемым геном. При лигировании эти фрагменты располагаются только в одной ориентации. Описанная процедура технически значительно более проста, чем та, в которой используется ре-стрицирующая эндонуклеаза AvaI; кроме того, она не требует, чтобы в гене-мишени отсутствовали AvaI- и EcoRI-сайты.
Уже показано экспериментально, что уровень экспрессии генов интерферона действительно увеличивается пропорционально числу тандемных копий гена, по крайней мере до четырех копий на плазмиду. Однако тандемные повторы иногда оказываются нестабильными и со временем некоторые из них или даже все утрачиваются плазмидой.
Трансляционные экспрессирующие векторы
Наличие сильного регулируемого промотора -это очень важное, но недостаточное условие максимизации количества продукта клонированного гена. Большую роль играют также эффективность трансляции и стабильность самого продукта. В прокариотических клетках разные мРНК не всегда транслируются с одинаковой эффективностью. Различие может составить несколько сотен раз, и в результате в клетке будут присутствовать сотни или даже тысячи копий одних белковых молекул и лишь несколько копий других.
Различия в трансляции связаны — по крайней мере частично — со свойствами имеющегося в транскрибированной РНК сигнала инициации трансляции, называемого сайтом связывания рибосомы. Сайт связывания рибосомы — это
Оптимизацияэкспрессии генов, клонированныхв прокариотических системах 119

|
| Рис. 6.12. Клонирование нескольких копий гена в одной плазмиде. А. Создание вектора. Плазмиду разрезают по AvaI-сайту и образовавшиеся липкие концы достраивают с помощью ДНК-полимеразы I E. coli. К тупым концам присоединяют EcoRI-линкер, замыкающий кольцо. Б. Встраивание EcoRI -линкера в AvaΙ-сайт в плазмиде. B. Образование однонаправленного тандемного повтора. |
| Рис. 6.13. Внутрицепочечное спаривание в молекуле мРНК, препятствующее эффективной трансляции. GGGGG — сайт связывания рибосомы, AUG (красные буквы) - инициаторный кодон, CAG-CAU-GAU-UUA-UUU — несколько первых кодонов. Обратите внимание, что кроме обычных для мРНК пар A-U и G-C иногда образуются пары G-U. | 
|
120 ГЛАВА 6

| |
| tac- Промотор: функциональный гибрид, полученный из trp- и lac- промоторов H. A. DeBoer, L J. Comstock, M. Yasser Proc. Nail. Acad. Sa. USA 80: 21-25, 1983 |
| Приступая к конструированию laс-промотора, Де Боер и его коллеги ставили своей целью создание на основе двух разных сильных регулируемых промоторов еще более сильного промотора, способного обеспечивать высокий уровень экспрессии чужеродных белков. Когда они начинали свои исследования, нуклеотидные последовательности большинства прока риотических промоторов, в первую очередь Е. coli, были уже установлены, однако конкретные свойства, обусловливающие их эффективность, оставались неизвестными. Было показано, что почти все мутации, влияющие на силу промотора, локализуются в —10- или в -35-областях (находя-шихся на расстоянии 10 или соответственно 35 п. н. до точки инициации транскрипции). Бо- | лее того, силу промотора увеличивали только те мутации, в результате которых нуклеотидные последовательности указанных областей приближались к консенсусным: 5'-ТАТААТ-3' для -10 и 5'-ТТСАСА-3' для -35 соответственно. Эти последовательности были получены в результате сравнения нуклестидных последовательностей всех известных промоторов и идентификации наиболее часто встречающихся нуклеотидов. Де Боеру было известно, что у промотора lacUV5, более сильного варианта lac-промотора, — 10-область имеет кон-сенсусную нуклеотидную последовательность, а — 35-область — нет, а у trр-промотора, в норме контролирующего транскрипцию генов, которые отвечают за биосинтез триптофана, ситуация | как раз обратная. Он и его коллеги решили сконструировать химерный промотор, у которого —10-область происходила бы от lac- промотора, а —35 — от промотора trр. Этот новый, так называемый taс-промотор был проверен на способность контролировать синтез фермента галактокиназы E. coli по сравнению с lac- и trp-промоторами в таких же условиях. Как и ожидалось, lac-промотор оказался гораздо более сильным — примерно в 5 раз по сравнению с промотором trp и в 10 — по сравнению с lac. Кроме того, laс-промотор, как и lac, реагировал на lас-репрессор и активировался под действием ИПТГ. Таким образом, новый промотор был не только более сильным, но и регулируемым. |
последовательность из шести-восьми нуклеотидов (например, UAAGGAGG), спаривающаяся с комплементарной последовательностью (в данном случае AUUCCUCC) РНК-компонента (рРНК) малой субъединицы рибосомы. Обычно чем прочнее связывание между мРНК и рРНК, тем выше эффективность инициации трансляции. Именно поэтому большинство экспресси-рующих Е. сoli-векторов конструируют таким образом, чтобы мРНК клонированного гена обязательно содержала сильный сайт связывания рибосомы. Это необходимое условие трансляции гетерологичных про- и эукариотических генов в E. coli. Однако должны соблюдаться и некоторые другие условия. Во-первых, нуклеотидная последовательность, связывающаяся с рРНК, должна находиться на определенном расстоянии от старт-кодона клонированного гена (в РНК старт-кодоном является AUG; в ДНК ему соответствует кодон ATG). Во-вторых, участок ДНК, содержащий сайт связывания рибосомы и несколько первых кодонов клонированного гена, не должен иметь такую нуклеотидную последовательность, при которой после транскрипции может произойти вну-трицепочечное спаривание (рис. 6.13), нарушающее связывание мРНК с рибосомой. Именно локальная вторичная структура мРНК, обеспечивающая экранирование или, напротив, экспонирование сайта связывания рибосомы, и определяет прочность связывания мРНК с комплементарной рРНК. Таким образом, при клонировании любого гена важно убедиться в том, что сайт связывания рибосомы расположен на нужном расстоянии от этого гена и что вторичная структура мРНК не помешает его присоединению к рибосоме.
Уже создано большое количество векторных систем, которые включают как транскрипционный, так и трансляционный сигналы, обеспечивающие экспрессию клонированных эукариотических генов в E. coli. Одной из таких систем
Оптимизация экспрессии генов, клонированных в прокариотическихсистемах 121
|
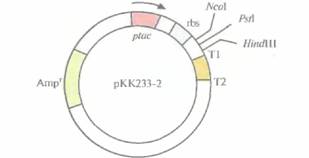
| Рис. 6.14. Экспрессирующий вектор на основе плазмиды рКК233-2 (без соблюдения масштаба). Он содержит ген устойчивости к ампициллину (Ampr), являющийся селективным маркером, lас-промотор (р(ас), lacZ-участок связывания рибосомы (rbs), три сайта для рестрицирующих эндонуклеаз (NcoI, PsAIи HindIII) и два сайта терминаиии транскрипции (Т1 и Т2). Стрелка — направление транскрипции. |
является экспрессирующий вектор рКК233-2,
содержащий следующие элементы (рис. 6.14):
• селективный маркер устойчивости к ампициллину
• tec-промотор
• lacZ-участок связывания рибосомы
• старт-кодон ATG, расположенный на расстоянии восьми нуклеотидов от сайта связывания рибосомы
• сайты терминации транскрипции Т1 и Т2 фага λ.
Клонируемый ген встраивают в NcoI-, PstI-или HindIII-сайт, расположенный между сайтом связывания рибосомы и сайтами терминации транскрипции. Если его рамка считывания не попадает «в ногу» с кодоном AUG, то необходимо произвести минимальную коррекцию. В этом случае после индукции и транскрипции происходит достаточно эффективная трансляция клонированного гена. Однако следует иметь в виду, что поскольку нуклеотидная последовательность, кодирующая N-концевой участок белка-мишени, у разных клонированных генов неодинакова, нельзя создать универсальный вектор, исключающий одноцепочечное спаривание мРНК при любых обстоятельствах. Поэтому ни одна из областей инициации трансляции, как бы она ни была оптимизирована, не может га-
рантировать эффективность трансляции всех клонированных генов. Таким образом, описанные выше экспрессирующие векторы - это только основа для создания оптимальной системы трансляции.
Эффективной трансляции может препятствовать и «несовместимость» клеток, обусловленная тем, что в клонируемом гене имеются кодоны, редко встречающиеся в геноме организма-хозяина. В таких случаях в хозяйской клетке может не доставать транспортных РНК (тРНК), узнающих редко используемые кодоны, что снижает выход продукта клонированного гена. Как решить эту проблему — не совсем понятно. Если продукт клонированного гена очень ценен, можно попытаться химически синтезировать такой вариант клонируемого гена, который состоит из кодонов, обычно используемых хозяйским организмом (оптимизация кодонов).
Стабилизация белков
Обычно время полужизни белков составляет от нескольких минут до нескольких часов. Такая вариабельность обусловливается различиями в числе дисульфидных связей в белковых молекулах и наличием или отсутствием на 5'-конце определенных аминокислот. Например, если к N-концу ß-галактозидазы присоединять разные аминокислоты, то время жизни модифицированного белка in vitro может варьировать от двух минут до более 20 часов (табл. 6.4). Аминокислоты, увеличивающие время жизни белков, можно включать в белки генноинженерными методами. Часто для стабилизации белка-мишени достаточно присоединить к N-концу всего
| Таблица 6.4. Время полужизни ß-галактозидаз, к N-концу которых присоединены разные аминокислоты1) | |
| Присоединенные аминокислоты | Время полужизни |
| Mel, Ser, Ala Thr, Val, Gly Ile, Glu Туr, Gln Pro Phe, Leu, Asp, Lys Arg | >20 ч >20 ч >30 мин ~ 10 мин ~7 мин ~3 мин ~2 мин |
| 1) По данным работы Bachmairelal., 1986, Science 234:179-186. |
122 ГЛАВА 6
один аминокислотный остаток. Долгоживущие белки накапливаются в клетках, что увеличивает конечный выход продукта. Это характерно как для эу-, так и для прокариот.
Однако стабильность белков может не только повышаться. Так, включение некоторых аминокислотных последовательностей во внутреннюю часть белковой молекулы делает ее более чувствительной к протеолитическому расщеплению. Такие последовательности обогащены остатками пролина (Р), глутаминовой кислоты (Е), се-рина (S) и треонина (Т), отсюда и их название -PEST-последовательности. Они часто бывают фланкированы кластерами из положительно заряженных аминокислот и, возможно, служат маркерами для протеаз. Стабильность белков, содержащих такие последовательности, можно было бы повысить, внося изменения в соответствующие гены. При этом, однако, необходимо позаботиться о том, чтобы не произошло нарушений функции белка-мишени.
Рост в условиях недостатка кислорода
E. coli и многие другие микроорганизмы, которые используются для экспрессии чужеродных белков, обычно растут только в присутствии кислорода. К сожалению, растворимость кислорода в водных средах ограничена, а по мере увеличения плотности культуры содержание растворенного кислорода в культуральной среде быстро падает. Более того, поскольку кислород растворяется очень медленно, эту проблему нельзя решить простым продуванием через среду воздуха или кислорода даже при интенсивном перемешивании. При уменьшении концентрации кислорода экспоненциальный рост замедляется и культура медленно переходит в стационарную фазу, характеризующуюся другим метаболическим статусом. Одним из последствий этого является образование в клетках протеиназ, которые могут расщеплять белок-мишень. Проблему аэрации культуральной среды пытались решить разными способами: изменением конструкции биореактора, повышением интенсивности продувания воздуха и перемешивания, добавлением в среду веществ, увеличивающих растворимость кислорода. Все это, однако, не привело ни к каким ощутимым результатам.
Применение хозяйских штаммов с дефицитом протеиназ
Дата добавления: 2015-04-16; просмотров: 291; Мы поможем в написании вашей работы!; Нарушение авторских прав |