
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГЛАВА 10. Гормон роста человека, полученный методом генной инженерии
Гормон роста человека, полученный методом генной инженерии
Стратегию конструирования новых белков путем замены функциональных доменов или с помощью направленного мутагенеза можно использовать для усиления или ослабления биологического действия белка. Например, нативный гормон роста человека (ГРЧ) связывается в разных типах клеток как с рецептором гормона роста, так и с пролактиновым рецептором.
Чтобы избежать нежелательных побочных эффектов в процессе лечения, нужно исключить присоединение ГРЧ к пролактиновому рецептору. Поскольку участок молекулы гормона роста, связывающийся с этим рецептором, по своей аминокислотной последовательности лишь частично совпадает с участком молекулы, который взаимодействует с пролактиновым рецептором, удалось избирательно снизить связывание гормона с последним. Для этого использовали сайт-специфический мутагенез, в результате которого произошли определенные изменения в боковых группах некоторых аминокислот (His-18, His-21 и Glu-174) — лигандов для ионов Zn2+, необходимых для высокоаффинного связывания ГРЧ с пролакгиновым рецептором (рис. 10.2). Модифицированный гормон роста связывается только со «своим» рецептором. Полученные результаты представляют несомненный интерес, но смогут ли модифицированные ГРЧ найти применение в клинике, пока неясно.
Оптимизация генной экспрессии
Недостаточно создать новый белок, важно оптимизировать экспрессию его гена. Для начала исследователи определяют возможность синтеза достаточных количеств аутентичного белка в прокариотической или эукариотической системах экспрессии. Прокариотическим системам отдается предпочтение, поскольку работа с ними обходится дешевле, а производительность выше. К сожалению, не все микроорганизмы синтезируют функциональные формы гетерологичных белков с одинаковой эффективностью, поэтому необходимо проводить сравнительные количественные оценки.
При изучении экспрессии гена интерлейкина-3 человека в различных клетках-хозяевах «наилучшим» хозяином оказалась Bacillus licheniformis (табл. 10.4). Хотя в одной из систем Е, coli был достигнут несколько более высокий уровень экспрессии, полученный белок мол. массой 20 кДа представлял собой продукт слияния интерлейкина-3 с участком ß-галактозидазы Е. coli, a не зрелый аутентичный белок мол. массой 15 кДа. Как правило, подобный химерный белок нельзя использовать в качестве лекарственного средства. Клетки дрожжей Kluyveromyces lactis и Saccharomyces cerevisiae, а также клетки человека были способны гликозилировать интерлейкин-3, однако уровень экспрессии в них был относительно низок. Гликозилирование не оказывает заметного влияния на активность интерлейкина-3, но ведет к ощутимой разнице в размерах молекулы.

| Рис. 10.2. Схематическое изображение нативной и модифицированной форм гормона роста человека (ГРЧ). С помощью олигонуклеотид-направленного мутагенеза получена форма ГРЧ, утратившая способность связываться с пролактиновым рецептором, но сохранившая специфичность к рецептору гормона роста. |
Микробиологическое производство лекарственных средств 209
| Таблица 10.4. Уровень экспрессии гена интерлейкина-3 в разных системах клеток-хозяев1) | |||
| Клетка-хозяин | Промотор2) | Уровень экспрессии, ЕД | Мол. масса белка, кДа |

| 
| 
| 
|
| 1) Из работы van Leen et al, Bio/Technology 9: 47-52, 1991, с изменениями. 2)В каждом случае использовался один из наиболее сильных промоторов, «работающих» в данной системе. |
Ферменты
ДНКаза I
Наиболее частым летальным наследственным заболеванием среди европеоидов является муковисцидоз. В США выявлено 30 000 случаев этого заболевания, в Канаде и странах Европы - 23 000. Пациенты с муковисцидозом часто страдают инфекционными заболеваниями, поражающими легкие. Лечение рецидивирующих инфекций антибиотиками в конце концов приводит к появлению резистентных штаммов патогенных бактерий. Бактерии и продукты их лизиса вызывают накопление в легких вязкой слизи, затрудняющей дыхание. Одним из компонентов слизи является высокомолекулярная ДНК, которая высвобождается из бактериальных клеток при лизисе. Ученые из биотехнологической компании Genentech (США) выделили и экспрессировали ген ДНКазы — фермента, который расщепляет высокомолекулярную ДНК на более короткие фрагменты. Очищенный фермент вводят в составе аэрозоля в легкие больных муковисцидозом, он расщепляет ДНК, вязкость слизи снижается, что облегчает дыхание. Хотя эти меры и не излечивают муковисцидоз, они облегчают состояние больного. Применение данного фермента было недавно одобрено Департаментом по контролю за качеством пищевых продуктов, медикаментов и косметических средств (США), и объем его продаж составил в 2000 г. примерно 100 млн. долларов.
Альгинат-лиаза
Альгинат - это полисахарид, синтезируемый целым рядом морских водорослей, а также почвенными и морскими бактериями. Его мономерными единицами являются два сахарида – ß-D-маннуронат и a-L-гулуронат, относительное содержание и распределение которых и определяют свойства конкретного альгината. Так, остатки a-L-гулуроната образуют межцепочечные и внутрицепочечные сшивки путем связывания ионов кальция; остатки ß-D-маннуроната связывают ионы других металлов, Альгинат, содержащий такие сшивки, образует эластичный гель, вязкость которого прямо пропорциональна размеру полисахаридных молекул.
Выделение альгината слизистыми штаммами Pseudomonas aemginosa существенно повышает вязкость слизи у больных муковисцидозом. Чтобы очистить дыхательные пути и облегчить состояние больных, в дополнение к обработке ДНКазой I следует провести деполимеризацию альгината с помощью альгинат-лиазы.
Ген альгинат-лиазы был выделен из Flavobacterium sp., грамотрицательной почвенной бактерии, ативно вырабатывающей этот фермент. На основе E. coli был создан банк клонов Flavobacterium и проведен скрининг тех из них, которые синтезируют альгинат-лиазу, путем высевания всех клонов на твердую среду, содержащую альгинат, с добавлением ионов кальция. В таких условиях весь альгинат, находящийся в среде, за исключением того, который окружает продуцирующие альгинат-лиазу колонии, образует сшивки и становится мутным. Гидролизованный альгинат теряет способность к формированию сшивок, поэтому среда вокруг синтезирующих альгинатлиазу колоний остается прозрачной-Анализ клонированного фрагмента ДНК, присутствующего в одной из положительных колоний, показал наличие открытой рамки считывания, кодирующей полипептид мол. массой около 69 000. Более детальные биохимические и
210 ГЛАВА 10
|
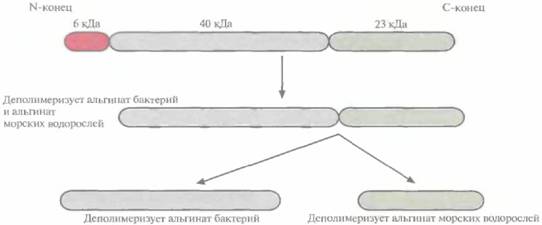
| Рис. 10.3. Процессинг белка — предшественника рекомбинантной альгинат-лиазы Flavobacterium, происходящий в Е. coli. В результате отщепления от белка мол. массой 69 кДа пептида 6 кДа образуется белок мол. массой 63 кДа, способный деполимеризовать альгинат морских водорослей и бактериальный альгинат. Расщепление белка 63 кДа дает белок мол. массой 23 кДа, активно деполимеризующий альгинат морских водорослей, и белок мол. массой 40 кДа, гидролизу ющий бактериальный альгинат. |
генетические исследования показали, что этот полипептид, по-видимому, является предшественником трех альгинат-лиаз, вырабатываемых Flavobacterium sp. (рис. 10.3). Сначала какой-то протеолитический фермент отрезает от него N-концевой пептид массой около 6000. Оставшийся белок мол. массой 63 000 способен деполимеризовать альгинат, вырабатываемый как бактериями, так и морскими водорослями. При его последующем разрезании образуется продукт мол. массой 23 000, деполимеризующий альгинат морских водорослей, и фермент мол. массой 40 000, разрушающий альгинат бактерий. Для получения больших количеств фермента мол. массой 40 000 кодирующую его ДНК амплифицировали методом полимеразной цепной реакции (ПЦР), а затем встраивали в выделенный из В. subtilis плазмидный вектор, несущий ген, кодируюший сигнальный пептид α-амилазы В. sitbtüis. Транскрипцию контролировали при помощи системы экспрессии гена пенициллиназы (рис. 10.4). При
трансформации клеток В. subtilis полученной плазмидой и высевании их на содержащую альгинат твердую среду с добавлением ионов кальция образовались колонии с большим ореолом. Когда такие колонии выращивали в жидкой среде, ре-комбинантная альгинат-лиаза выделялась в культуральную среду. Последующие тесты показали, что этот фермент способен эффективно разжижать альгинаты, синтезируемые слизистыми штаммами P. aeruginosa, которые были выделены из легких больных муковисцидозом. Для того чтобы определить, целесообразно ли проводить клиническое тестирование рекомбинантной альгинат-лиазы, нужны дополнительные исследования.
Моноклональные антитела как лекарственные средства
Примерно 100 лет назад была предпринята попытка лечения детей, больных дифтерией, с помощью неочищенной антисыворотки, получен-

|
| Рис. 10.4. ДНК, кодирующая альгинат-лиазу мол. массой 40 кДа. К последовательности, кодирующей N-конец альгинат-лиазы, присоединен сегмент гена α-амилазы В. subtilis, кодирующий ее сигнальный пептид. Транскрипция контролируется при помощи системы экспрессии гена пенициллиназы В. subtilis. |
Микробиологическое производство лекарственных средств 211
ной от лошадей, которых инфицировали Corynebacierium diphtheriae, вызывающей дифтерию у человека. С. diphtheriae инфицирует горло и миндалины, выделяя экзотоксин, приводящий к гибели клеток человека. Проникая в кровоток, этот токсин поражает органы, удаленные от места первичной инфекции, и в отсутствие лечения болезнь может иметь летальный исход. (В те времена, о которых идет речь, смертность достигала 45%.) Однако, если больному в первые несколько дней после начала инфекции ввести лошадиную антисыворотку, содержащую антитела к этому экзотоксину, то у него возникнет пассивный иммунитет, который позволяет избежать летального исхода.
К сожалению, риск, связанный с использованием антител, не позволяет широко применять этот метод терапии. Дело в том, что в организме больного часто вырабатываются собственные антитела на чужеродные белки, присутствующие в цельной или частично очищенной антисыворотке, и ее повторное введение в случае сенсибилизации организма может привести к развитию анафилактического шока и гибели пациента.
С развитием гибридомной технологам вновь появилась надежда на то, что антитела можно будет использовать в качестве терапевтических средств для поддержания постоянного уровня чистых моноспецифичных антител в организме. Однако остаются проблемы, связанные с риском развития перекрестных реакций, приводящих к развитию иммунного ответа и анафилаксии: ведь в организме бального могут вырабатываться собственные антитела на детерминанты монокло-нальных антител мыши. Поэтому основная задача в настоящее время состоит в том, чтобы разработать методы получения моноклональных антител человека, обладающих как специфическими иммунотерапевтическими свойствами, так и пониженной иммуногенностью.
Структура и функции антител
Молекула антитела (иммуноглобулин) состоит из двух «легких» (L) и двух «тяжелых» (Н) белковых цепей, которые соединены водородными связями и расположенными в строго определенных местах дисульфидными мостиками. N-концевые участки L- и Η-цепей образуют антигенсвязывающий сайт. Отдельные домены
(области) молекулы антитела выполняют разные функции, что облегчает манипуляции с генами антител (рис. 10.5). Антигенсвязывающие сайты состоят из трех участков, определяющих комплементарность антител к антигену (CDR, от англ, complementarity-determining regions), и образующих вариабельные (VH и Vl) области на N-концах Н- и L-цепей. Для CDR характерна очень высокая изменчивость последовательности аминокислот, поэтому их еще называют гипервариабельными. Помимо вариабельных (VH и Vl), каждая L-цепь содержит одну константную область, или домен (CL), a каждая Η-цепь -три константных области, или домена (СH1, СН2 и СH3). При обработке антитела протеолитическим ферментом папаином образуются три фрагмента: два идентичных (Fab), каждый из которых содержит интактную L-цепь, связанную дисульфидным мостиком с vh- и СH1-доменами Н-цепи, и один Fc, состоящий из двух соединенных дисульфидной связью СН2- и Сн3-доменов Н-цепи, Fab-фрагмент, точнее его N-концевая часть, называемая Fv-фрагментом, обладает антигенсвязывающей активностью, присущей интактной молекуле антитела (рис. 10.5). При этом его аминокислотная последовательность у разных молекул существенно различается.
После связывания антигена с интактным антителом запускаются следующие реакции иммунного ответа.
• Активируется система комплемента. Компоненты этой системы разрушают клеточные мембраны, активируют фагоциты и генерируют сигналы, мобилизующие другие компоненты системы иммунного ответа.
• В результате связывания Fc-участка антитела с Fc-рецептором эффекторной клетки запускается реакция опосредованной антителами клеточной цитотоксичности. Активированная эффекторная клетка высвобождает вещества, лизирующие чужеродную клетку, с которой связан Fab-участок молекулы антитела.
• После связывания Fab-участка с растворимым антигеном Fc-участок антитела может присоединяться к Fc-рецепторам фагоцитов, которые захватывают и разрушают комплекс антиген—антитело.
Дата добавления: 2015-04-16; просмотров: 303; Мы поможем в написании вашей работы!; Нарушение авторских прав |