
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Описание метода и экспериментальной установки. Определение показателя адиабаты для воздуха
Лабораторная работа 2.2.
Определение показателя адиабаты для воздуха
Методом Клемана-Дезорма.
Библиографический список
1. Трофимова Т. И. Курс физики. М.: Высшая школа, 1985.
2. Савельев И.В. Курс общей физики. – М.: Наука, 1988. Т. 1.
Цель работы: изучение газовых законов.
Приборы и принадлежности: прибор Клемана-Дезорма
Описание метода и экспериментальной установки
Величину показателя адиабаты  ,
,
где:
Сp — теплоемкость газа при постоянном давлении,
  |
СV – теплоемкость газа при постоянном объеме,
можно определить с помощью прибора Клемана-Дезорма
(рис. 1), состоящего из баллона 1 с воздухом, насоса 4 и спиртового манометра 5.
В баллон при закрытом кране 2 накачивается воздух. При накачивании воздух, сжимаемый под поршнем насоса, нагревается, следовательно, необходимо выждать 2-3 минуты, пока благодаря теплообмену температура в баллоне не станет равной комнатной. Поле этого измеряют манометром избыточное давление воздуха p1 (в миллиметрах столба жидкости, налитой в манометр). Давление в баллоне станет равным
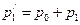
где p0 – атмосферное давление; p1 – избыток давления в баллоне над атмосферным давлением p0, измеряемый манометром.
Открывают на короткое время кран 2, чтобы давление в баллоне сравнялось с атмосферным (  ), после чего закрывают кран.
), после чего закрывают кран.
Пусть масса воздуха после накачивания насосом в сосуде объемом V равна m. При открывании крана часть воздуха выходит. Обозначим массу вышедшего воздуха  , тогда как масса оставшегося воздуха
, тогда как масса оставшегося воздуха  .
.
Масса воздуха  , которая заключается в объеме V, занимала перед открытием крана меньший объем V1. Так как процесс кратковременный и заметного теплообмена между газом и стенками нет, то его можно считать адиабатическим. Согласно уравнению Пуассона (для массы газа, равной
, которая заключается в объеме V, занимала перед открытием крана меньший объем V1. Так как процесс кратковременный и заметного теплообмена между газом и стенками нет, то его можно считать адиабатическим. Согласно уравнению Пуассона (для массы газа, равной  ) получим:
) получим:
 (1)
(1)
Вследствие адиабатического расширения газа температура его понизилась, а затем в результате теплообмена температура газа через небольшой промежуток времени станет равной комнатной. При этом давление газа поднимается до величины
 .
.
Начальное и конечное состояние газа наблюдается при одинаковой температуре. Поэтому на основании закона Бойля-Мариотта получим
 (2)
(2)
Решая уравнения (1) и (2) относительно g, получаем
 (3)
(3)
Разложим  и
и  в ряд Тейлора, ограничившись в этом случае двумя первыми членами:
в ряд Тейлора, ограничившись в этом случае двумя первыми членами:
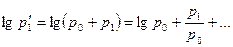

Подставляя эти значения в формулу (3), находим окончательно
 (4)
(4)
Дата добавления: 2015-04-16; просмотров: 250; Мы поможем в написании вашей работы!; Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Описание метода и экспериментальной установки. Определение универсальной газовой постоянной методом откачки. | | | Описание метода и экспериментальной установки |