
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ГИДРАТАЦИЯ И ДЕГИДРАТАЦИЯ БЕЛКОВ
Пищевая ценность, вкусовые качества пищевых продуктов, их стойкость при хранении обусловлены входящими в их состав веществами органического и неорганического происхождения. Из всех компонентов продуктов питания наибольшее влияние на их свойства оказывает вода. Во многих пищевых продуктах, и даже в тех, в которых содержание воды было преднамеренно снижено в процессе обработки с целью повышения их стойкости при хранении, на ее долю приходится наибольший удельный вес. Так, в сушеном картофеле, общая влажность которого составляет 6,5 %, на каждые 3,6 моль воды приходится 3,1 моль крахмала и 0,46 моль белка.
Характер воздействия воды на процессы, протекающие при производстве пищевых продуктов, определяется, прежде всего, общим количеством воды и формами связи ее с другими компонентами, в основном с белками.
По количеству влаги пищевые продукты целесообразно разделить на три основные группы: продукты с высокой влажностью (более 40 % воды), со средней, или промежуточной, влажностью (10...40 % воды), и с низкой влажностью (менее 10 % воды).
Влажность пищевых продуктов непосредственно связана с таким показателем их качества, как активность воды (aт), величина которой влияет на течение химических реакций и размножение микроорганизмов в продукте. Более подробно этот вопрос рассмотрен в главе 14.
Различают четыре формы связи влаги с материалами, и в частности с компонентами пищевых продуктов: химическую, адсорбционную, осмотическую и капиллярно-связанную.
Химически связанную воду подразделяют на воду гидрата в составе гидроксильных групп (ионная связь) и воду молекулярных соединений в виде кристаллогидратов (молекулярная связь). Из всех форм связи химически связанная вода обладает наибольшей энергией.
Адсорбционно-связанная вода характеризуется средней интенсивностью прочности связи. Она образуется в результате притяжения диполей воды полярными молекулами, расположенными на поверхности субстрата. При образовании такой связи молекулы воды могут сохранять свои свойства, в этом случае происходит физическая адсорбция. Если молекула воды расщепляется на ионы, то происходит химическая адсорбция, или хемосорбция.
Одновременно с адсорбцией водяных паров или воды на поверхности молекул продукта возможна диффузия влаги в массу сорбента. В этом случае наблюдается процесс абсорбции.
Увлажнение капиллярно-пористых тел, к которым относится большинство пищевых продуктов, происходит в результате адсорбции влаги, образования раствора и проникания его в клетки пищевого продукта за счет разности концентраций растворенных веществ. Образуется осмотически связанная вода.
Пищевые продукты представляют собой капиллярно-пористые тела с порами различного диаметра, которые могут быть заполнены жидкостью. Капиллярно-связанная влага образуется в результате адсорбции воды стенками капилляров и понижения давления водяного пара над вогнутым мениском жидкости.
Гидратация белков пищевых продуктов в основном обусловлена адсорбционно- и химически связанной водой.
Аминокислоты, из которых состоит белок, относятся к амфотерным веществам, обладающим одновременно свойствами кис 

 лот и оснований. Это объясняется тем, что все амино- и карбоксильные группы аминокислот заняты в образовании пептидных связей. В молекулах диаминокислот остаются свободными аминогруппы, а в молекулах моноаминодикарбоновых кислот — карбоксильные группы. Например, при растворении белка в воде от карбоксильных групп отщепляются протоны, и белок приобретает свойства слабой кислоты.
лот и оснований. Это объясняется тем, что все амино- и карбоксильные группы аминокислот заняты в образовании пептидных связей. В молекулах диаминокислот остаются свободными аминогруппы, а в молекулах моноаминодикарбоновых кислот — карбоксильные группы. Например, при растворении белка в воде от карбоксильных групп отщепляются протоны, и белок приобретает свойства слабой кислоты.
Появляющиеся в растворе протоны присоединяются к NH2-группам, вследствие чего они переходят в ионизированную форму — NH3+. В сильнокислой среде биполярный ион аминокислоты превращается в катион, способный двигаться к катоду в электрическом поле. В щелочной среде биполярный ион аминокислоты превращается в анион. Таким образом, молекула белка несет положительный или отрицательный заряд.
Амфотерность белков определяется не только присутствием свободных карбоксильных или аминогрупп в белке, но и наличием других функциональных группировок. Слабо выраженными кислотными свойствами обладают SH-группа цистеина и ОН-группа тирозина.
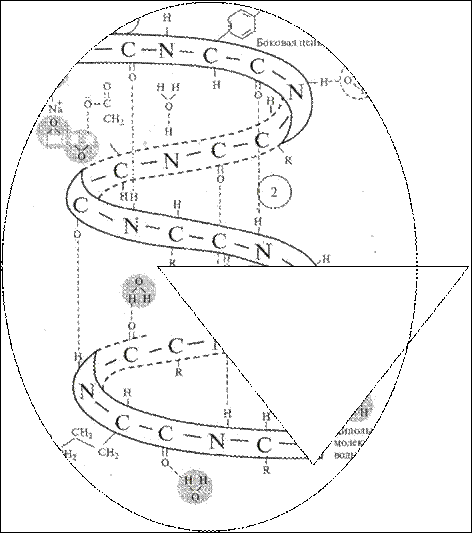
Рис. 6.1. Схема вероятного присоединения молекул воды к полярным группам белка (интерпретация X. Хмары).
Поскольку молекула воды также обладает полярностью, то при контакте белка с водой диполи воды адсорбируются поверхностью белковой молекулы, группируясь вокруг полярных групп. Эти группы называют гидрофильными (рис. 6.1).
Адсорбционная вода удерживается белком благодаря образованию между их молекулами водородных связей, которые относятся к разряду относительно слабых. Однако это свойство компенсируется значительным их числом: каждая молекула воды способна образовать 4 водородные связи, которые распределяются между полярными группами белка и соседними молекулами воды. В результате адсорбционная вода в белке оказывается довольно прочно связанной: она не отделяется от белка самопроизвольно и не может служить растворителем для других веществ.
На поверхности белковой молекулы имеется два вида полярных групп: связанные и свободные. Связанные полярные группы (пептидные группы главных полипептидных цепей, гидроксильные, сульфгидрильные) присоединяют молекулу воды благодаря молекулярной адсорбции, величина которой постоянна для каждого вида белка и незначительно влияет на изменение степени гидратации белков.
Свободные полярные группы (аминогруппы диаминокислот, карбоксильные группы дикарбоновых кислот), диссоциируя в растворе определяют суммарную величину заряда белковой молекулы. Адсорбирование воды свободными полярными группами называется ионной адсорбцией.
Среди факторов, обусловливающих степень гидратации белков, следует выделить рН среды, концентрацию белковых растворов, природные свойства белка и др.
Ионизация ионогенных групп в результате ионной адсорбции приводит к тому, что в растворе белковые глобулы ведут себя как макроионы, знак и величина заряда которых зависят от рН и состава растворителя. Величину рН, отвечающую равенству общего числа положительных зарядов общему числу отрицательных, т. е. суммарному или эффективному заряду глобулы, равному нулю, называют изоэлектрической точкой (ИЭТ) белка. Изоэлектрическая точка — основная электрохимическая константа белков. Белки в этой точке электронейтральны, а их набухаемость и растворимость наименьшие. Снижение растворимости белков при достижении электронейтральности их молекул широко используется для выделения их из растворов, например при получении белковых изолятов.
Каждый белок характеризуется своей изоэлектрической точкой (рН): пепсин — 1,0; яичный альбумин — 4,7; сывороточный альбумин — 4,59; желатин — 5,05; лактоглобулин — 5,1; фосфорилаза — 5,8; гемоглобин — 6,87; химотрипсин — 8,6; рибонуклеаза — 9,4; лизоцим — 10,5; цитохром — 10,65.
Значение рН белкового раствора в ИЭТ соответствует прекращению переноса макроионов белка в электрическом поле. Если величина рН раствора будет отклоняться от ИЭТ белка, то его эффективный заряд увеличится. В области рН выше ИЭТ он будет отрицательным в результате подавления диссоциации основных групп в щелочной среде. Напротив, при рН ниже ИЭТ белок будет обладать суммарным положительным зарядом вследствие подавления диссоциации карбоксильных и других кислотных групп.
В ИЭТ наблюдается стабильность белковых пен. С изменением растворимости белка при отклонении рН от ИЭТ, а также с изменением ионной силы белкового раствора хорошо коррелирует изменение эмульгирующей емкости белка. Это обстоятельство используют при выделении белков из животного и растительного сырья и переработке белков в пищевых производствах.
Таким образом, изменяя рН среды в ту или иную сторону от изоэлектрической точки, можно повышать степень гидратации белка за счет адсорбционно-связанной воды.
В общественном питании способность белков мяса к дополнительной гидратации используют при мариновании мяса перед жаркой. При этом мясо и рыбу обрабатывают пищевой кислотой (уксусной, лимонной, молочной и др.) или натуральными фруктовыми соками, содержащими смесь пищевых кислот. При этом рН мяса снижается до 3,0...3,5, т. е. ниже изоэлектрической точки основных белков мяса. При тепловой кулинарной обработке такое мясо меньше обезвоживается, что позволяет получать готовые изделия с более высокими органолептическими показателями качества (сочность, вкус, консистенция). В мясной фарш также добавляют до 8 % воды для получения более сочных рубленых мясных изделий (бифштексы, шницели, котлеты, биточки, зразы, рулеты, фрикадельки, тефтели, люля-кебаб).
В мясной промышленности дополнительная гидратация белков мяса достигается добавлением пищевых фосфатов, смещающих рН мяса в нейтральную и слабощелочную сторону от изоэлектрической точки белков мяса.
В растворах небольшой концентрации молекулы белка полностью гидратированы из-за присутствия избыточного количества воды. Такие белковые растворы содержатся в молоке, жидком тесте, в некоторых смесях на основе яичного меланжа и пр.
В концентрированных белковых растворах и обводненных белковых студнях при добавлении воды происходит дополнительная гидратация белков. Это наблюдается, например, при добавлении к яичной массе, предназначенной для изготовления омлетов, воды или молока. При последующей тепловой обработке в результате денатурации белков и структурообразования получается студень, удерживающий всю содержащуюся в белковом растворе влагу. Эффективность дополнительной гидратации в данном случае заключается в улучшении реологических показателей студня — снижении его механической прочности и упругости. Все вместе взятое создает ощущение нежности и сочности готового продукта.
При высоких концентрациях хорошо растворимых солей в растворе присутствует несравненно больше ионов соли, чем заряженных групп белка. При этом гидратация белка водой может уменьшаться, так как раствор соли становится плохим растворителем для белка. Иначе говоря, снижение активности воды в растворе при введении большого количества диссоциирующих солей соответствует повышению активности белка в растворе и соответствующему снижению его растворимости.
Повышение концентрации солей в растворе соответствует также увеличению гидрофильности растворителя и усилению гидрофобного взаимодействия между молекулами белка. Высаливание (осаждение белка из водных растворов при высоких концентрациях соли) наиболее эффективно при ИЭТ белка. Обратный эффект — увеличение растворимости белка в присутствии солей — называют солевым растворением.
В результате гидратации белки растворяются и набухают. Растворению белка всегда предшествует процесс набухания. Оно характерно для всех высокомолекулярных соединений и никогда не наблюдается у низкомолекулярных веществ.
Процесс растворения условно можно разделить на четыре стадии. В первой стадии до начала растворения система состоит из чистых компонентов: низкомолекулярной жидкости и полимера (белка). Вторая стадия процесса — набухание — заключается в том, что молекулы жидкости проникают в погруженный в нее белок, раздвигают полипептидные цепочки и разрыхляют его. Расстояние между молекулами в белке, а также его масса и объем увеличиваются. Третья стадия растворения заключается в' том, что по мере набухания объем белка и расстояние между макромолекулами увеличиваются настолько, что макромолекулы начинают отрываться друг от друга и переходить в слой низкомолекулярной жидкости. В четвертой стадии растворения молекулы полимера равномерно распределены по всему объему системы, образуя истинный гомогенный раствор.
Набухание, как и растворение, носит избирательный характер. Белки (полярные полимеры) хорошо набухают в полярных жидкостях. Например, желатин хорошо набухает в воде.
Скорость набухания зависит от температуры. Однако существуют определенные температурные интервалы, в которых белок под воздействием тепла денатурирует, а следовательно, теряет способность к гидратации и набуханию. Скорость набухания увеличивается с увеличением степени измельченности полимера, так как это вызывает увеличение поверхности соприкосновения набухающего вещества с растворителем. На степень и скорость набухания влияет возраст белка: чем он меньше, тем степень и скорость набухания больше. Скорость и степень набухания некоторых белков зависят от рН среды. Например, белки муки набухают лучше при рН < 7, т. е. в кислой среде. Эту зависимость к набуханию от величины рН используют в процессе приготовления некоторых пищевых продуктов, например при производстве слоеного теста.
Дополнительная гидратация белков имеет большое практическое значение при производстве мясных рубленых полуфабрикатов, когда к измельченному мясу добавляют воду, поваренную соль и другие компоненты. При перемешивании этих компонентов процесс гидратации белков состоит из накладывающихся друг на друга двух процессов: растворения одних белков и набухания других с образованием студней. При этом повышается липкость массы, в результате чего она хорошо формуется в виде полуфабрикатов, предназначенных для тепловой обработки.
Фарш представляет собой сложную полидисперсную систему, в которой роль дисперсионной среды выполняет водный раствор белков, низкомолекулярных органических и неорганических веществ, а дисперсной фазой служат обрывки (частицы) мышечной, соединительной и жировой тканей, а также хлеба и других компонентов. Частицы в фарше связаны между собой молекулярными силами сцепления и образуют сплошную объемную сетку или своеобразный пространственный каркас. Одновременно частицы взаимодействуют и с дисперсионной средой, с которой они составляют единое целое, причем часть дисперсионной среды связана с частицами дисперсной фазы прочнее, чем частицы между собой.
Важной характеристикой сырого фарша является липкость, которая зависит от количества белка, находящегося в растворенном состоянии в водяной фазе. Липкость определяет связность структуры готового фарша.
Свойства мясного фарша зависят от его состава, степени измельчения, влажности, природы и концентрации растворенных в воде веществ, водосвязывающей способности компонентов и прочности связи между дисперсными частицами.
Степень измельчения мясного сырья определяет характер разрушения клеточной структуры и переход в окружающую среду содержимого клеток, а также величину дисперсных частиц.
При увеличении степени измельчения возрастают дисперсность частиц и доля растворенного белка в дисперсионной среде, что повышает водосвязывающую способность фарша. Последняя зависит также от качества исходного мясного сырья, и в первую очередь от его рН. Мясо с высоким значением рН (6,2 и более) способно удерживать значительное количество воды. Увеличение доли прочносвязанной белками воды приводит к нарастанию прочностных свойств в системе, что нежелательно, поэтому количество воды, добавляемой при приготовлении фарша, должно быть таким, чтобы сырой фарш хорошо формовался, а готовое изделие было нежным и сочным. При выработке мясных рубленых полуфабрикатов количество воды определяется рецептурой, но для получения готового изделия высокого качества необходимо учитывать качество мясного сырья и добавок (их водосвязывающую способность).
Сухие белки муки, круп, бобовых, содержащиеся в продуктах в виде частиц высохшей протоплазмы и алейроновых зерен, при контакте с водой набухают, образуя сплошной более или менее обводненный студень. Классическим примером гидратации такого типа является приготовление теста, в процессе которого белки муки при контакте с водой набухают, образуя клейковину. Реологические свойства теста, приготовленного на основе муки и воды, в значительной мере зависят от соотношения этих компонентов. Изменяя это соотношение, регулируют степень гидратации белков муки и связанные с этим процессом такие свойства теста, как эластичность, вязкость и др.
От степени гидратации белков в значительной мере зависит такой показатель качества готовой продукции, как сочность, и связанные с ней другие критерии органолептической оценки. При оценке роли гидратационных процессов необходимо иметь в виду, что в пищевых продуктах наряду с адсорбционной водой, прочно связанной с белками, содержится большее или меньшее количество осмотически и капиллярно-связанной воды, которая также оказывает влияние на качество продукции.
Потеря белками связанной воды происходит под влиянием внешних воздействий. Различают необратимую дегидратацию белков, происходящую при замораживании, хранении в замороженном состоянии и размораживании мяса, мясопродуктов, рыбы, при тепловой обработке продуктов, и обратимую дегидратацию, являющуюся составной частью целенаправленного технологического процесса — сублимационной сушки продуктов.
При быстром размораживании мяса дегидратация белков — это результат неполного восстановления белковых систем, нарушенных в период замораживания. Дегидратация белков рыбы связана с денатурацией их при замораживании и последующем хранении. При размораживании этих продуктов часть воды выделяется в окружающую среду в капельно-жидком состоянии. Вместе с водой из продукта удаляются растворимые вещества — экстрактивные, минеральные, витамины, белки и др.
Необратимая дегидратация белков с выделением воды в окружающую среду происходит, например, при варке мяса. В окружающую среду переходит около половины содержащихся в продукте воды и растворимых веществ.
При выпечке изделий из теста возникают денатурация и дегидратация белков клейковины. Однако вода в этом случае не выделяется в окружающую среду, а поглощается клейстеризующимся крахмалом муки.
Таким образом, необратимая дегидратация белков может быть причиной уменьшения массы продукта, некоторого снижения его пищевой ценности, в том числе и органолептических показателей.
Обратимую дегидратацию белковых веществ можно продемонстрировать на примере сублимационной сушки пищевых продуктов. Метод сублимационной сушки основан на способности льда при определенных условиях возгоняться, т. е. испаряться, минуя жидкую фазу. При обычной тепловой сушке влага с наружной поверхности материала испаряется, а из внутренних слоев непрерывно перемещается к наружным, вызывая перераспределение водорастворимых веществ, солей, витаминов и др. При сублимационной сушке такого перераспределения не происходит.
Сублимация льда начинается с поверхности материала, затем зона сублимации углубляется. Лед испаряется внутри продукта в зоне испарения, а водяной пар, преодолевая сопротивление сухого слоя, по капиллярам и трещинам прорывается в разреженное пространство сушильной камеры (сублиматора), а затем конденсируется и затвердевает в десублиматоре. Движение пара внутри материала обусловлено разностью давлений в сушильной камере (сублиматоре) и конденсаторе (десублиматоре).
В процессе сублимационной сушки из продукта удаляется капиллярно-связанная и осмотически связанная вода. Вода, адсорбционно-связанная белками, удаляется из продукта не полностью, так как ее мономолекулярный слой, располагающийся на поверхности белковых молекул, очень прочно связан с белком. Рентгеноструктурными исследованиями установлено, что каждая полярная группа белка прочно удерживает определенное число молекул воды. Эта вода, получившая название «гидратная», может быть удалена только при нагревании продукта до 100 °С и выше, что приводит к денатурации белка. Количество гидратной воды может достигать 5 % массы сухого белка.
Сухая возгонка льда непосредственно в пар способствует сохранению формы высушиваемого продукта. Усадки продукта, которая наблюдается при тепловой сушке, не происходит, и он после сушки сохраняет свои линейные размеры. По мере сушки образуется сухой высокопористый продукт, представляющий собой каркас с ячейками, равными по величине кристаллам испарившегося льда или несколько больших размеров.
Преимущество этого метода сушки заключается в том, что продукт после обработки сохраняет свои исходные свойства (вкус, цвет, аромат, консистенцию, содержание витаминов, ферментов и т. д.) и быстро (за 5... 15 мин) восстанавливается при добавлении воды. К достоинствам метода относится также то, что масса высушенного продукта составляет 1/4... 1/7 начальной, что выгодно при дальних перевозках; продукт не требует холодильного хранения; сроки хранения продуктов возрастают; имеется возможность реализации продукции через торговые автоматы.
Кроме пищевых продуктов сублимации можно подвергать также готовые к употреблению блюда. Высушенные этим способом блюда обладают рядом достоинств: высокие вкусовые качества и пищевая ценность; минимум времени на приготовление; их можно употреблять в любых условиях, в том числе в условиях космических полетов и чрезвычайных ситуаций.
Блюда, высушенные методом сублимации, восстанавливают двумя способами: продукт заливают кипящей водой и варят при слабом кипении 5... 10 мин с момента закипания, жир добавляют по рецептуре; продукт заливают кипящей водой, оставляют для набухания на 5...8 мин и кипятят 6... 10 мин при осторожном помешивании. Высушенные сублимацией свежие ягоды и плоды восстанавливают путем погружения в холодную кипяченую воду на 5...8 мин.
Восстановление водой продуктов сублимационной сушки называют регидратацией.
В настоящее время разработаны рецептуры, технология производства и режимы сушки методом сублимации некоторых блюд, в том числе щей из свежих овощей с мясом; супа перлового с грибами; борща из свежих овощей с мясом; рассольника с фасолью и мясом; рагу овощного с мясом; голубцов ленивых с говяжьим фаршем; творога с черносмородиновым пюре и др.
Дата добавления: 2014-10-31; просмотров: 472; Мы поможем в написании вашей работы!; Нарушение авторских прав |