
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение молекулярной массы диоксида углерода
Приборы, посуда и реактивы: аппарат Киппа (с двумя промывными склянками); технохимические весы с разновесами; термометр комнатный; барометр; резиновое кольцо; сухая плоскодонная колба ёмкостью 250 мл с пробкой; мерный цилиндр на 300-500 мл; мрамор кусковой; соляная кислота (1:6); серная кислота (концентрированная); гидрокарбонат натрия (насы-щенный раствор).


Установка для получения и очистки диоксида углерода
Ход работы
На технохимических весах взвесить сухую колбу с воздухом, закрытую пробкой (масса m1). Пробка должна быть вдвинута в горлышко колбы до метки (резиновое кольцо). Опустить в колбу стеклянную трубку, подводящую диоксид углерода из аппарата Киппа, открыть кран аппарата и медленно пропускать диоксид углерода в течение 7-8 мин. Закрыть колбу пробкой до метки и взвесить (m2). Вновь пропускать диоксид углерода 3-4 мин, а затем взвесить (m2). Если результаты двух последних взвешиваний равны или отличаются друг от друга не более чем на 0,01 г, то наполнение колбы считать законченным. В противном случае повторить наполнение и добиться постоянного результата взвешивания. Отметить температуру по комнатному термометру и давление - по барометру.
Определить объём колбы, наполнив её водой до метки, затем измерить объём воды мерным цилиндром и записать результаты в таблицу:
| Масса колбы с воздухом и пробкой, г | Масса колбы с CO2 и пробкой, г | Объём колбы, V мл | Температура, °С | Давление, Р мм рт. ст. |
Обработка результатов
1. Объём воздуха в колбе V следует привести к нормальным
условиям (То = 273 К, Ро = 760 мм рт. ст.) по формуле:
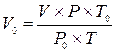 ,
,
где V - объём колбы, Р - атмосферное давление, Т - температура, К.
2. Вычислить массу воздуха m4, который находился в колбе, зная, что масса 1 л воздуха при нормальных условиях равна 1,29 г.
3. По разности (m1 – m4) вычислить массу пустой колбы с пробкой (m3).
4. По разности (m2 – m3) найти массу углекислого газа в колбе (m5).
5. Из найденных масс m4 и m5 определить относительную плотность диоксида углерода по воздуху: Dвозд = m5 / m4 .
6. Вычислить молекулярную массу углекислого газа (с точностью до 0,01 г):
а) по относительной плотности – M1, М1 = 29 × Dвозд;
б) по уравнению Менделеева-Клапейрона, М2, г;
в) по закону Авогадро, М3, г.
7. Определить среднюю молекулярную массу, Мср., г:
Мср. = (M1 + M2 + M3)/3.
8. Определить абсолютную и относительную ошибки опыта. Составить уравнение реакции получения диоксида углерода.
Контрольные вопросы
1. Какие законы относят к основным стехиометрическим законам химии? В чем их сущность?
2. Какие величины характеризуют газовое состояние? Каковы единицы измерения массы, объёма, давления, температуры?
3. Что называется плотностью газа по воздуху? Как можно вычислить молекулярную массу вещества, зная плотность его паров по воздуху?
4. Какой вид примет формула для расчёта молекулярной массы газа, если относительную плотность его определить по азоту или по диоксиду углерода?
Дата добавления: 2014-11-13; просмотров: 506; Мы поможем в написании вашей работы!; Нарушение авторских прав |