
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Тангенциальная составляющая ускорения 10 страница. где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:

где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы:

В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа, будет равнасумме кинетических энергий Na молекул:
 (50.1)
(50.1)
Внутренняя энергия для произвольной массы т газа.

где М — молярная масса, n — количество вещества.
§ 51. Первое начало термодинамики
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется лишь ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате различных процессов, например совершения над системой работы или сообщения ей теплоты. Так, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым изменяется (увеличивается) внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты — энергии, переданной системе внешними телами путем теплообмена (процесс обмена внутренними энергиями при контакте тел с разными температурами).
Таким образом, можно говорить о двух формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных.

Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа — положительной, когда система совершает ее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии DU=U2–U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой А, совершенной системой против внешних сил:

или
 (51.1)
(51.1)
Уравнение (51.1) выражаетпервое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (51.1) в дифференциальной форме будет иметь вид

или в более корректной форме
 (51.2)
(51.2)
где dU — бесконечно малое изменение внутренней энергии системы, dA — элементарная работа, dQ — бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а dA и dQ таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии DU=0. Тогда, согласно первому началу термодинамики,

т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы бóльшую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).
§ 52. Работа газа при изменении его объема
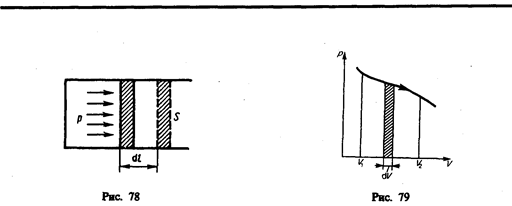
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу

где S — площадь поршня, Sdl=dV— изменение объема системы. Таким образом,
 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (52.1):
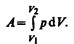 (52.2)
(52.2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается кривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием dV, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2, определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2.
Графически можно изображать только равновесные процессы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
§ 53. Теплоемкость
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:

Единила удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг × К)).
Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
 (53.1)
(53.1)
где n=m/М—количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль × К)).
Удельная теплоемкость с связана с молярной Сm, соотношением
 (53.2)
(53.2)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики (51.2) для 1 моль газа с учетом формул (52.1) и (53.1):
 (53.3)
(53.3)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (52.1)) и сообщаемая газу извне теплота вдет только на увеличение его внутренней энергии:
 (53.4)
(53.4)
т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Согласно формуле (50.1), 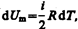 тогда
тогда
 (53.5)
(53.5)
Если газ нагревается при постоянном давлении, то выражение (53.3) можно записать в виде

Учитывая, что  не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p=const), получаем
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (53.4)), и дифференцируя уравнение Клапейрона — Менделеева pVm=RT (42.4) по T (p=const), получаем
 (53.6)
(53.6)
Выражение (53.6) называетсяуравнением Майера; оно показывает, что Ср всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, таккак постоянство давления обеспечивается увеличением объема газа. Использовав (53.5), выражение (53.6) можно записать в виде
 (53.7)
(53.7)
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение Сp к СV :
 (53.8)
(53.8)
Из формул (53.5) и (53.7) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов.Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
По закону равномерного распределения энергии по степеням свободы (см. § 50), для комнатных температур СV = 7/2 R. Из качественной экспериментальной зависимости молярной теплоемкости СV водорода (рис. 80) следует, что СV зависит от температуры: при низкой температуре (»50 К) СV =3/2 R, при комнатной — CV = 5/2R (вместо расчетных 7/2R) и при очень высокой — Сv=7/2 R. Это можно объяснить, предположив, что при низких температурах наблюдается только поступательное движение молекул, при комнатных — добавляется их вращение, а при высоких — к этим двум видам движения добавляются еще колебания молекул.
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы «замораживается» — к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа — водорода — при комнатной температуре равна 5/2 R вместо 7/2R. Аналогично можно объяснить уменьшение теплоемкости при низкой температуре («замораживаются» вращательные степени свободы) и увеличение при высокой («возбуждаются» колебательные степени свободы).
§ 54. Применение первого начала термодинамики к изопроцессам
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V=const). Диаграмма этого процесса(изохора)в координатах р, V изображается прямой, параллельной оси ординат (рис. 81), где процесс 1—2 есть изохорное нагревание, а 1—3 — изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т. е.

Как уже указывалось в § 53, из первого начала термодинамики (dQ=dU+dA) для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:

Согласно формуле (53.4),

Тогда для произвольной массы газа получим
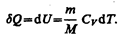 (54.1)
(54.1)

Изобарный процесс (p=const). Диаграмма этого процесса (изобара) в координатах р, V изображается прямой, параллельной оси V. При изобарном процессе работа газа (см. (52.2)) при увеличения объема от V1 до V2 равна
 (54.2)
(54.2)
и определяется площадью заштрихованного прямоугольника (рис. 82). Если использовать уравнение (42.5) Клапейрона — Менделеева для выбранных нами двух состояний, то

откуда

Тогда выражение (54.2) для работы изобарного расширения примет вид
 (54.3)
(54.3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 =1 К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой т количества теплоты

его внутренняя энергия возрастает на величину (согласно формуле (53.4))

При этом газ совершит работу, определяемую выражением (54.3).
Изотермический процесс (T=const). Как уже указывалось § 41, изотермический процесс описывается законом Бойля—Мариотта:

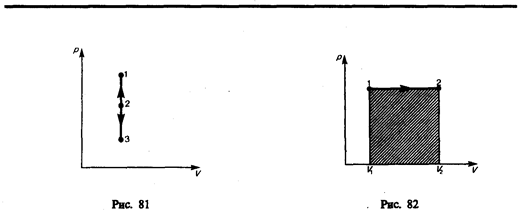
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу (см. рис. 60), расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из выражений (52.2) и (42.5) найдем работу изотермического расширения газа:
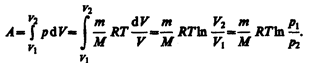
Так как при Т=const внутренняя энергия идеального газа не изменяется:

то из первого начала термодинамики (dQ=dU+dA) следует, что для изотермического процесса

т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
 (54.4)
(54.4)
Следовательно, для того чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.

§ 55. Адиабатический процесс. Политропный процесс
Адиабатическим называется процесс, при котором отсутствует теплообмен (dQ=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
Из первого начала термодинамики (dQ=dU+dA) для адиабатического процесса следует, что
 (55.1)
(55.1)
т. е. внешняя работа совершается за счет изменения внутренней энергии системы.
Используя выражения (52.1) и (53.4), для произвольной массы газа перепишем уравнение (55.1) в виде
 (55.2)
(55.2)
Продифференцировав уравнение состояния для идеального газа  получим
получим
 (55.3)
(55.3)
Исключим из (55.2) и (55.3) температуру Т.

Разделив переменные и учитывая, что Сp/СV=g (см. (53.8)), найдем

Интегрируя это уравнение в пределах от p1 до p2 и соответственно от V1 до V2, а затем потенцируя, придем к выражению

Так как состояния 1 и 2 выбраны произвольно, то можно записать
 (55.4)
(55.4)
Полученное выражение естьуравнение адиабатического процесса, называемое также уравнением Пуассона.
Для перехода к переменным Т, V или p, Т исключим из (55.4) с помощью уравнения Клапейрона — Менделеева

соответственно давление или объем:
 (55.5)
(55.5)
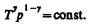 (55.6)
(55.6)
Выражения (55.4) — (55.6) представляют собой уравнения адиабатического процесса. В этих уравнениях безразмерная величина (см. (53.8) и (53.2))
 (55.7)
(55.7)
называетсяпоказателем адиабаты (иликоэффициентом Пуассона). Для одноатомных газов (Ne, He и др.), достаточно хорошо удовлетворяющих условию идеальности, i=3, g=1,67. Для двухатомных газов (Н2, N2, О2 и др.) i=5, g=1,4. Значения g, вычисленные по формуле (55.7), хорошо подтверждаются экспериментом.
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой (рис. 83). На рисунке видно, что адиабата (pVg = const) более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии 1—3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Вычислим работу, совершаемую газом в адиабатическом процессе. Запишем уравнение (55.1) в виде

Если газ адиабатически расширяется от объема V1 до V2, то его температура уменьшается от T1 до T2 и работа расширения идеального газа
 (55.8)
(55.8)
Применяя те же приемы, что и при выводе формулы (55.5), выражение (55.8) для работы при адиабатическом расширении можно преобразовать к виду

где  .
.
Работа, совершаемая газом при адиабатическом расширении 1—2 (определяется площадью, заштрихованной на рис. 83), меньше, чем при изотермическом. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом — температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
Рассмотренные изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и Сp, в изотермическом процессе (dT=0) теплоемкость равна ±¥, в адиабатическом (dQ=0) теплоемкость равна нулю. Процесс, в котором теплоемкость остается постоянной, называется политропным.

Исходя из первого начала термодинамики при условии постоянства теплоемкости (C=const) можно вывести уравнение политропы:
 (55.9)
(55.9)
где п=(С—Сp)/(С—СV)—показатель политропы. Очевидно, что при С=0, n=g, из (55.9) получается уравнение адиабаты; при С = ¥, n = 1 — уравнение изотермы; при С=Сp, n=0 —уравнение изобары, при С=СV, n=±¥ — уравнение изохоры. Таким образом, все рассмотренные процессы являются частными случаями политропного процесса.
§ 56. Круговой процесс (цикл). Обратимые и необратимые процессы
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. На диаграмме процессов цикл изображается замкнутой кривой (рис. 84). Цикл, совершаемый идеальным газом, можно разбить на процессы расширения (1—2) и сжатия (2—1) газа. Работа расширения (определяется площадью фигуры 1a2V2V11) положительна (dV>0), работа сжатия (определяется площадью фигуры 2b1V1V22) отрицательна (dV<0). Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой. Если за цикл совершается положительная работа A=  >0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа A=
>0 (цикл протекает по часовой стрелке), то он называется прямым (рис. 84, а), если за цикл совершается отрицательная работа A=  <0 (цикл протекает против часовой стрелки), то он называется обратным (рис. 84, б).
<0 (цикл протекает против часовой стрелки), то он называется обратным (рис. 84, б).
Прямой цикл используется в тепловых двигателях — периодически действующих двигателях, совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах — периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики (51.1) для кругового процесса
 (56.1)
(56.1)
т. е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому

где Q1 — количество теплоты, полученное системой, Q2 — количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса
 (56.2)
(56.2)

Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среда и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что се любое промежуточное состояние есть состояние термодинамического равновесия; для него «безразлично», идет процесс в прямом или обратном направлении. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т. д.), которая нами не обсуждается. Обратимые процессы — это идеализация реальных процессов. Их рассмотрение важно по двум причинам: 1) многие процессы в природе и технике практически обратимы; 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения к. п. д. реальных тепловых двигателей.
§ 57. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное количество теплоты, сообщаемое телу на бесконечно малом участке процесса, равно dQ/T. Строгий теоретический анализ показывает, что приведенное количество теплоты, сообщаемое телу в любом обратимом круговом процессе, равно нулю:
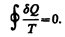 (57.1)
(57.1)
Из равенства нулю интеграла (57.1), взятого по замкнутому контуру, следует, что подынтегральное выражение dQ/T есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от пути, каким система пришла в это состояние. Таким образом,
 (57.2)
(57.2)
Функция состояния, дифференциалом которой является dQ/T, называется энтропией и обозначается S.
Из формулы (57.1) следует, что для обратимых процессов изменение энтропии
 (57.3)
(57.3)
В термодинамике доказывается, что энтропия системы, совершающей необратимый цикл, возрастает:
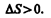 (57.4)
(57.4)
Выражения (57.3) и (57.4) относятся только к замкнутым системам, если же система обменивается теплотой с внешней средой, то ее энтропия может вести себя любым образом. Соотношения (57.3) и (57.4) можно представить в виде неравенства Клаузиуса
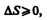 (57.5)
(57.5)
т. е. энтропия замкнутой системы может либо возрастать (в случае необратимых процессов), либо оставаться постоянной (в случае обратимых процессов).
Если система совершает равновесный переход из состояния 1 в состояние 2, то, согласно (57.2), изменение энтропии
Дата добавления: 2014-10-31; просмотров: 348; Мы поможем в написании вашей работы!; Нарушение авторских прав |