
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Адсорбция
Процесс самопроизвольного концентрирования газов или растворенных веществ на поверхности раздела фаз называют адсорбцией. В зависимости от природы контактирующих фаз различают адсорбцию на границах: газ - твердое тело, газ – жидкость, жидкость - твердое тело и жидкость - жидкость.
Еще в 1785 г русский ученый Т.Е. Ловиц открыл способность угля поглощать растворенное вещество. С тех пор изучению явлений адсорбции было посвящено много работ, среди которых первостепенное значение имеют работы русских ученых: академика Н.Д.Зелинского, предложившего уголь в качестве универсального средства защиты от газообразных отравляющих веществ; М.С.Цвета, разработавшего хроматографический метод разделения веществ по их адсорбционной способности; академика К.К. Гедройца, создавшего учение о поглотительной способности почв; академика М.М. Думанского, разработавшего методику получения активных адсорбентов. Очень много для разработки теории и практики адсорбции сделали зарубежные ученые Гиббс, Ленгмюр, Фрейндлих, Поляни, Бранауэр и др.
Адсорбция является следствием снижения ненасыщенности молекулярных, атомных или ионных сил на поверхности раздела фаз и обусловлена накоплением вещества, снижающего свободную поверхностную энергию. Адсорбция – процесс самопроизвольный, т.к. в результате процесса адсорбции происходит уменьшение свободной поверхностной энергии, а по второму закону термодинамики такие процессы являются самопроизвольными.
Вещества, которые адсорбируются, называют адсорбатами (иногда - адсорбтивами), а вещества, которые адсорбируют на своей поверхности - адсорбентами.
В зависимости от характера сил, действующих между частицами (молекулы, атомы, ионы) адсорбата и адсорбента, различают физическую или ван-дер-ваальсову адсорбцию и химическую или хемосорбцию.
Природу адсорбции можно установить, исследовав её кинетику и энергетику. Действительно, физическая адсорбция происходит под влиянием относительно слабых межмолекулярных сил сцепления (сил Ван-дер-Ваальса) и по своей природе аналогична процессам конденсации паров адсорбата, теплота её близка к теплотам конденсации и составляет 10 - 50 кДж/моль. Поэтому при увеличении температуры физическая адсорбция уменьшается.
Хемосорбция связана с перекрыванием электронных орбиталей частиц адсорбата и адсорбента, т.е. вызывается их химическим взаимодействием, не приводящим, однако, к образованию объемной фазы. Теплота хемосорбции соизмерима с теплотами химических реакций и составляет обычно 60 - 600 кДж/моль. Химическая адсорбция с увеличением температуры увеличивается.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией.
Различают молекулярную и ионную хемосорбцию в зависимости от того, что адсорбируется – молекулы или ионы вещества. В свою очередь, ионная адсорбция делится на обменную и адсорбцию потенциалопределяющих ионов.
Обменная адсорбция. Обменная адсорбция протекает на границе твердое тело / раствор электролита и состоит в том, что адсорбент и раствор обмениваются между собой катионами или анионами в эквивалентных количествах, благодаря чему принцип электронейтральности раствора электролита и адсорбента остается ненарушенным.
Основными факторами обменной адсорбции, определяющими ее специфичность, являются: наличие двойного электрического слоя на поверхности твердого адсорбента, валентность, величина радиуса и степень гидратации ионов раствора электролита.
Обменная адсорбция протекает несколько медленнее, чем обычная.
Для уяснения процесса обменной адсорбции можно рассмотреть процесс образования двойного электрического слоя при взаимодействии частицы хлористого серебра с раствором хлорида калия. Ионы хлора, сталкиваясь с частицами [AgCl]n будут соединяться с ионами серебра, образуя прочно удерживаемый слой С1- ионов, тем самым заряжая поверхность частицы. Такие ионы получили название потенциалопределяющих, а т.к. присоединившиеся С1- -ионы увеличивают свою концентрацию, т.е. адсорбируются на поверхности, то такой вид адсорбции называется адсорбцией потенциалопределяющих ионов.
Адсорбированные С1--ионы заряжают частицу отрицательно, и под действием электростатических сил притяжения будет увеличиваться количество К+-ионов, прилегающих к поверхности частицы. Другими словами, будет происходить адсорбция противоионов под действием электростатических сил. Так как К+-ионы могут быть заменены другими ионами такого же знака, взаимодействующими с частицей лишь электростатически, такие ионы называются обменными, адсорбция их - обменной.
Таким образом, обменная адсорбция происходит в процессе обмена ионов двойного электрического слоя адсорбента и ионов раствора. Схематически это можно представить следующими уравнениями:
Адсорбент-½Н+ + Na+ + Cl- à Адсорбент-½Na+ + H+ +Cl-
Адсорбент+ ½OH- + Na+ + Cl- à Адсорбент+½Cl- + Na+ + OH-
Из приведенной схемы видно, что в ходе адсорбции ионов может изменяться рН среды (в раствор переходят H+ или OH- ионы), раствор приобретает кислую или щелочную реакцию, такой вид адсорбции называется гидролитический.
Так как обменная адсорбция является химической, то обмен ионов происходит в строго эквивалентных соотношениях.
Обменные ионы на твердой поверхности обладают определенной величиной и знаком заряда, поэтому, чтобы не нарушался двойной электрический слой (ДЭС), обменными ионами из раствора, могут быть только ионы одного и того же знака. При этом не должна изменяться и величина заряда поверхности. Таким образом, обменная адсорбция может быть только анионообменной или катионообменной.
Явления обменной адсорбции играют важную роль в процессах, происходящих в почвах. Обменным комплексом почв является почвенный поглощающий комплекс (ППК), состоящий из коллоидных частиц, заряженных отрицательно. Обменными ионами почвы являются катионы. Важнейшие свойства почвы: водопроницаемость, влагоемкость, набухаемость, структура, рН почвенного раствора и др. – определяются составом адсорбированных ионов. Например, почвы, содержащие в составе обменных катионов значительное количество ионов натрия, приобретают особые, так называемые, “солонцовые свойства”. Они отличаются высокой дисперсностью, плотным сложением, высокой щелочностью, повышенной набухаемостью и вязкостью, малой водопроницаемостью. Эти почвы трудно обрабатываются и, несмотря на большой запас питательных веществ, мало плодородны. Если же в состав обменных катионов почвы входят преимущественно ионы кальция, то такие почвы обладают хорошей структурой, малой распыленностью, хорошей водо- и воздухопроницаемостью. Эти почвы относятся к наиболее плодородным. Примером почв с большим содержанием обменного кальция и прекрасными физико-химическими свойствами являются черноземные почвы.
Ионообменные процессы в почвах можно представить следующей схемой:
[ППК]-2Na+ + Са2+ + SO42- = [ППК]- Cа2+ + Na2SO4
Б.П. Никольский и Е.Н. Гапон предложили уравнение, описывающее обменную адсорбцию:
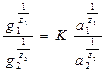
Здесь g1 и g2 – количество г-моль (г-экв) адсорбированных и десорбированных ионов единицей массы адсорбента, а1 и а2 – активности обменивающихся ионов в растворе при равновесии; z1 и z2 – заряд ионов, К – константа данного адсорбционного процесса.
Явление адсорбции находит широкое применение в промышленности и сельском хозяйстве. Так, на активированном угле производят адсорбционную очистку (рафинирование) сиропа сахарозы. Именно силы адсорбции удерживают ионы минеральных удобрений (К+, РО4-3и т.п.) и молекулы (мочевины) в почве. Адсорбция мочевины физическая, молекулы её слабо удерживаются почвой. Поэтому мочевину, чтобы её не вынесло весенним паводком, вносят обычно весной. Калийные удобрения можно вносить в почву и осенью, так как адсорбция ионов К+ вызывается химическими силами (ионные связи) и она прочная.
В общем случае адсорбция является функцией давления Р (для газов) или концентрации С (для жидких растворов) и температуры, т.е. изображается плоскостью в координатах Г = f(C,T). Обычно один из параметров поддерживают постоянным и адсорбцию графически изображают в виде кривых.
Количественная зависимость, устанавливаемая между адсорбентом и адсорбтивом при постоянной температуре в виде уравнения или кривой, называется изотермой адсорбции.
Cуществует несколько типов изотерм адсорбции - простейшими уравнениями для описания адсорбции являются уравнение Фрейндлиха и уравнение Ленгмюра.
Изотерма адсорбции по Фрейндлиху. Адсорбция растворенного вещества на твердой поверхности подчиняется определенной закономерности, согласно которой концентрация адсорбированного вещества возрастает не пропорционально его концентрации в растворе, а значительно медленнее, и пропорциональна корню n-ой степени из концентрации раствора. Эта зависимость при постоянной температуре может быть представлена следующем уравнением:
Х/m = К С1/n
где Х – количество (моль) вещества, адсорбированного m г адсорбента: С- равновесная концентрация; К и 1/n – эмпирические константы, характерные для данных адсорбента и адсорбата, значение 1/n колеблется между 0,1 – 0,7. Данное уравнение известно под названием изотермы адсорбции и имеет вид параболы.
Для графического построения изотермы адсорбции по Фрейндлиху на оси абсцисс откладывается равновесная концентрация в ммоль/л, а на оси ординат – величина адсорбции на единицу поверхности Х/m в ммоль/грамм. На рисунке 7 показано графическое изображение уравнения Фрейндлиха.
 |
Рис. 7. Изотерма адсорбции по Фрейндлиху Рис.8. Графическое определение постоянных адсорбции уравнения Фрейндлиха
Логарифмируя данное уравнение, можно найти значения постоянных К и 1/n:
lg X/m = lg K + 1/n lg C
Если на абсциссе отложить величину lg C, а на ординате – величину lg X/m, то мы получаем прямую, отсекающую на оси ординат отрезок, равный lgК, а тангенс угла наклона этой прямой к абсциссе дает значение 1/n.
Графически значение 1/n находят следующим образом: из точки lgС = 1 восстанавливают перпендикуляр к прямой. Из точки пересечения опускают перпендикуляр на ось ординат – точка lgХ1
1/n будет равна разности (lgХ1 - lgК), где lgХ1 –ординаты точки, абсцисса которой lgС1 = 1 (рис. 8). Уравнение Фрейндлиха находит широкое применение, но имеет и ряд недостатков, т.к. применимо только в области средних концентраций.
Изотерма адсорбции по Ленгмюру. В 1917 году Ленгмюр предложил более удобное уравнение адсорбции, которое выведено им на основании молекулярно-кинетической теории газов.
Изотерма адсорбции по Ленгмюру является уравнением гиперболы и может быть представлена в виде:
Г = Г¥ × 
где Г – величина адсорбции на единицу поверхности; Г¥ - предельное количество вещества, адсорбированного единицей поверхности при полном насыщении поверхности; С – равновесная концентрация. В уравнении Ленгмюра также имеются две константы - Г¥ и К. Графическое изображение изотермы адсорбции Ленгмюра представлено на рисунке 9.
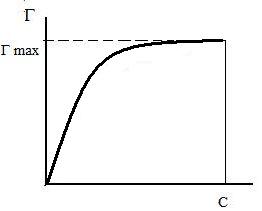 | 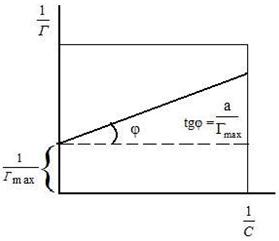 | ||
Рис. 9. Изотерма адсорбции по Ленгмюру Рис.10. Графическое определение постоянных адсорбции уравнения Ленгмюра
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Молекулы адсорбата поглощаются лишь на отдельных точках поверхности адсорбента. Эти точки – активные центры – обладают остаточными валентностями и способны связывать только одну молекулу адсорбата. Заполнение всех активных центров соответствует насыщению поверхности. Таким образом, насыщенный адсорбционный слой мономолекулярен, т.е. только один слой молекул связан силами молекулярного сцепления с поверхностью. На твердой поверхности при постоянной температуре устанавливается подвижное равновесие между молекулами, адсорбирующимися на поверхности, и молекулами, отрывающимися от поверхности. Концентрация адсорбата на момент установления динамического адсорбционного равновесия называется равновесной. Следовательно, активные центры удерживают адсорбированные молекулы только в течение определенного промежутка времени.
Вывод уравнения Ленгмюра основан на предположении о мономолекулярном слое адсорбированного вещества. Однако адсорбция может быть и многослойной, тогда уравнение изотермы адсорбции Ленгмюра становится неприменимой, более точными являются так называемые S-образные изотермы БЭТ (по фамилиям ученых Браунер, Эммет, Теллер), одна из которых представлена на рисунке 11. Изотерме адсорбции Ленгмюра соответствует только нижняя часть (ОА) кривой. S-образные изотермы и соответствующие им уравнения особенно часто используются для случаев адсорбции паров на твердых поверхностях.
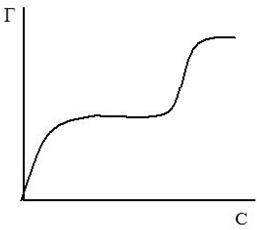 |
Рис.11. S-образная изотерма БЭТ
Практическое значение явлений адсорбции. Явления адсорбции находят широкое применение в промышленности, технике, биологии, медицине, ветеринарии. Так, например, с адсорбционными процессами мы встречаемся в химической и пищевой промышленности при сахароварении, очистке соков и вин, при ректификации спирта, в текстильной промышленности при крашении тканей.
Среди различных адсорбентов одно из первых мест занимает уголь. Древесный, костяной, кровяной и другие сорта углей получили широкое распространение как адсорбенты в самых различных областях.
Адсорбция широко используется в медицине с лечебными целями. Адсорбенты способны связывать многие ядовитые вещества, поэтому многие коллоиды применяют в качестве противоядий. Так, например, коллоидное железо употребляется при мышьяковом отравлении. Для этих же целей употребляются различные мелко растертые порошки, чаще всего животный и древесный уголь.
Явления адсорбции имеют большое биологическое значение. В организме имеется огромное количество поверхностей, на которых идут адсорбционные процессы. Это, во-первых, поверхности раздела между организмом и средой, затем поверхности стенок сосудов, разнообразнейшие мембраны, поверхности клеток, поверхности ядер, поверхности вакуолей и, наконец, поверхности коллоидных частиц протоплазмы. На всех этих поверхностях в процессе обмена веществ могут адсорбироваться различные вещества.
Если для высших организмов поверхность раздела между организмом и средой адсорбционной роли почти не играет, то для организмов, живущих в воде, особенно для низших организмов, эта поверхность имеет весьма существенное значение в процессах питания и проникновения пищевых веществ.
По исследованием Траубе поверхностно-активные вещества легко проникают в клетку, а пищевые вещества, как правило, поверхностно-активны. Поэтому, первым этапом усвоения, является адсорбция питательных веществ, после чего начинается процесс химического превращения.
Процессы обмена веществ в организме осуществляются посредством разнообразных специфических катализаторов-ферментов, являющихся коллоидами. Первые стадии действия фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие. Явления адсорбции широко распространены в жидкостях и тканях организма. Такие важные жизненные процессы как, питание, дыхание, выделение и другие процессы жизнедеятельности организма сопровождаются многообразными явлениями адсорбции.
Таким образом, если учесть огромнейшие величины поверхностей раздела у высших организмов и адсорбционные возможности этих поверхностей, то будет понятно все то значение, которое имеет адсорбция в процессах жизнедеятельности.
Дата добавления: 2014-11-13; просмотров: 377; Мы поможем в написании вашей работы!; Нарушение авторских прав |