
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химические реакции, протекающие в атмосфере
Атмосферные реакции осуществляются или при разрыве химических связей в молекулах, обусловленном поглощением солнечного излучения либо при разрыве (образовании новых) химических связей при столкновении молекул. Превращения первого типа называются фотохимическими реакциями и изучаются в атмосферной фотохимии. Химические превращения, инициированные столкновениями молекул, изучаются на основе химической кинетики. Закон сохранения массы является базовым физическим принципом, управляющим поведением реагентов в атмосфере. Для изменения количества одного выбранного реагента в выделенном объеме воздуха можно записать балансные соотношения:

Где 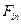 ,
,  - скорость вноса реагента в объем и выноса его через границу выделенного объема,
- скорость вноса реагента в объем и выноса его через границу выделенного объема,  ,
,  - скорость образования и уничтожения реагента в результате химических процессов происходящих внутри объема. Информативной характеристикой поведения реагента в атмосфере является время его жизни
- скорость образования и уничтожения реагента в результате химических процессов происходящих внутри объема. Информативной характеристикой поведения реагента в атмосфере является время его жизни 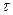

 ФОТОХИМИЧЕСКИЕ РЕАКЦИИпротекают под действием видимого света, ИК- и УФ-излучения с длинами волн от 100 до 1000 нм, энергия этих квантов колеблется от 120 до 1200 кДж/моль. Поглощение энергии электронного излучения усиливает вращение молекул или колебания атомов, и может приводить к возбуждению электронов внешних слоев и образованию частиц с избыточной электронной энергией, вступающих в определенные процессы, несвойственные обычным частицам.
ФОТОХИМИЧЕСКИЕ РЕАКЦИИпротекают под действием видимого света, ИК- и УФ-излучения с длинами волн от 100 до 1000 нм, энергия этих квантов колеблется от 120 до 1200 кДж/моль. Поглощение энергии электронного излучения усиливает вращение молекул или колебания атомов, и может приводить к возбуждению электронов внешних слоев и образованию частиц с избыточной электронной энергией, вступающих в определенные процессы, несвойственные обычным частицам.
Большая часть химически устойчивых молекул содержат четное число  , которые спарены, поэтому сумма их спиновых чисел равна нулю. Если общий спин равен S, то мультиплетность состояний равна 2S+1. При S=0 мультиплетность равна 1, и система синглетна (обозначается символом «S»). Фотовозбуждение переводит один электрон молекулы на более высокий энергетический уровень, где спины электронов могут быть антипараллельны и система останется синглетной. Однако возможны и такие переходы, когда спины электронов будут параллельны, мультиплетность равна 3, такое состояние системы называется триплетным и обозначается символом «Т».
, которые спарены, поэтому сумма их спиновых чисел равна нулю. Если общий спин равен S, то мультиплетность состояний равна 2S+1. При S=0 мультиплетность равна 1, и система синглетна (обозначается символом «S»). Фотовозбуждение переводит один электрон молекулы на более высокий энергетический уровень, где спины электронов могут быть антипараллельны и система останется синглетной. Однако возможны и такие переходы, когда спины электронов будут параллельны, мультиплетность равна 3, такое состояние системы называется триплетным и обозначается символом «Т».
Возбужденная молекула через некоторое время возвращается в нормальное состояние путем:
– излучения поглощенного фотона (излучательный переход) А*→ А + hν
– передачи энергии другой молекуле при столкновении (тушение) А* + М→А+М*
– превращение энергии в тепловую при столкновении (безызлучательный переход) А* + М→А + М + Q.
Также электронно-возбужденная молекула может вступить в реакцию, и тогда ее избыточная энергия переходит к продуктам реакции А*→ В + С.
Возможен переход в метастабильное состояние, если его энергия ниже энергии возбужденного синглетного состояния. Молекулы в метастабильном состоянии обладают избыточной энергией, а также имеют 2 свободные валентности и в результате более активны, чем обычные возбужденные молекулы.
Фотодиссоциацией (фотолизом) называется процесс: А + hν → В + С.
Скорость фотодиссоциации выражается уравнением:
 , где
, где
I – коэффициент фотодиссоциации (константа скорости фотодиссоциации), время-1.
Кроме фотодиссоциации возбужденной частицы может происходить ее окисление в атмосфере по двум направлениям:
– прямое фотоокисление;
– окисление, инициируемое реакционноспособными кислородсодержащими частицами.
Первые стадии фотоокисления в общем виде могут быть представлены следующими уравнениями:
АВ + hν → (АВ)* (1)
АВ)*+ О2 → АВ-ОО• → продукты (2)
(АВ)* →А* + В*  АОО• + ВОО•→ продукты (3)
АОО• + ВОО•→ продукты (3)
В тропосфере по данному пути могут превращаться в основном соединения, которые абсорбируют свет в ближней УФ- (290-400 нм) и видимой (400-800 нм) области электромагнитного спектра. При этом количество поглощенной энергии должно быть достаточным для последующей реакции с молекулярным кислородом либо для диссоциации возбужденной молекулы на радикалы. Большинство газовых компонентов при взаимодействии с проникающим в нижнюю тропосферу светом не образует возбужденных состояний, способных непосредственно реагировать с О2. Поэтому направление (2) для химии нижней атмосферы ограниченно, а направление (3) играет определенную роль в превращениях некоторых соединений.
В нижних слоях атмосферы значительную конкуренцию прямому окислению создают процессы с участием активных кислородсодержащих частиц.
Дата добавления: 2014-11-13; просмотров: 353; Мы поможем в написании вашей работы!; Нарушение авторских прав |