
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фотохимический смог в городской атмосфере
Различают две основных разновидности смога: вызванный загрязнением атмосферы копотью или дымом, включающим сернистый ангидрид SО2 (лондонский смог), и смог, обусловленный загрязнением выхлопными газами транспорта, включающими оксиды азота (лос-анджелесский смог). Смог лондонского типа возникает при сжигании угля и мазута в условиях высокой влажности. Происходит образование густого тумана с примесями частиц сажи и диоксида серы.
Необходимой составной частью процесса образования лос-анджелесского смога является протекание химических реакций, поэтому его также называют фотохимическим смогом. Фотохимический смог возникает только в солнечную погоду, в условиях низкой влажности воздуха. Образование лос-анджелесского смога наблюдается в виде голубоватой дымки, он действует раздражающе на дыхательные пути, обладает окислительными свойствами. Соединениями, определяющими данные свойства смога, в основном являются озон и пероксиацетилнитрат (ПАН). Повышение содержания озона в воздухе, содержащем автомобильные выхлопы, связано с определенными изменениями содержания оксидов азота. Рост концентрации О3 в пробах воздуха начинается после того, как соотношение СNO2 : CNO достигает максимума. Изменение концентрации озона в загрязненной городской атмосфере связано с процессами превращения оксидов азота.
Образование озона идет в 2 этапа:
NO2 + hν → NO + O(3P) (36)
О(3Р) + О2 + М → О3 + М*
Одним из главных химических путей О3 в тропосфере служит его реакция с NO:
О3 + NО → О2 + NО2 (37)
Установлено, что концентрация О3 будет расти при увеличении скорости конверсии NO в NO2, что может быть вызвано пероксильными радикалами:
NO + HO2• → NO2 + HO• (38)
NO + RO2• → NO2 + RO• (39)
Эти радикалы образуются при окислении СО:
СО + НО• → СО2 + Н (40)
Н• + О2 + М → НО2• + М* (41), а также при окислении углеводородов:
СН4 + НО• → СН3• + Н2О (42)
СН3• + О2 + М → СН3О2• + М* (43)
Окисление метана в «чистом» воздухе приводит к образованию формальдегида (процесс включает 6 стадий):
СН4 + О2 → СН2О + Н2О (44)
В присутствии NО общий результат окисления метана сильно будет значительно отличаться (процесс включает 13 стадий):
СН4 + 8О2 + 4М → СО2 + 2Н2О + 4М* + 4О3 (45)
В результате этого процесса идет накопление О3.
С присутствием органических соединений в воздухе городов связаны и процессы образования высокотоксичных пероксидных соединений, таких как ПАН. При окислении предельных углеводородов могут образовываться альдегиды (49), которые окисляются далее:
RCH=O + HO• → RC•=O + H2O (46)
RC•=O + O2 → RC(O)OO• (47)
Ацилпероксидный радикал окисляет монооксид азота, образует надкислоту при столкновении с НО2• или присоединяет NО2:
RC(O)O2• + NO → RC(O)O• + NO2 (48)
RC(O)O2• + HO2• → RC(O)OH + O2 (49)
RC(O)O2• + NO2→ RC(O)OONO2 (50)
Последняя реакция приводит к пероксиацилнитратам, например,
 или
или 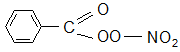
Дата добавления: 2014-11-13; просмотров: 402; Мы поможем в написании вашей работы!; Нарушение авторских прав |