
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. При решении задач этого раздела следует пользоваться табл
При решении задач этого раздела следует пользоваться табл. Б. 1.
Пример 3.1.Вычислить тепловой эффект и написать термохимическое уравнение реакции горения ацетилена, в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 10 л ацетилена при нормальных условиях?
Решение. Реакция горения ацетилена протекает по уравнению
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г).
Пользуясь следствием из закона Гесса и справочными данными из табл. Б.1, вычисляем тепловой эффект реакции:
 ,
,
DH°х.р. = [2(–393,5) + (–241,8)] − [226,8 + 5½∙0] = –1255,6 кДж.
Термохимическими называются уравнения химических реакций, в которых указано изменение энтальпии. Изменение энтальпии (тепловой эффект) записывают в правой части уравнения после запятой.
Термохимическое уравнение реакции горения ацетилена имеет вид:
С2Н2 (г) + 5½О2 (г) = 2СО2 (г) + Н2О (г), DH°х.р. = –1255,6 кДж.
Тепловой эффект обычно относят к одному молю вещества. Следовательно, при сжигании 1 моль С2Н2 выделяется 1255,6 кДж. Однако по условию задачи сжигается 10 л ацетилена, что составляет 10/22,4 = 0,446 моль С2Н2, где 22,4 л/моль – мольный объем любого газа при нормальных условиях. Таким образом, при сгорании 0,446 моль (10 л) С2Н2 выделится 0,446×(1255,6) = 560 кДж теплоты.
Пример 3.2. Реакция идет по уравнению Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к).
При восстановлении 48 г Fe2O3 выделяется 256,1 кДж теплоты. Вычислить тепловой эффект реакции и стандартную энтальпию образования Fe2O3.
Решение. Число молей Fe2O3, содержащихся в 48 г Fe2O3, составляет 48/160 = 0,3 моль, где 160 г/моль – молярная масса Fe2O3. Так как тепловой эффект относят к 1 моль вещества, то тепловой эффект данной реакции равен –256,1/0,3 =
= –853,7 кДж. Запишем термохимическое уравнение этой реакции:
Fe2O3 (к) + 2Al (к) = 2Fe (к) + Al2O3 (к), DH°х.р. = –853,8 кДж.
Формула для расчета теплового эффекта данной реакции имеет вид:
 , отсюда находим
, отсюда находим  :
: 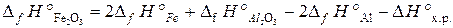 .
.
После подстановки справочных данных из табл. Б. 1 получаем:
 = 2×0 – 1676 – 2×0 + 853,8 = –822,2 кДж/моль.
= 2×0 – 1676 – 2×0 + 853,8 = –822,2 кДж/моль.
Дата добавления: 2014-11-13; просмотров: 274; Мы поможем в написании вашей работы!; Нарушение авторских прав |