
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Таким образом, тепловой эффект реакции равен –853,8 кДж, а составляет –822,2 кДж/моль.
Пример 3.3.Исходя из термохимических уравнений:
Н2 (г) + О2 (г) = Н2О2 (ж), ΔН°(1) = –187 кДж; (1)
Н2О2 (ж) + Н2 (г) = 2Н2О (г), ΔН°(2) = –297 кДж; (2)
Н2О (г) = Н2О (ж), ΔН°(3) = – 44 кДж, (3)
рассчитать значение стандартной энтальпии реакции образования Н2О (ж).
Решение. Запишем уравнение реакции, тепловой эффект которой необходимо определить: Н2 (г) + ½О2 (г) = Н2О (ж), ΔН°(4) – ? (4)
В уравнения (1), (2), (3) входят Н2О2 (ж) и Н2О (г), которые не входят в уравнение (4). Чтобы исключить их из уравнений (1), (2), (3), умножим уравнение (3) на 2 и сложим все три уравнения:
Н2 (г) + О2 (г) + Н2О2 (ж) + Н2 (г) + 2Н2О (г) = Н2О2 (ж) + 2Н2О (г) + 2Н2О (ж). (5)
После преобразования уравнения (5) и деления его на 2 получаем искомое уравнение (4). Аналогичные действия проделаем с тепловыми эффектами:
 .
.
В результате получаем  кДж,
кДж,
т. е. энтальпия образования Н2О (ж):  = –286 кДж/моль.
= –286 кДж/моль.
Пример 3.4.В каком направлении будет протекать при стандартных условиях реакция СН4 (г) + СО2 (г) ↔ 2СО (г) + 2Н2 (г)?
Решение. Направление протекания химической реакции определяет энергия Гиббса (∆G). Изменение энергии Гиббса в результате химической реакции равно сумме энергий Гиббса образования продуктов реакции за вычетом суммы энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. Формула для расчета изменение энергии Гиббса изучаемой реакции имеет вид
 .
.
Значения Δf G° берем из табл. Б. 1 и получаем
Δf G° = [2∙(–137,1) + 2∙0] − [(–50,8) + (–394,4)] = +171 кДж.
При р = const, T = const реакция самопроизвольно протекает в том направлении, которому отвечает убыль энергии Гиббса. Если ∆G < 0, то реакция самопроизвольно протекает в прямом направлении. Если ∆G > 0, то самопроизвольное протекание процесса в прямом направлении невозможно. Если ∆G = 0, то реакция может протекать как в прямом направлении, так и в обратном, и система находится в состоянии равновесия.
Так как ∆G°х.р. = +171 кДж, т.е. ∆G > 0, то самопроизвольное протекание данной реакции в прямом направлении в стандартных условиях невозможно.
Пример 3.5. Определить изменение энтропии в стандартных условиях для реакции, протекающей по уравнению
С (графит) + 2Н2 (г) = СН4 (г).
Решение. Изменение энтропии системы в результате протекания химической реакции (∆S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов:
 .
.
Подставляем в формулу справочные данные из табл. Б. 1 и получаем:
∆S°х.р. = 186,2 − (5,7 + 2∙130,6) = –80,7 Дж/К.
Пример 3.6. По значениям стандартных энтальпий образования и стандартных энтропий веществ, участвующих в реакции, вычислить изменение энергии Гиббса реакции, протекающей по уравнению
СО (г) + Н2О (ж) = СО2 (г) + Н2 (г).
Решение.Изменение энергии Гиббса в химической реакции при температуре Т можно вычислить по уравнению
∆G°х.р. = ∆Н°х.р. – Т∆S°х.р..
Тепловой эффект реакции ∆Н°х.р. и изменение энтропии ∆S°х.р. определяем по следствию из закона Гесса:
 ;
;
 .
.
Используя справочные данные табл. Б. 1, получаем:
∆Н°х.р. = [(–393,5) + 0] − [(–110,5) + (–285,8)] = +2,8 кДж;
∆S°х.р. = (213,7 + 130,6) − (197,5 + 70,1) = +76,7 Дж/К.
Изменение энергии Гиббса в химической реакции:
∆G°х.р. = ∆Н°х.р. – Т∆S°х.р.; Т = 298 К;
∆G°х.р. = 2,8 − 298∙76,7∙10-3 = –20,05 кДж.
Пример 3.7.Определить температуру, при которой установится равновесие в системе
СаСО3 (к)  СаО (к) + СО2 (г).
СаО (к) + СО2 (г).
Решение. При химическом взаимодействии одновременно изменяется энтальпия, характеризующая стремление системы к порядку, и энтропия, характеризующая стремление системы к беспорядку. Если тенденции к порядку и беспорядку в системе одинаковы, то ∆H°х.р. = Т∆S°х.р., что является условием равновесного состояния системы. Отсюда можно определить температуру, при которой устанавливается равновесие химической реакции для стандартного состояния реагентов:
 .
.
Сначала вычисляем ∆Н°х.р. и ∆S°х.р. по формулам:
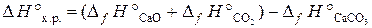 ;
;
 .
.
Используя справочные данные табл. Б. 1 получаем:
DH°х.р. = [– 635,5 + (–393,5)] – (–1207,1) = 178,1 кДж;
DS°х.р. = (39,7 + 213,7) – 92,9 = 160,5 Дж/К или 0,1605 кДж/К.
Отсюда температура, при которой устанавливается равновесие:
Травн. = 178,1/0,1605 = 1109,5 К.
Пример 3.8.Вычислить DH°х.р., ∆S°х.р. и DG°T реакции, протекающей по уравнению Fe2O3 (к) + 3C (к) = 2Fe (к) + 3CO (г). Возможна ли реакция
восстановления Fe2O3 углеродом при температуре 298 и 1000 К?
Решение. Вычисляем DH°х.р. и DS°х.р.:
 ,
,
DH°х.р. =[3(–110,5) + 2·0] – [–822,2 + 3·0] = –331,5 + 822,2 = +490,7 кДж;
 ,
,
DS°х.р. = (2·27,2 + 3·197,5) – (89,9 + 3·5,7) = 539,9 Дж/К или 0,540 кДж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения DG°х.р. = DH°х.р. – ТDS°х.р..
DG°298 = 490,7 – 298×0,540 = +329,8 кДж;
DG°1000 = 490,7 – 1000×0,540 = –49,3 кДж.
Так как DG°298 > 0, а DG°1000 < 0, то восстановление Fe2O3 углеродом возможно при 1000 К и невозможно при 298 К.
Дата добавления: 2014-11-13; просмотров: 295; Мы поможем в написании вашей работы!; Нарушение авторских прав |