
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи для самостоятельного решения. 19.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
19.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag → AgNO3 → AgCl → [Ag(NH3)2]Cl → Ag2S.
19.2. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
ZnS → ZnO → Zn → ZnSO4 → Zn(OH)2 → Na2ZnO2.
19.3. Составить в молекулярном и ионном виде уравнения реакций гидролиза:
а) CuSO4 + H2O ↔ …; б) CuSO4 + Na2CO3 + H2O = …; в) CuCl2 + H2O ↔ ….
19.4. Вычислить ΔН° реакции восстановления ZnO углем с образованием СО. (  = –350,6 кДж/моль;
= –350,6 кДж/моль; 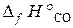 = –110,5 кДж/моль).
= –110,5 кДж/моль).
(Ответ: 240,1 кДж).
19.5. Написать уравнения реакций, сопровождающихся образованием свободного металла: а) AgNO3 + H2O2 + NaOH = …; б) H[AuCl4] + H2O2 + NaOH = ….
19.6. Что происходит при действии на гидроксиды цинка и кадмия растворов: а) щелочи; б) аммиака? Написать уравнения соответствующих реакций в молекулярном и ионном виде.
19.7. Вычислить молярную концентрацию водного раствора сульфата меди
(ρ = 1,107 г/мл), полученного при растворении 5 г соли в 45 г воды.
(Ответ: 0,63 моль/л).
19.8. Закончить уравнения реакций: а) CuCl2 + NaOH = …;
б) CuO + HNO3 = …; в) Cu(СN)2 + КСN = …; г) CuSO4 + H2O ↔ … .
19.9. Закончить уравнения реакций: а) Zn + NaNO3 + NaOH = …;
б) Zn + K2Cr2O7 + H2SO4 = …; в) Hg + HNO3 (разб.) = …; г) Zn + H2SO4 (разб.) = ….
19.10. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
СuS → CuO → Cu → CuSO4 → Cu(OH)2 → CuO.
19.11. Можно ли восстановить медь из ее оксида водородом? Ответ мотивировать, вычислив ΔG0 реакции CuO (к) + H2 (г) = Cu (к) + H2O (г).
(  = –129,9 кДж/моль;
= –129,9 кДж/моль;  = –228,6 кДж/моль).
= –228,6 кДж/моль).
19.12. Написать уравнения реакций взаимодействия металлов с кислотами:
а) Сu + H2SO4 (конц.) = …; б) Au + H2SеO4 (конц.) = …;
в) Ag + HNO3 (разб.) = …; г) Cu + HNO3 (разб.) = ….
19.13. Кусочек латуни (сплав цинка и меди) растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой − избыток щелочи. В растворе или в осадке и в виде каких соединений находятся цинк и медь в обоих случаях? Написать уравнения соответствующих реакций.
19.14. Составить уравнения реакций, с помощью которых можно осуществить следующие превращения: HgSO4 → HgO → HgCl2 → HgS → HgO →Hg.
19.15. Чему равна молярная масса эквивалентов кадмия, если для выделения 1 г кадмия из раствора его соли надо пропустить через раствор 1717 Кл электричества? (Ответ: 56,2 г/моль).
19.16. Закончить уравнения реакций: а) Hg2Cl2 + SnCl2 = …;
б) Cd + HNO3 (разб.) = …; в) Cd + H2SO4 (конц.) = …; г) Hg + HNO3 (разб.) = …
19.17. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd → Cd(NO3)2 → Cd(OH)2 → [Cd(NH3)4](OH)2 → CdSO4.
19.18. Учитывая, что координационное число серебра равно двум, написать уравнения реакций образования комплексных соединений серебра и назвать их:
а) AgNO3 + KCN (избыток) = …; б) AgBr + Nа2S2O3 = …; в) AgCl + NH4OH = ….
19.19. Какие вещества образуются при добавлении щелочи к растворам одно- и двухвалентной азотнокислой ртути? Составить молекулярные и ионные уравнения реакций.
19.20. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов. Вычислить значения стандартных ЭДС.
Дата добавления: 2014-11-13; просмотров: 269; Мы поможем в написании вашей работы!; Нарушение авторских прав |