
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторные работы. Определение коэффициента внутреннего трения воздуха при различных температурах
Определение коэффициента внутреннего трения воздуха при различных температурах
№ 1.20 Изучение реального газа (Эффект Джоуля-Томсона)
Теоретический минимум
- Уравнение Клайперона-Менделеева. Основное уравнение молекулярно-кинетической теории газов.
- Барометрическая формула. Распределение Больцмана.
- Максвелловское распределение молекул по скоростям.
- Эффективный диаметр и средняя длина свободного пробега молекул.
- Явления переноса. Вязкость газов. Диффузия. Теплопроводность. Механизм вязкости газов. Зависимость вязкости газов от температуры. Формула Пуазейля и ее применение для определения вязкости газов.
- Реальные газы. Силы межмолекулярного взаимодействия.
- Поправки Ван-дер-Ваальса. Уравнение Ван-дер-Ваальса.
Контрольные задания
Вариант 1
1. Явление диффузии. Закон Фика. Физический смысл коэффициента диффузии.
2. Чему равна плотность ρ азота, находящегося в баллоне под давлением р = 2 МПа при температуре Т = 400 К?
3. При повышении температуры в 1,5 раза происходит диссоциация молекул двухатомного газа. Как при этом изменяется давление газа?
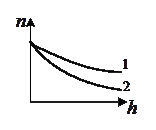 4. На рисунке приведены зависимости концентрации частиц некоторого газа от высоты. Какая кривая соответствует большей температуре газа?
4. На рисунке приведены зависимости концентрации частиц некоторого газа от высоты. Какая кривая соответствует большей температуре газа?
5. Средняя длина свободного пробега молекул определяется выражениями
a) 1/<z> б) < υ>/<z> в)  ·
·  г)
г)  πd2n< υ>
πd2n< υ>
1) а, б 2) б, в . 3) в, г 4) а,г
6. Теплопроводность в газах обусловлена
1) силами межмолекулярного взаимодействия;
2) переносом импульса упорядоченного движения молекул;
3) переносом энергии молекул;
4) переносом массы молекул из одного слоя в другой.
7. Ван-дер-Ваальсом были введены в уравнение Клайперона-Менделеева поправки, учитывающие
1) собственный объем молекул, скорость движения молекул;
2) собственный объем молекул, притяжение молекул;
3) скорость движения молекул, притяжение молекул;
4) скорость движения молекул, колебательные степени свободы.
Вариант 2
1. Явление теплопроводности. Закон Фурье. Физический смысл коэффициента теплопроводности.
2. Газ при температуре Т = 309 К и давлении р = 0,7 МПа имеет плотность ρ = 12 кг/м3. Чему равна молярная масса газа?
3. В результате уменьшения объема газа в 3 раза и увеличения средней кинетической энергии его молекул в 2 раза давление газа
1) не изменилось 2) увеличилось в 2 раза
3) увеличилось в 3 раза 4) увеличилось в 6 раз
4. Найти отношение давления воздуха на высоте h2 к давлению воздуха на высоте h1 при постоянной температуре Т.
5. По какой формуле можно найти среднее число столкновения молекул?
1)  πd2n 2)
πd2n 2)  3)
3)  πd2n< υ> 4)
πd2n< υ> 4) 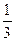 < υ>< λ>
< υ>< λ>
6. Явления переноса характеризуются коэффициентом вязкости (а), коэффициентом диффузии (б), коэффициентом теплопроводности (в). Какой из этих коэффициентов не зависит от плотности газа?
7. Если уменьшение объема насыщенного пара происходит при постоянной температуре, то его давление
1) увеличится; 2) останется прежним; 3) уменьшится;
Вариант 3
1. Явление внутреннего трения. Закон Ньютона. Физический смысл коэффициента вязкости.
2. В сосуде емкостью V = 5 л находится кислород, концентрация п молекул которого равна 9,41·1023 м-3. Чему равна масса т газа?
3. Два идеальных газа характеризуются следующими параметрами: р1, ρ1 и р2 = 2р1, ρ2 = ρ1/2. Чему равно отношение значений среднеквадратичных скоростей движения их молекул υ2/ υ1?
4. Найти высоту, на которой давление газа равно 0,8 давления на уровне моря, считая, что температура Т не меняется.
5. По какой формуле можно найти среднюю длину пробега молекул?
1)  2)
2)  3)
3)  4)
4) 
 6. Температура газовой системы изменяется согласно графику. Сравните плотности потока энергии, переносимой в направлении оси Оx через одинаковые сечения I и II.
6. Температура газовой системы изменяется согласно графику. Сравните плотности потока энергии, переносимой в направлении оси Оx через одинаковые сечения I и II.
 7. На рисунке представлена изотерма реального газа. Состоянию равновесия между жидкостью и паром соответствует участок
7. На рисунке представлена изотерма реального газа. Состоянию равновесия между жидкостью и паром соответствует участок
1) а, в 2) а 3) б 4) в
Вариант 4
1. Основное уравнение молекулярно-кинетической теории идеального газа.
2. В одинаковых баллонах при одинаковой температуре находятся равные массы водорода Н2 и углекислого газа СО2. Во сколько раз давление, производимое водородом больше?
3. Давление идеального газа 2 мПа, концентрация молекул 2·1010 см-3. Определить среднюю кинетическую энергию поступательного движения одной молекулы этого газа.
 4. На рисунке приведены зависимости концентрации частиц двух разных газов от высоты. Какая кривая соответствует более легким молекулам?
4. На рисунке приведены зависимости концентрации частиц двух разных газов от высоты. Какая кривая соответствует более легким молекулам?
5. В результате протекания изотермического процесса давление газа увеличилось в k раз. Как при этом изменилась длина свободного пробега?
6. Внутреннее трение в газах обусловлено:
1) силами межмолекулярного взаимодействия;
2) переносом импульса упорядоченного движения молекул;
3) переносом энергии молекул;
4) переносом массы молекул из одного слоя в другой.
7. Учет сил притяжения между молекулами газа приводит к появлению внутреннего давления на газ, которое равно
1)  2)
2) 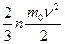 3)
3)  4)
4) 
Вариант 5
1. Уравнение Клапейрона-Менделеева. Изопроцессы.
2. При увеличении абсолютной температуры идеального газа в 2 раза давление газа увеличилось на 25 %. Во сколько раз при этом изменился объем?
3. Давление газа на стенки сосуда
1) пропорционально υ; 2) пропорционально υ1/2;
3) не зависит от υ; 4) пропорционально υ2, .
где υ – средняя квадратичная скорость молекулы.
4. Найти высоту, на которой плотность воздуха в е раз меньше плотности воздуха на уровне моря, считая температуру неизменной.
5. Найти зависимость среднего числа столкновений <z> молекулы идеального газа за 1 с от давления р при изохорном процессе.
6. Определить зависимость динамической вязкости от Т при изобарном процессе.
7. Внутренняя энергия моля реального газа (с учетом потенциальной энергии межмолекулярного взаимодействия) отличается от внутренней энергии идеального газа на величину
1)  2)
2)  3)
3)  4)
4) 
Вариант 6
1. Распределение Больцмана. Влияние температуры и массы молекул на характер распределения.
2. При увеличении объема газа в 2 раза давление увеличилось на 120 кПа, а абсолютная температура возросла на 10 %. Каким было первоначальное давление?
3. Во сколько раз средняя квадратичная скорость молекул кислорода меньше средней квадратичной скорости молекул водорода, если температуры газов одинаковы?
 4. На рисунке представлен график функции распределения молекул по проекциям скорости υх. Числа молекул, имеющих проекции в интервалах: от 0 до υх1(N1) и от υх1 до υх2(N2) соотносятся как
4. На рисунке представлен график функции распределения молекул по проекциям скорости υх. Числа молекул, имеющих проекции в интервалах: от 0 до υх1(N1) и от υх1 до υх2(N2) соотносятся как
1) N1 > N2 .
2) N2 > N1
3) N1 = N2
4) зависимость не дает информации о количестве молекул
5. Найти зависимость средней длины свободного пробега молекул идеального газа от температуры Т при изобарном процессе.
6. Определить зависимость динамической вязкости h от температуры Т при изохорном процессе.
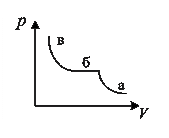 7. На рисунке представлена изотерма реального газа. Насыщенному пару соответствуют области
7. На рисунке представлена изотерма реального газа. Насыщенному пару соответствуют области
1) а 2) б
3) в 4) а, в
Вариант 7
1. Максвелловское распределение молекул по скоростям. Наиболее вероятная, средняя и средняя квадратичная скорости.
2. При нагревании газа на 1 К при постоянном объеме его давление увеличилось на 0,2 %. Какова начальная температура газа?
3. Давление идеального газа выражается формулами
а) p = nkT б) 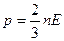 в)
в) 
г)  ρυкв2 д)
ρυкв2 д) 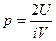
1) а, б 2) а, б, г 3) а, в, г, д 4) а, б, в, г, д
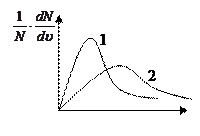 4. Представленным кривым распределения Максвелла соответствуют параметры
4. Представленным кривым распределения Максвелла соответствуют параметры
1) Т1 = Т2, М1 > М2
2) Т1 = Т2, М2 > М1 .
3) М1 = М2, Т1 > Т2
4) М1 = М2, Т2 > Т1
5. Найти зависимость средней длины свободного пробега молекул идеального газа от давления р при изотермическом процессе.
 6. Концентрация молекул газа вдоль оси х изменяется согласно графику. Сравните перенос массы вещества в горизонтальном направлении через одинаковые сечения I и II.
6. Концентрация молекул газа вдоль оси х изменяется согласно графику. Сравните перенос массы вещества в горизонтальном направлении через одинаковые сечения I и II.
7. Удельная теплоемкость твердых тел, с учетом закона Дюлонга и Пти, равна
1)  2)
2)  3) 3R 4)
3) 3R 4) 
Вариант 8
1. Вывод формулы для расчета длины свободного пробега молекул.
2. В баллоне вместимостью V = 5 л находится азот массой т = 17,5 г. Чему равна концентрация п молекул азота в баллоне?
3. При неизменной концентрации молекул идеального газа в результате нагревания давление газа увеличилось в 4 раза. Как при этом изменилась средняя квадратичная скорость теплового движения молекул?
4. Площадь под кривой распределения молекул по скоростям
1) увеличивается при увеличении температуры
2) увеличивается при уменьшении давления
3) зависит от Т и р
4) остается постоянной.
5. Найти зависимость среднего числа столкновений <z> молекулы идеального газа за 1 с от давления р при изотермическом процессе.
6. Явление диффузии обусловлено:
1) силами межмолекулярного взаимодействия
2) переносом импульса упорядоченного движения молекул
3) переносом энергии молекул
4) переносом массы молекул из одного слоя в другой.
7. Внутренняя энергия моля реального газа равна
1)  2) СvT 3)
2) СvT 3)  4)
4) 
Дата добавления: 2014-12-23; просмотров: 464; Мы поможем в написании вашей работы!; Нарушение авторских прав |