
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Г магния выделяется 25,6 кДж теплоты.
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(Мg)=1 г Q=25,6 кДж Найти: Q' - ? |
| 2. Чтобы составить термохимическое уравнение реакции, нужно вычислить тепловой эффект реакции, написать уравнение горения магния и указать в нем значение этой величины. | |
| 3.Составьте уравнение химической реакции. | Решение: 2Мg + O2 = 2МgО |
| 4.При анализе условия и уравнения горения магния делают вывод, что, для того чтобы найти тепловой эффект реакции, нужно вычислить количество теплоты, которое выделится при сгорании 2 моль | |
| 5.В уравнении подчеркните, что записано в «Дано» | 2Мg + O2 = 2МgО |
| 6.Под подчеркнутой формулой подпишите число моль: | 2Мg + O2 = 2МgО 2 моль |
| 7.Вычислите количество вещества n, которое записано в «Дано». | 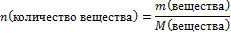 n(Мg) =
n(Мg) = 
|
| 8.Подпишите найденное nпод формулой этого вещества | 2Мg + O2 = 2МgО 2 моль 0,04 моль |
| 9.Составьте пропорцию: | при сгорании 0,04 моль магния выделится 25,6 кДж теплоты при сгорании 2 моль магния выделится х кДж теплоты |
| 10.Из полученной пропорции выразить х | 0,04 моль 25,6 кДж
2 моль х кДж
х = 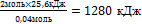
|
| 11. Запишите ответ | 2Мg + O2 = 2МgО + 1280 кДж |
Задача 3. На гидроксид натрия, взятый в необходимом количестве, подействовали раствором, содержащим 252 г азотной кислоты. Вычислите массу полученной соли, если практический выход составляет 90 % от теоретического.
Количество продукта, рассчитанное по уравнению, является максимально возможным значением (теоретическое значение,mтеор). На практике из-за потерь обычно получают меньшее количество (практическое значение,mпракт., mпракт < mтеор).
Практический выход продукта определяется отношением его практического количества к теоретическому: ᶮ = 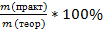
При получении продукта в газообразном или жидком состоянии часто определяют отношение не масс, а объемов готового вещества. В этом случае вычисляют объемную долю выхода продукта: ᶮ= 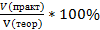
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(НNО3)=252 г ᶮ(соли)=90% Найти: m(соли)-? |
| 2.Составьте уравнение химической реакции. Рассчитайте массу соли по уравнению – это теоретическая масса соли | Решение: NаОН + НNO3 = NаNO3+Н2О |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | NаОН + НNO3 = NаNO3+Н2О |
| 5.Под подчеркнутыми формулами подпишите по коэффициентам число моль | NаОН + НNO3 = NаNO3+Н2О 1 моль 1 моль |
| 6.Вычислите количество вещества n, которое записано в «Дано». | 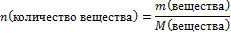 n(НNO3) =
n(НNO3) = 
|
| 7.Подпишите найденное n под формулой этого вещества | NаОН + НNO3 = NаNO3+Н2О 1 моль 1 моль 4 моль |
| 8.Под формулой вещества, массу которого надо найти, поставьтех моль | NаОН + НNO3 = NаNO3+Н2О 1 моль 1 моль 4 моль х моль |
| 9.Из полученной пропорции выразите х | 1 моль 1 моль
4 моль х моль
х = 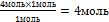 –
это количество вещества n(NаNO3) –
это количество вещества n(NаNO3)
|
| 10.Зная n(NаNO3) найдите массу NаNO3 | m=nM
m (NаNO3)= n (NаNO3) 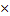 M (NаNO3)
M (NаNO3=23+ 14+16 M (NаNO3)
M (NаNO3=23+ 14+16  =85г/моль
m(NаNO3)=4 =85г/моль
m(NаNO3)=4 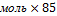 г/моль=340г – теоретическая масса соли г/моль=340г – теоретическая масса соли
|
| 11.Вычислите практическую массу полученной соли | 340 г - 100%
Х г - 90%
х = 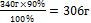 - практическая масса NаNO3 - практическая масса NаNO3
|
| 11.Запишите ответ | Ответ: m (NаNO3) =306 г |
Дата добавления: 2015-01-01; просмотров: 434; Мы поможем в написании вашей работы!; Нарушение авторских прав |