
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Г сульфата меди (II), на раствор, содержащий 10 г гидроксида натрия.
Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т.е. в соответствии с уравнением реакции и расчетным уравнением.
Чаще один реагент берется в избытке, а следовательно, другой реагент окажется в недостатке. Избыток реагента вступать в реакцию не будет.
Расчет получаемых количеств, масс и объемов (для газов) продуктов проводят только по реагенту в недостатке.
| Последовательность действий | Пример выполнения действий |
| 1.Запишите условие и требование задачи с помощью общепринятых обозначений | Дано: m(СuSO4)=8г m(NaOH)=10г Найти: m(Cu(OН)2)-? |
| 2.Составьте уравнение химической реакции | Решение: СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 |
| 3.В уравнении подчеркните формулы веществ, которые записаны в «Дано» и «Найти» | СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 |
| 4.Под подчеркнутыми формулами подпишите по коэффициентам число моль | СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль |
| 5.Под формулой вещества, массу которого надо найти поставьте х моль | СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль х моль |
| 6.Вычислите количество веществ n, которые записаны в «Дано». | 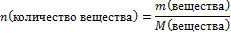 n(СuSO4) =
n(СuSO4) =  – то, что есть по условию задачи
n(NaOH) = – то, что есть по условию задачи
n(NaOH) = 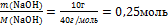 - то, что есть по условию задачи - то, что есть по условию задачи
|
| 7.Подпишите найденное n под формулами этих веществ | СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 1 моль 2 моль 1 моль 0,05 моль 0,25 моль х моль |
| 8. Найдите, какое из исходных веществ СuSO4 или NaOH взято в избытке, составив пропорцию (х можно подставить или под СuSO4 или NaOH) |  Х=
Х=  - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4. - должно быть NaOH, а его 0,25 моль, значит NaOH дан в избытке. Далее расчет ведем по недостатку, т.е по СuSO4.
|
| 9.Выразите х уже через СuSO4. | СuSO4 + 2NaOH = Cu(OН)2 + Na2SO4 1 моль 2 моль1 моль 0,05 моль 0,25 моль х моль |
| 10.Из полученной пропорции выразите х | 1 моль 1 моль
0,05 моль х моль
х =  –
это количество вещества n(Cu(OН)2) –
это количество вещества n(Cu(OН)2)
|
| 11.Зная n(Cu(OН)2) найдите массу Cu(OН)2 | m=nM
m(Cu(OН)2)= n (Cu(OН)2) 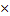 M (Cu(OН)2)
M (Cu(OН)2) =64+17 M (Cu(OН)2)
M (Cu(OН)2) =64+17 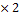 =98г/моль
m(Cu(OН)2)=0,05 =98г/моль
m(Cu(OН)2)=0,05  г/моль=4,9г г/моль=4,9г
|
| 12.Запишите ответ | Ответ: m(Cu(OН)2)=4,9г |
Дата добавления: 2015-01-01; просмотров: 244; Мы поможем в написании вашей работы!; Нарушение авторских прав |