
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Распределение электронов в многоэлектронных атомах
Важнейшей характеристикой электрона в атоме является энергия его притяжения ядром, или, что то же самое, энергия связи его с ядром или кратко "энергия электрона".
В атоме водорода энергия притяжения электрона протоном в расчёте на 1 моль вещества составляет –1300 кДж*.
Энергии притяжения приписывается знак минус, так как она пропорциональна произведению величин притягивающихся зарядов, знаки которых противоположны «+» и «–», следовательно,их произведение отрицательно).
Заряд ядра атома гелия (+2) больше, чем атома водорода (+1), значит и энергия притяжения больше; поскольку два электрона, имеющиеся в атоме He, отталкиваются друг от друга, тоихэнергия связи с ядром меньше удвоенной энергии связи электрона в атоме водорода и составляет – 2400 кДж/моль.
Усиление связи приводит к приближению электронов к ядру, поэтому область пространства, где движутся электроны атома Не (то есть его s орбиталь), более сжата. Радиус сферы, где в основном находятся электроны атома He, равен 60 пм. Таким образом, радиус Н–атома (140 пм) больше радиуса атома He в 2,33 раза.
Следующий по сложности строения — атом лития Li, имеющий три электрона. Два из них занимают такую же s орбиталь, как и электроны в атомах Н и Не (только эта орбиталь ещё более сжата около ядра, см. рис. ), а третьего электрона здесь быть не может (по принципу Паули на одной орбитали может быть не более двух электронов). Поэтому третий электрон должен находиться на другой орбитали, которая также представляет собой сферу, только значительно большего радиуса (159 пм).
Энергия связи третьего электрона с атомным ядром намного меньше (по модулю), чем первых двух, находящихся к ядру ближе: значения энергий связи составляют –520 и –7000 кДж/моль соответственно. В этом случае говорят, что электрон находится на втором энергетическом уровне.
В атоме водорода электрон (рис. ) находится на сферической ls-орбитали (1 – номер энергетического уровня, s – название орбитали). В атоме Hе оба электрона так же находятся на ls-орбитали. В атоме Li два электрона занимают 1s- и один электрон – 2s-орбиталь.
В следующем за литием атоме бериллия имеется четыре электрона: два изних занимают ls- и два – 2s-орбиталь. По сравнению с атомом Li атом Be (r = 104 пм) меньше, так как он обладает бόльшим зарядом ядра, который сильнее сжимает орбитали, чем в случае лития (рис. ).

Рис. . Сечения 1s- и 2s-электронных облако соответственно
атомов водорода и лития плоскостью, проходящей через ядро
Таким образом, в атоме Be 1s- и 2s-орбитали оказываются целиком занятыми, поэтому у атома следующего элемента – бора, добавочный пятый электрон должен занять новую орбиталь.
В отличие от состояния электрона на первом энергетическом уровне, где имеется лишь одна s-орбиталь, на втором уровне, более удалённом от ядра, имеется два типа орбиталей. Это сферическая s-орбиталь, и р-орбитали, имеющие форму гантели. На каждом энергетическом уровне (кроме первого) имеется по три р-орбитали, которые взаимно перпендикулярно ориентированы в пространстве вдоль осей х, у и z и соответственно обозначаются рх, ру и рz.
На каждой р-орбитали (также как и на s-орбитали и любых других орбиталях) согласно принципу Паули может находиться не более двух электронов. Всего, таким образом, на втором энергетическом уровне может быть не более восьми электронов (два электрона на 2s-орбитали и по два электрона на каждой из трёх 2р-орбиталей), в отличие от первого уровня, где имеется только одна орбиталь.
р-Орбитали последовательно (согласно правилу Хунда) заполняются у атомов следующих за Be элементов: В, С, …, вплоть до Ne.
Распределение электронов в атоме по энергетическим уровням, подуровням и орбиталям в основном (невозбуждённом) состоянии показывается электронной конфигурацией атома.
Она изображается в виде электронной формулы, в которой цифрой впереди указан номер энергетического уровня, затем буквой обозначен подуровень, а вверху справа от буквы – число электронов на данном подуровне. Например, распределение электронов в атоме неона можно выразить формулой:
Ne ls22s22p6,
которая указывает, что на первом уровне на ls-орбитали находятся два электрона, на втором уровне на 2s-орбитали – два электрона и на трёх 2р-орбиталях – шесть электронов.
Представленная запись электронного строения называется электронной формулой атома.
Химические свойства атомов определяются в основном электронным строением их наружных, не полностью занятых энергетических уровней, которые называются валентными. Можно предсказать изменение валентности* атома в результате перехода его в возбуждённое состояние, когда электроны с низколежащего энергетического подуровня могут распариваться и переходить на более высокий подуровень.
У атома следующего после неона элемента – натрия прибавляется ещё один электрон. Но поскольку орбитали первых двух энергетических уровней атома Na заполнены, этот электрон занимает s-орбиталь третьего уровня, которая находится ещё дальше от ядра. И поэтому энергия связи этого электрона с ядром будет ещё меньше, чем у электронов на 1s- и 2s- и 2p-подуровнях.
Электронное строение атома изображают и графически электронно-структурными формулами с помощью квантовых ячеек (клеток) – орбиталей, сгруппированных в подуровни и уровни с учётом их энергий, со стрелками, указывающими направление спина (свободная клетка – свободная орбиталь): - спаренные электроны; - неспаренный электрон.
В результате поглощения внешней энергии электроны могут переходить на более высокий энергетический уровень, а атомы вследствие этого переводятся в возбуждённое состояние.
Пример 3.Составьте электронную формулу и изобразите графически схему заполнения электронами валентных орбиталей атома кремния в основном и в возбуждённом состояниях.
Решение. Электронная формула атома кремния в основном состоянии будет иметь вид: 1s2 2s2 2p6 3s2 3p2. Валентными орбиталями в Si-атоме являются орбитали внешнего энергетического уровня: 3s-, 3р- и 3d-орбитали. Графически схема заполнения электронами этих орбиталей имеет вид:
Si 
Суммарный спин при размещении электронов на 3р-подуровне в соответствии с правилом Хунда имеет максимальное значение, равное 1. Другие возможные варианты размещения электронов на 3р-подуровне:

отвечают нулевому значению суммарного спина и, следовательно, соответствуют возбуждённому состоянию атома.
При получении некоторого квантованного количества энергии (ΔЕ) один из 3s-электронов атома кремния может перейти на вакантную 3р-орбиталь. При этом энергия атома возрастает так, что возникающей электронной конфигурации, которая соответствует одному из возможных возбуждённых состояний атома кремния, отвечают электронная формула 3s13p3 и электронно-структурная формула
Si* 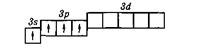
(знак "*" – обозначает возбуждённое состояние атома)
*Атом - от греч. a'tomos – неделимый (а "не" и temnō "делю, ломаю"). Термин ввёл Демокрит.
* Термин «электрон» ввёл в науку ирландский физик Джордж Дж. Стони в 1891 г. От греч. ēlektron – янтарь, лучезарное солнце – окаменелое образование, минерал органического происхождения, который при трении приобретает отрицательный заряд.
Термин введён для обозначения единицы минимального количества электричества, так как к 1870 г. учёные стали догадываться, что поскольку вещество состоит из атомов, то и электричество тоже связано как-то с существованием отдельных частиц.
Электрон был открыт в 1897 г. Дж. Дж. Томсоном и независимо – немецким физиком Э. Вихертом. В более ранней дате введения термина, чем открытие электрона нет ошибки. Мысль о существовании элементарного электрического заряда возникла ещё в XVIII веке, то есть задолго до экспериментального открытия электрона.
** Радиоактивность – от лат. radio – испускаю лучи и activus – действенный.
** За единицу измерения размера атома принят пикометр: 1 пм = 10-12м.(от исп. pico-малая велечина).
*Дискретный – прерывистый, дробный, состоящий из отдельных частей (от латинского diskretus).
** Квант – наименьшее возможное количество энергии, которое может быть поглощено или отдано молекулярной, атомной или ядерной системой в отдельном акте изменения её состояния; от лат. quantum – сколько.
Квантовая механика – это наука о строении и свойствах микрочастиц и их систем (элементарных частиц, ядер, атомов молекул). Она использует сложный математический аппарат и понятия, некоторые из которых не имеют аналогий в макромире. Законы классической механики макромира являются частными случаями законов квантовой механики.
Протон открыт Э. Резерфордом в 1920 г. и назван им так потому, что ядро атома водорода представляет собой протон (от греч. prόtos – первый).
**** Нейтрон (от лат. neutrum – ни то, ни другое) открыт английским физиком Дж. Чедвиком в 1932 г. В том же году немецкий физик-теоретик В. Гейзенберг и русский физик Д.Д. Иваненко предложили протон-нейтронную модель атомного ядра.
* Суб … (от лат. sub – под) – первая составная часть сложных слов, обозначающая: не основной, не главный или меньший.
* А. е. м. (дальтон) – атомная единица массы, равная 1/12 массы нуклида углерода 12С (1 а. е. м. = 1,661 ∙ 10-27 кг).
** Положительный заряд протона – наименьший существующий в природе электрический заряд, то есть элементарный заряд, который далее неделим. Его рассчитал в 1911 г. американский физик Р.Э. Милликен.
При описании объектов атомных масштабов заряд протона принимается за 1. Его абсолютное значение можно вычислить, зная, что электрический заряд в 96 485 Кл (число Фарадея) равен заряду NA (число Авогадро) электронов: 96 485/ 6,022 ∙ 1023 ≈ 1,602 ∙ 10-19 Кл.
*Совокупность
* Обратите внимание на тот факт, что хлор – единственный в Периодической системе Д.И. Менделеева элемент, атомная масса которого никогда не округляется до целого числа.
r- relative - относительный
** Волновые свойства электрона были предсказаны французским физиком Луи де Бройлем в 1924 г., а затем установлены экспериментально в 1927 г. американскими учёными Дж. Девиссоном и А. Джермером.
*** Частица – это сосредоточение вещества в малой части пространства. Движение частицы характеризуется траекторией (координатами) и скоростью в каждый момент времени.
Волна – это процесс, занимающий значительный объём двухмерного пространства и развивающийся во времени; чаще всего как периодический процесс. Характеристиками волны являются её длина, частота, скорость движения, а также амплитуда и её знак амплитуды.
* Дифракция – огибание волнами (световыми, звуковыми) встречающихся на пути препятствий; от лат. diffractio – разламывание.
Интерференция – взаимное усиление или ослабление электромагнитных волн с одинаковыми периодами при их наложении друг на друга; от лат. inter – взаимно и ferens – несущий, переносящий
** Движение электрона в квантовой механике описывают уравнением австрийского физика- теоретика Э. Шрёдингера (1926г.) с помощью волновой функции . Это уравнение имеет много решений, каждое из которых описывает электронное облако и соответствующую ему полную энергию, и показывает вероятность пребывания электрона в данной точке пространства. Каждое из решений уравнения Шрёдингера определяется квантовыми числами (раздел 1.4).
Важнейшим принципом квантовой механики является принцип неопределённости, установленный В. Гейзенбергом в 1927 г. Невозможно одновременно определить положение и импульс микрочастицы с одинаково высокой точностью. Согласно этому принципу нельзя движение микрочастиц характеризовать траекторией как точной линией.
*** Употребляя выражения «электронное облако» и «распределение электронной плотности», следует помнить, что электронное облако – это не наглядный образ самого электрона, а изображение распределения вероятности его нахождения в той или иной единице объёма атомного пространства.
* Термин «орбиталь» принят в 1962 г. вместо термина "орбита".
* Расщепление уровней энергии на подуровни немецкий физик А. Зоммерфельд объяснил тем, что электроны вращаются не по круговым, а по эллиптическим орбитам.
* Орбитальным моментом количества движения L (или орбитальным механическим моментом) частицы, движущейся вокруг центра вращения по некоторой орбите, называется произведение m v r, где m – масса частицы; v – вектор её скорости; r – радиус-вектор, соединяющий центр вращения с частицей.
Важно отметить, что L – векторная величина; направление этого вектора перпендикулярно плоскости, в которой расположены векторы v и r. Определённой форме электронного облака соответствует вполне определённое значение орбитального момента количества движения L электрона. Но поскольку L может принимать только дискретные значения, задаваемые орбитальным квантовым числом l, то формы электронных облаков не могут быть произвольными: каждому значению l соответствует вполне определённая форма электронного облака.
** Для обозначения подуровней в своё время взяли начальные буквы английских названий, отражающих особенности серии спектральных линий: sharp – "резкая", principal – "главная", diffuse – "размытая", fundamental – "основная".
* Энергетические диаграммы соответствуют атомам в основном состоянии.
*Сформулирован швейцарским физиком- теоретиком, лауреатом Нобелевской премии Вольфгангом Паули в 1925 г.
[2] Немецкий физик- теоретик Фридрих Хунд ( Hand ).
*1 кДж = кг ∙ м2/с2 = 6,24 ∙ 1021 эВ. (1 эВ = 1,602 · 10-19 Дж).
* Валентность (от лат. Valentia- сила) -способность атома химического элемента (или атомной группы) образовывать определённое число химических связей с другими атомами (или атомными группами); число связей, которое атом данного элемента образует с другими атомами в простом или сложном веществе.
Валентные электроны – электроны внешнего энергитического уровня (для s- и p-элементов), либо электроны внешнего и предвнешнего уровней (для d- и f-элементов).
Дата добавления: 2015-01-05; просмотров: 345; Мы поможем в написании вашей работы!; Нарушение авторских прав |