
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Коэффициенты рыночной активности
1. Тринатрийгидродифосфат образуется по реакции
Na4P2O7 + HCl = Na3HP2O7 + NaCl
Рассчитать тепловой эффект реакции на 100 кг пирофосфата натрия, содержащего 97% Na4P2O7, если степень протекания процесса составляет 98%, а DН  равна, кДж/моль: Na4P2O7 – (–3166); HCl – (–152,4); Na3HP2O7 – (–2965); NaCl – (–411,3).
равна, кДж/моль: Na4P2O7 – (–3166); HCl – (–152,4); Na3HP2O7 – (–2965); NaCl – (–411,3).
2. Определить расход тепла на получение 1000 кг диоксида кремния по реакции
SiCl4 + 2H2O = SiO2 + 4HCl
если теплота образования веществ равна, кДж/моль: SiCl4 – 628,4; Н2О – 286,0; SiO2 – 437,9; HCl – 95,5.
3. На вакуум-кристаллизацию приходит 2000 кг/ч раствора, содержащего 37,5 мас. % CuSO4, с температурой 90ºС (Ср = 2,99 кДж/(кг × град)). При охлаждении до 20°С выпадают кристаллы CuSO4 × 5Н2О (Ср = 1,125 кДж/(кг × К)). Маточный раствор содержит 17 мас. % CuSO4 (Ср = 3,655 кДж/(кг × К)). Теплосодержание водяного пара составляет 2640 кДж/кг. Найти количество кристаллов.
4. В вакуум-испаритель поступает 300 т/ч Н3РО4 с температурой 348°С (Ср = 2,26 кДж/(кг × К)) и охлаждается до 308°С. Определить количество испаряемой воды, если теплосодержание пара равно 2610 кДж/кг.
5. На первый слой контактного аппарата поступает 40 000 м3/ч газа, содержащего, об. %: SO2 – 8; O2 – 13; N2 – 79, с температурой 420°С. Вычислить температуру газа после слоя, если степень окисления SO2 составляет 70%, а тепловой эффект реакции равен в среднем 94,2 кДж. Средняя удельная теплоемкость газа составляет 1,09 кДж/(кг × К). Рассчитать расход холодного (150°С) газа следующего состава, об. %: SO2 – 8; O2 – 13; N2 – 79 на получение смешанного газа с температурой 460°С. Установить состав газа после смешения.
6. В конденсатор приходит 8000 м3/ч газа, содержащего 55 об. % водяного пара. Определить количество конденсирующегося водяного пара и количество тепла, которое при этом выделяется, если общее давление в конденсаторе Р0 = 160 кПа, а равновесное давление водяного пара составляет 30 кПа. Теплота конденсации равна 2245 кДж/кг.
7. Рассчитать количество теплоты, выделяющееся при обжиге 5 т колчедана, содержащего 40% серы, по реакции
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + 3413,2 кДж,
если степень выгорания серы из колчедана составляет 0,90.
8. Смешано 2 кг 20%-ного раствора H2SO4 и 3 кг 12%-ного раствора NaOH. При этом протекает реакция
H2SO4 + 2NaOH = Na2SO4 + 2H2O + 120 085 Дж.
Найти температуру раствора после смешения, если первоначальная температура кислоты и щелочи составляла 20°С, а потери тепла в окружающую среду равны 10%. Удельная теплоемкость раствора составляет 3,75 Дж/(г × К).
9. Рассчитать тепловой баланс (на 1 ч работы) стадии пиролиза при производстве уксусного ангидрида из ацетона и определить объем топлива (природный газ, содержащий, об. %: СН4 - 98, N2 – 2), необходимый для проведения данного процесса, при котором протекает реакция
(СН3)2СО → СН2 = СО + СН4 (Qх.р = -83,7 кДж/кмоль).
Производительность по уксусному ангидриду составляет 24 т/сут. Температура пиролиза равна 800°С. Степень превращения ацетона в кетен за один цикл составляет 0,25. Теплота испарения ацетона равна 553,5 кДж/кг. Теплоемкость Ср, кДж/(кг × град): ацетона при 20°С - 2,09, реакционной смеси при 800°С - 2,26. Теплотворная способность чистого метана составляет 890 310 кДж/кмоль.
10. На первый слой контактного аппарата поступает 40 000 м3/ч газа, содержащего, об. %: SO2 – 8; O2 – 13; N2 – 79, с температурой 420°С. Определить температуру газа после слоя, если степень окисления SO2 составляет 70%, а тепловой эффект реакции равен в среднем 94,2 кДж/моль. Средняя удельная теплоемкость газа составляет 1,09 кДж/(кг × град). Рассчитать расход холодного (150°С) газа состава, об. %: SO2 – 8; O2 – 13; N2 – 79, на получение смешанного газа с температурой 460°С. Установить состав газа после смешения.
11. Составить тепловой баланс процесса гашения извести водой по реакции
СаО + Н2О = Са(ОН)2 + 65,32 кДж.
На гашение поступает 5000 кг/ч извести, содержащей 85% СаО, температурой 120°С (Ср СаО = 0,765 кДж/(кг × К)). Температура воды 57°С. Образующееся известковое молоко концентрацией Са(ОН)2 25% уходит с температурой 100°С (Ср 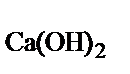 = 1,142 кДж/(кг × К)). Потери тепла в окружающую среду составляют 10% от прихода. Избыточное тепло отводится за счет испарения воды (теплота испарения воды равна 2500 кДж/кг).
= 1,142 кДж/(кг × К)). Потери тепла в окружающую среду составляют 10% от прихода. Избыточное тепло отводится за счет испарения воды (теплота испарения воды равна 2500 кДж/кг).
12. На сколько градусов повысится температура 30%-ного раствора аммиачной воды (NH4OH), если к 400 г его прилить 50 г 20%-ного раствора HCl? Начальная температура растворов равна 12ºС; теплоемкость полученного раствора составляет 3 кДж/(кг × К). Количество тепла, выделяющегося при смешении, равно 11 800 Дж/г.
13. Составить тепловой баланс процесса получения метилового спирта, протекающего по реакции
СО + 2Н2 Û СН3ОН, DH = -110,5 кДж.
Определить степень превращения СО и конечный состав газовой смеси (об. %), если температура газовой смеси на выходе из контактного аппарата повысилась с 450 до 520°С. Мольное соотношение реагентов в газовой смеси СО : Н2 = 1,0 : 2,1. Потери тепла в окружающую среду составляют 6% от общего прихода. Расчет вести на 1000 м3 исходной газовой смеси. Средние молярные теплоемкости, кДж/(кмоль × К): СО – 30,5; Н2 – 20,4; СН3ОН – 74,2.
14. Получение формальдегида происходит по реакции
СН3ОН + 0,5О2 ® СН2О + Н2О + 159 кДж.
Степень превращения метилового спирта составляет 50%. Начальная температура газов равна 27ºС. Исходная смесь содержит 35 об. % СН3ОН, остальное – воздух. Определить количество тепла, которое необходимо отвести из контактного аппарата, чтобы температура газа на выходе составляла 325°С. Потери тепла в окружающую среду равны 2% от прихода. Молярные теплоемкости, кДж/(кмоль × К): СН3ОН – 74,2; воздуха – 29,4; водяного пара – 33,2; СН2О – 35,4. Расчет вести на 1 т 40%-ного раствора формальдегида.
15. На абсорбцию поступает газ, содержащий 70 об. % HCl. Абсорбция осуществляется в адиабатическом режиме с получением соляной кислоты, содержащей 37 мас. % HCl. Тепло абсорбции (DНр = -58 кДж/моль) отводится за счет испарения воды (DНисп = 2244 кДж/кг). Рассчитать расход газа и воды на получение 1000 кг кислоты, если отходящий газ содержит 1 об. % HCl.
16. Аммиак образуется из азотоводородной смеси стехиометрического состава по реакции
N2 + 3Н2 = 2NН3; ΔН = –89 кДж.
Вычислить количество отводимого тепла, если смесь поступает с температурой 700 К, а выходит из аппарата с температурой 800 К и содержит 25 мас. % аммиака.
Средние теплоемкости газов, Дж/(моль ∙ град):
N2 Н2 NН3
при 700 К 30,01 29,15 41,71
при 800 К 30,22 29,28 43,09
17. Рассчитать материальный и тепловой балансы печи для производства сульфата калия и хлористого водорода и расходный коэффициент по топливу, если протекает реакция
2KCl + H2SO4 = K2SO4 + 2HCl
Расход хлорида калия составляет 1600 кг/ч, состав, мас. % (на сухое): KCl – 98; NaCl – 2; влага – 3, температура - 15°С; серная кислота подается по стехиометрии, концентрация 98%, температура 15°С; реакция проходит на 98%; продукты выгружаются с температурой 480°С, а газы отводятся с температурой 500°С; теплотворная способность мазута Q = 37 МДж/кг; тепловой КПД печи составляет 75%.
18. На выходе из контактного аппарата окисления SO2 температура газа составляет 860 К, а степень окисления SO2 – 0,65. Найти температуру Т1 исходной смеси следующего состава, об. %: SO2 – 8; О2 – 13; N2 – 79. Окисление SO2 идет по реакции
SO2 + 0,5О2 = SO3; DН  = -107,7 кДж.
= -107,7 кДж.
Средние молярные теплоемкости газов при температуре Т1, Дж/(моль × К): SO2 – 43,53; SO3 – 58,0; О2 – 30,0; N2 – 29,49. Средние молярные теплоемкости газов при температуре 860 К, Дж/(моль × К): SO2 – 45,16; SO3 – 60,82; О2 – 30,77; N2 – 29,76.
19. Определить температуру, развиваемую контактным аппаратом окисления аммиака, по следующим данным: в аппарат поступает 30 000 м3 аммиачно-воздушной смеси, содержащей 10 об. % аммиака, нагретой до 573 К. Степень окисления аммиака - 0,96. Энтальпия реакции ΔН0 = -226 450 кДж. Потери тепла в окружающую среду составляют 5% от прихода. Средняя молярная теплоемкость газовой смеси до реакции 29,74 кДж/(кмоль · К), после реакции - 32,34 кДж/(кмоль · К).
20. Составить материальный и тепловой балансы реактора синтеза этилового спирта, где протекает реакция
СН2=СН2 + Н2О = С2Н5ОН + 46 090 кДж,
если исходный газ имеет состав, об. %: Н2О - 40; С2Н4 - 60; скорость его подачи в реактор-гидратор составляет 2000 м3/ч, температура на входе - 290ºС, на выходе из реактора - 341°С, конверсия этилена - 5%. Молярная теплоемкость продуктов на входе и на выходе одинакова и равна 27,1 кДж/(кмоль · К). Потери теплоты в окружающую среду составляют 3% от прихода теплоты.
21. Рассчитать количество теплоты, которое нужно отвести с помощью холодильника из реактора синтеза метанола, если исходный синтез-газ имеет состав, об. %: СО – 20; Н2 – 80; объемный расход синтез-газа составляет 100 000 м3/ч; температура на входе в реактор – 200ºС, на выходе – 300ºС. Степень превращения СО составляет 35%. Средняя молярная теплоемкость газа на входе и на выходе одинакова и равна 32,5 кДж/(кмоль · град).
22. В котел-утилизатор поступает газ с температурой 1373 К. Определить расход воды с температурой 313 К на питание котла, если уходящий газ имеет температуру 773 К, а энтальпия пара – 3010 кДж/кг. Расход газа, поступающего в котел, равен 2000 м3/ч. Состав газа, об. %: SO2 – 9; O2 – 9; N2 – 82. Потери тепла в окружающую среду составляют 5% от прихода.
23. Составить тепловой баланс реактора для получения водорода каталитической конверсией метана. Производительность по метану равна 6000 кг/ч, потери тепла в окружающую среду – 10% от прихода. Молярное соотношение Н2О : СН4 составляет 3,2 : 1, а степень конверсии метана – 62%. Температура реагентов равна 600 К, продуктов – 1000 К. Определить количество тепла, затраченное на проведение процесса по реакции
СН4 + Н2О = СО + 3Н2О; ΔН  = 206,2 кДж.
= 206,2 кДж.
24. Найти температуру на выходе из реактора синтеза метанола, если ΔН  составляет 90,085 кДж. В реактор поступает 35 000 м3/ч исходного газа состава об. %: СО – 20; Н2 – 80, температура на входе – 473 К, конверсия СО a = 25%. Средняя теплоемкость газа на входе и выходе
составляет 90,085 кДж. В реактор поступает 35 000 м3/ч исходного газа состава об. %: СО – 20; Н2 – 80, температура на входе – 473 К, конверсия СО a = 25%. Средняя теплоемкость газа на входе и выходе  равна 32,3 кДж/(кмоль ∙ К). Количество теплоты, отводимое из зоны реакции с помощью холодильника, составляет 3 600 000 кДж/ч.
равна 32,3 кДж/(кмоль ∙ К). Количество теплоты, отводимое из зоны реакции с помощью холодильника, составляет 3 600 000 кДж/ч.
Коэффициенты рыночной активности
| Наименование показателей | Источник информации | Величина за ____ год | Величина за ____ год | Величина за ____ год |
| 1. Рыночная цена акции | Данные котировки | |||
| 2. Прибыль на акцию | Ф2 стр.320 | |||
| 3. Балансовая стоимость акции | (П1+П2)ср./ Ф2 стр.300 | |||
| 4. Отношение рыночной цены и прибыли акцию | 1:2 | |||
| 5. Соотношение рыночной и балансовой стоимости акции | 1:3 | |||
| 6. Доля выплаченных дивидендов | Ф2 стр.300* стр.340/ Ф2 стр.220 |
| Таблица 5 Анализ динамики уровня прибыли | ||||
| Показатели | Источник информации Ф №2 | ____ г (тыс. грн.) | ____ г. (тыс. грн.) | ____ г. (тыс. грн.) |
| 1. Выручка от реализации продукции (работ, услуг) | стр. 010 | |||
| 2. Доход от реализации продукции (работ, услуг) без НДС и акцизов (чистая выручка) | стр. 035 | |||
| 3. Валовая прибыль (убыток) | стр. 050 (стр. 055) | |||
| 4. Финансовый результат от операционной деятельности (ФРОД) (убыток) | стр.100 (стр.105) | |||
| 5. Прибыль до налогообложения (убыток) | стр.170 (стр. 175) | |||
| 6. Чистая прибыль (убыток) | стр.220 (стр. 225) |
Таблица 6
Условные обозначения (промежуточная таблица)
| Условные обозначения | Название показателя | Величина за ____ год | Величина за ____ год | Величина за ____ год | |
| Ибср | 280 ср | Средняя стоимость активов | |||
| П1ср+П2ср+ +П5 ср | (380+430+ +630) ср | Средняя стоимость собственного капитала | |||
| П3 ср | 480 ср | Средняя стоимость долгосрочного кредита | |||
| П4 ср | 620 ср | Расчеты и прочие краткосрочные пассивы | |||
| А1 ср | 080 ср | Средняя стоимость основных средств и прочих необоротных активов | |||
| А2ср+А3 ср | (260+270) ср | Средняя стоимость оборотных активов | |||
| Зап ср | (100…140) ср | Средняя величина производственных запасов | |||
| ДС ср | (150…240)ср (кроме *) | Средняя величина денежных средств и дебиторской задолженности | |||
| ДЗ ср | (150…210) ср | Средняя величина дебиторской задолженности | |||
| ГП ср | 130 ср | Средние запасы готовой продукции | |||
| КрЗ ср | 520…610 ср | Средняя величина кредиторской задолженности | |||
| Анл ср | (220…250) ср | Наиболее ликвидные активы |
Таблица 7
Дата добавления: 2015-01-05; просмотров: 249; Мы поможем в написании вашей работы!; Нарушение авторских прав |