
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Концентрационный гальванический элемент его устройство химизм работы и расчет его эдс
Концентрационный элемент — это гальванический элемент, состоящий из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными концентрациями С1 > С2. Катодом в этом гальваническом элементе является электрод, погруженный в раствор с большей концентрацией, а анодом соответственно погруженным в раствор с меньшей концентрацией[1].
В качестве примера концентрационного элемента можно привести концентрационный свинцовый гальванический элемент. Электроды этого элемента сделаны из свинца, при этом один из электродов которого погружен в раствор соли свинца с концентрацией Pb2+ равной 0,1 моль/л, а другой — в раствор с концентрацией Pb2+ равной 0,01 моль/л.
Схема данного элемента: 
В данном элементе происходят электродные процессы:
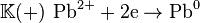 - реакция восстановления
- реакция восстановления
 - реакция окисления
- реакция окисления

Работа гальванического элемента основана на разнице в активности металлов катодной и анодной пластин. Иными словами, на различной энергии выхода иона металла в раствор из пластины, погруженной в раствор. Вместо энергии выхода иона, обычно пользуются понятием электродный потенциал металла, который тесно связан с электроотрецательностью, радиусом иона и валентностью металлов. Существует специальный ряд стандартных электродных потенциалов, сокращенный вариант которой представлен на рисунке 1.

В этом ряду активность металлов увеличивается с право на лево, то есть, чем левее находится металл в этом ряду, тем легче его ионы покидают металлическую поверхность, переходя в раствор ("соблазнившись” на отрицательный заряд на диполях воды). К примеру, металлы с лития по натрий, при погружении в воду, энергично насыщают ее катионами, превращая в раствор щелочи. Получившийся раствор при этом вскипает от нагрева и пузырьков водорода. Металлы правее меди могут лежать хоть на дне океана многие века, практически не растворяясь.
Этот ряд также полезен тем, что при взаимодействии кислород содержащих кислот и металла, продукты реакции зависят от положения металла в этом ряду. Металлы левее марганца при реакции с кислотой, дают соль и газообразный водород. Металлы правее водорода, дают соль, воду и оксид неметалла в степени близкой к высшей (для азотной, например, NO2). Металлы средней части при реакции дают соль, воду и низший оксид неметалла (для азотной, NO).
37. Практическое применение химических источников тока: сухие гальванические элементы, электрохимические аккумуляторы, топливные элементы.
На основе электрохимических систем осуществляются многие технологические процессы и процессы преобразования энергии (химические источники тока – ХИТ). Достоинства ХИТ – высокий КПД, бесшумность, безвредность, возможность использования под водой, в космосе, в переносных устройствах. К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы.
Большое распространение получили гальванические элементы (однократного действия).
«Классическим» ХИТ является сухой марганцово-цинковый элемент. Исп-ся для питания радиоаппаратуры, карманных фонарей и т.п.
В современных условиях большое распространение получили литиевые ХИТ. В них применяются литиевые аноды, органический электролит и катоды из различных материалов. Они обладают очень большими сроками хранения, высокими плотностями энергии и работоспособны в широком интервале температур от –25 до +85 OC, поскольку не содержат воды. Важным видом ХИТ являются топливные элементы, в которых в электрическую энергию переводится реакция горения водорода, углеводородного и других видов топлива. Наиболее энергетически выгодный вид топлива – водород. На катод подается кислород или воздух (тогда «продуктом» является еще и азот). Электроды – мелкопористые никелевые или угольные, погружены в щелочной раствор электролита (30-40%). Именно они были источником энергии на кораблях «Аполлон» американской лунной программы. Они исп-ся в спутниках и космических кораблях; пытаются применять их вместо двигателей внутреннего сгорания на транспорте.Кроме гальванических элементов широко распространены также аккумуляторы, которые, в отличие от гальванических элементов, являются ХИТ многократного действия. В аккумуляторах под воздействием внешнего источника тока накапливается химическая энергия – зарядка аккумулятора. Затем эта энергия переходит в электрическую – разрядка аккумулятора. Свинцовые аккумуляторы, изобретенные ещё на заре электротехники, в 1869 году, до сих пор широко используются в технике. Свинцовый аккумулятор состоит из двух пористых свинцовых пластин. В ячейки пор запрессовывается смесь PbO с глицерином. Пластины опускаются в 25-30% раствор H2SO4. Аккумуляторы соединяют в батарею, которая помещается в баки из эбонита или полипропилена. В результате взаимодействия PbO с H2SO4 в порах обоих электродов образуется PbSO4.Используется не только в автомобилях - современные свинцовые аккумуляторы (мощностью примерно 10 МВт, с расчетной емкостью 40 МВт/ч) используются на электрической подстанции для выравнивания максимальных пиковых нагрузок. В автомобилестроении свинцовые аккумуляторы имеют перспективу существенного усовершенствования. Второй тип электрохимических процессов – электролиз – также широко представлен в современной технике и технологиях. С помощью электролиза получают в промышленных масштабах все щелочные и щелочноземельные металлы (Li, Na, K, Mg, Sr, Ca), а также Al, Ni, Zn, Cr, Mn и другие металлы.С помощью электролиза (процесс гальваностегии) на металлы наносятся покрытия из других металлов, что позволяет получать защитные, а также декоративные пленки и слоистые композиционные материалы.Электролитическим путем получают и такие важные химические агенты, как NaOH, KOH, Cl2 и ряд других.Методы гальванопластики (получение точных металлических копий различных изделий) широко применяются в машиностроении, электротехнике и других отраслях промышленности, а также в художественном творчестве.
Дата добавления: 2015-01-19; просмотров: 1046; Мы поможем в написании вашей работы!; Нарушение авторских прав |