
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Первое начала термодинамики
 Внутренняя энергия системы может изменяться за счет энергии, сообщаемой системе извне. Эта энергия может сообщаться системе посредством двух процессов: либо за счет работы, производимой внешними силами над системой, либо за счет передачи ей тепла. Рассмотрим газ, сжимаемый в сосуде поршнем под действием силы F (рис.). Пусть под действием этой силы поршень переместился на расстояние dh, сжав газ. Работа силы на пути dh dA = Fdh.
Внутренняя энергия системы может изменяться за счет энергии, сообщаемой системе извне. Эта энергия может сообщаться системе посредством двух процессов: либо за счет работы, производимой внешними силами над системой, либо за счет передачи ей тепла. Рассмотрим газ, сжимаемый в сосуде поршнем под действием силы F (рис.). Пусть под действием этой силы поршень переместился на расстояние dh, сжав газ. Работа силы на пути dh dA = Fdh.
Разделив величину силы на площадь поршня, получим давление P, а умножив на S, получим изменение объема газа dV . Таким образом, производимая над газом работа
dA= PdV.
 Такую же по величине работу совершает газ при расширении, перемещая поршень. При этом dV положительно, если газ расширяется, и отрицательно при сжатии газа. Соответственно работа dA положительна или отрицательна: в первом случае система производит работу сама, во втором — внешние силы производят работу над системой.
Такую же по величине работу совершает газ при расширении, перемещая поршень. При этом dV положительно, если газ расширяется, и отрицательно при сжатии газа. Соответственно работа dA положительна или отрицательна: в первом случае система производит работу сама, во втором — внешние силы производят работу над системой.
Графически процесс изменения состояния газа при его расширении или сжатии изображается на кривой P, V участком 1-2 на рис. Полная работа, совершаемая газом, при расширении от V1 до V2:
 .
.
Эта работа численно равна заштрихованной площади, заключенной под кривой P(V).
Рассмотрим способы передачи телу тепла. При соприкосновении тел либо при взаимодействии тел через излучение, изменение внутренней энергии происходит за счет передачи энергии хаотически движущихся частиц одного тела частицам другого.
Энергия, передаваемая от одного тела другому, представляет собой теплоту. Обозначим ее через Q. Теплота измеряется в тех же единицах, что и энергия.
Связь между переданным теплом, изменением внутренней энергии системы и произведенной работой выражается уравнением
dQ = dE + dA = dE + PdV.
Это уравнение представляет собой закон сохранения энергии применительно к механической и тепловой энергии макроскопических тел. Он получил название первого начала термодинамики.
ΔQA = ΔUA + Aint
Важно учесть, что в выражении (2.32) работа и количество тепла не есть полные дифференциалы каких-либо величин, в то время как внутренняя энергия является таковой. Можно говорить о внутренней энергии в данном состоянии, а не о количестве тепла или работы, которыми обладает тело. Нельзя делить энергию тела на тепловую и механическую, речь идет лишь об изменении внутренней энергии тела за счет количества тепла, переданного ему или отданного им, и количества совершенной работы. Это разделение неоднозначно и зависит от начального и конечного состояний тела и от характера совершаемого процесса. Поэтому, например, в процессе перехода из состояния 1 в состояние 2 изменение внутренней энергии может быть равно нулю, а тело при этом может приобрести или потерять энергию.
28. Теплоёмкость. Молярная и удельная теплоёмкости. Связь между ними. Формула Майера.
Количество тепла, при получении которого температура тела повышается на один градус, называется теплоемкостью. Согласно этому определению
 .
.
Теплоемкость, отнесенная к единице массы, называется удельной теплоемкостью. Теплоемкость, отнесенная к одному молю, называется моляpной теплоемкостью.
Итак, теплоемкость опpеделяется чеpез понятие количества теплоты. Но последнее, как и pабота, зависит от пpоцесса. Значит и теплоемкость зависит от пpоцесса. Сообщать теплоту - нагpевать тело - можно пpи pазличных условиях. Однако пpи pазличных условиях на одно и то же увеличение темпеpатуpы тела потpебуется pазличное количество теплоты. Следовательно, тела можно хаpактеpизовать не одной теплоемкостью, а бесчисленным множеством (столько же, сколько можно пpидумать всевозможных пpоцессов, пpи котоpых пpоисходит теплопеpедача). Однако на пpактике обычно пользуются опpеделением двух теплоемкостей: теплоемкости пpи постоянном объеме и теплоемкости пpи постоянном давлении.
Теплоемкость различается в зависимости от того, при каких условиях происходит нагревание тела — при постоянном объеме или при постоянном давлении.
Если нагревание тела происходит при постоянном объеме, т. е. dV = 0, то работа равна нулю. В этом случае передаваемое телу тепло идет только на изменение его внутренней энергии, dQ = dE, и в этом случае теплоемкость равна изменению внутренней энергии при изменении температуры на 1 К, т. е.
 .
.
Поскольку для газа  , то
, то 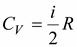 .
.
Эта формула определяет теплоемкость 1 моля идеального газа, называемую молярной. При нагревании газа при постоянном давлении его объем меняется, сообщенное телу тепло идет не только на увеличение его внутренней энергии, но и на совершение работы, т.е. dQ = dE + PdV. Теплоемкость при постоянном давлении 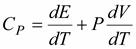 .
.
Для идеального газа PV = RT и поэтому PdV = RdT.
Учитывая это, найдем
 .
.
Отношение  представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Измерение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
представляет собой величину, характерную для каждого газа и определяемую числом степеней свободы молекул газа. Измерение теплоемкости тела есть, таким образом, способ непосредственного измерения микроскопических характеристик составляющих его молекул.
 Формулы для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно формулам, полученным выше, теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис., полученная опытным путем для двухатомного газа водорода. На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (2.35), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об идеальном газе для описания реальных свойств вещества.
Формулы для теплоемкости идеального газа приблизительно верно описывают эксперимент, причем, в основном, для одноатомных газов. Согласно формулам, полученным выше, теплоемкость не должна зависеть от температуры. На самом деле наблюдается картина, изображенная на рис., полученная опытным путем для двухатомного газа водорода. На участке 1 газ ведет себя как система частиц, обладающих лишь поступательными степенями свободы, на участке 2 возбуждается движение, связанное с вращательными степенями свободы и, наконец, на участке 3 появляются две колебательные степени свободы. Ступеньки на кривой хорошо согласуются с формулой (2.35), однако между ними теплоемкость растет с температурой, что соответствует как бы нецелому переменному числу степеней свободы. Такое поведение теплоемкости указывает на недостаточность используемого нами представления об идеальном газе для описания реальных свойств вещества.
Связь молярной теплоёмкости с удельной теплоёмкостью
С=M•с, где с — удельная теплоёмкость, М — молярная масса.
Дата добавления: 2015-01-19; просмотров: 245; Мы поможем в написании вашей работы!; Нарушение авторских прав |