
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Классификация липидов
Биологическая роль липидов
1. Ацилглицеролы являются источником энергии в организме. При окислении 1 г их выделяется 9,1 ккал.
2. Ацилглиценролы жировых депо являются не только запасным энергетическим материалом, но и защищают тело от переохлаждения, травм, фиксируют органы.
3. Фосфоглицериды входят в состав транспортных и структурных липопротеинов. Из последних построены мембранные структуры клеток.
4. Сфинголипиды входят в состав нервной ткани.
5. Из стеридов синтезируются холестерин, гормоны половых желез коркового слоя надпочечников и желчные кислоты.
6. Воска образуют верхний слой растений, пчелиные соты.
Классификация липидов
1. Ацилглицеролы (нейтральные жиры).
2. Фосфоглицериды.
3. Сфинголипиды: сфингомиэлины, цереброзиды и ганглиозиды.
4. Стериды.
5. Воска.
2)Выработка молока в молочных железах начинается в конце беременности под действием гонадотропных гормонов. В первые дни лактации вырабатывается молозиво. В нем содержится 14,8-18,1 % белков, в которых в 20 раз больше, чем в молоке альбуминов и глобулинов, особенно γ-глобулинов, через которые новорожденному передается иммунитет. γ-глобулины не расщепляются в органах пищеварительной системы протеолитическими ферментами.В дальнейшем вырабатывается молоко. Состоит оно из плазмы и жировых шариков. Содержится в молоке 90 % воды, 2,9-5 % белков, липидов 3,5-7,5 %, углеводов 2,5-6,5 %, 1,5 минеральных веществ, 0,02-0,04 % небелковых азотистых веществ, 0,02-0,04 мг% витаминов, в частности каротина. 80 % от общего количества белков приходится на казеиноген. В нем содержится фосфор, кальций, все незаменимые аминокислоты. Различают 3 фракции казеиногена, отличающиеся друг от друга по структуре. Содержатся в молоке также лактоальбумин, иммуноглобулины, пептиды и свободные аминокислоты. Углеводы молока представлены главным образом лактозой, расщепляющейся в тонком кишечнике до глюкозы и галактозы. Последняя в печени превращается в глюкозу. Из липидов в молоке больше всего ацилглицеролов, содержащих главным образом олеиновую и пальмитиновую кислоты. Меньше в их составе миристиновой, каприловой, капроновой и других кислот. В состав липидов молока входят также фосфоглицериды и холестерин. В липидами связаны жирорастворимые витамины. Имеются в составе молока и водорастворимые витамины В1, В2, В3 , В6,Вс , В12 и другие а также макро- и микроэлементы (натрий, калий, кальций, магний, фосфор, медь, марганец и др.). Молоко содержит недостаточное количество железа, цинка, кальция и фосфора и их необходимо дополнительно принимать.
3) Дезаминирование аминокислот -реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Существует несколько способов дезаминирования аминокислот: внутримолекулярное, Восстановительное,Гидролитическое,окислительное.
на пример: 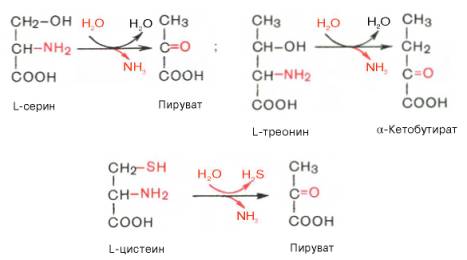
Билет 22,
1.липиды-фосфоглицериды.
2.свойства ферментов.
3.реакция анаэробного гликолиза,связаных с выроботкой атф.
1) Фосфолипиды (фосфоглицериды) - это сложные липиды, производные фосфатидной кислоты.
Основные структурные компоненты, составляющие молекулы фосфоглицеридов, – это глицерин, жирные кислоты, фосфорная кислота, аминоспирты (этаноламин или холин) или аминокислота серин.
2) Свойства ферментов
1. Высокая каталитическая активность – способность повышать скорость реакций в миллионы-миллиарды раз. Неорганические катализаторы увеличивают ее лишь в тысячи раз.
2. На активность фермента влияет концентрация субстрата. При увеличении последней активность фермента возрастает, но до определенного предела. Концентрация субстрата, при которой активность фермента равна 0,5 от максимальной, называется константой Михаэлиса.
3. На активность фермента влияет концентрация продукта реакции. При постепенном накоплении последнего в среде она снижается. Поэтому активность фермента определяют на начальном этапе реакции, когда субстрат еще не накопился.
4. Активность ферментов зависит от рН среды. В зависимости от рН изменяется диссоциация ионогенных групп в активном центре фермента и в молекуле субстрата, что влияет на скорость реакции. Большинство ферментов наиболее активны в слабощелочной среде. Исключение – пепсин желудочного сока и катепсины лизосом, активные в кислой среде.
5. На активность фермента влияет температура среды. Обычно при повышении ее на 10оС скорость реакции увеличивается в 2 раза (правило Ван Гоффа). Наиболее активны ферменты млекопитающих при 40-50 о. При более низкой температуре активность тормозится из-за снижения диссоциации ионогенных групп, а при более высокой – из-за денатурации белковой молекулы.
6. Ферменты обладают специфичностью, т.е. способность воздействовать лишь на определенный субстрат. Различают различные виды специфичности.
а. Абсолютная специфичность, когда фермент действует лишь на один субстрат. Например, фумаратгидратаза действует только на фумаровую кислоту.
б. Групповая специфичность, когда фермент действует на несколько сходных по структуре субстратов. Например, липаза расщепляет ацилглицеролы, состоящие из различных жирных кислот.
г. Стереоспецифичность, когда фермент действует только на определенный пространственный изомер. Например, фумаратгидратаза не действе на стереоизомер фумаровой кислоты – малеиновую кислоту.
7. На активность ферментов влияют вещества, повышающие скорость реакции (активаторы) и снижающие ее (ингибиторы). Некоторые ферменты вырабатываются неактивными и при помощи активаторов переходят в активные. Например, энтерокиназа отщепляет от трипсиногена часть молекулы и он превращается в активный трипсин. Активаторами могут быть ионы металлов, субстраты, продукты других реакций, гормоны и другие вещества.
Ингибиторы по характеру торможения активности фермента могут быть обратимыми и необратимыми. В первом случае комплекс фермент-ингибитор может расщепляться и активность фермента восстанавливается. При необратимом ингибировании образуется прочная связь между ферментом и ингибитором.
По механизму действия ингибиторы делят на конкурентные, неконкурентные, субстратные и аллостерические.
а. При конкурентном ингибировании структура ингибитора близка к структуре субстрата и он конкурирует за активный центр. Например, малоновая кислота по структуре близка к янтарной кислоте и поэтому способна связывать активный центр сукцинатдегидрогеназы. Ингибирование можно ослабить увеличением концентрации субстрата. На конкурентном ингибировании основано действие сульфаниламидов. Они по строению сходны с п-аминобензойной кислотой, необходимой микроорганизмам. Сульфаниламиды, занимая место последней, тормозят рост микроорганизмов.
б. Неконкурентное ингибирование развивается под действием вещества, структура которого не сходная со структурой субстрата. Оно связывается не с активным центром, а с другими участками молекулы фермента. Последний после этого может образовывать комплекс с субстратом, но внутри этого комплекса реакция не протекает. Например, ионы тяжелых металлов связывают HS-группы ферментов, ингибируя их. Цианиды связываются с ионом железа цитохромоксидазы, прекращая дыхание митохондрий. Неконкурентное ингибирование, в отличие от конкурентного, не снимается избытком субстрата.
в. Субстратное ингибирование развивается иногда при увеличении в среде концентрации субстрата. Его снимают, уменьшая концентрацию последнего.
г. Аллостерическое ингибирование развивается тогда, когда вещество, сзязываясь с аллостерическим центром, изменяет конфигурацию активного центра, блокируя его. Такими ингибиторами могут быть собственный продукт реакции, продукты других реакций, гормоны и другие вещества.
3) 

Рисунок 1
Билет 21
1. липиды-ацилглицеролы.
2. атф: строение, биологическая роль. Фосфорилирование.
3. биологичиская роль реакции анаэробного гликолиза.
1) Ацилглицеролы, или нейтральные липиды, - наиболее распространенная в природе группа липидов. Эти соединения представляют собой сложные эфиры жирных кислот pj трехатомного спирта глицерола (глицериды), в котором могут быть этерифицированы одна, две или три гидроксильные группы.
2) Аденозинтрифосфат — нуклеотид, содержащий 3 остатка фосфорной кислоты. 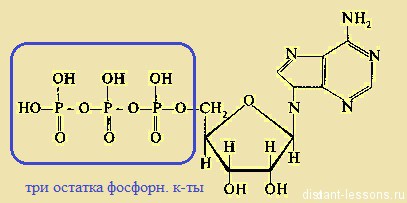
Главная роль АТФ в организме связана с обеспечением энергией многочисленных биохимических реакций. Являясь носителем двух высокоэнергетических связей, АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов. Всё это реакции синтеза сложных веществ в организме: осуществление активного переноса молекул через биологические мембраны, в том числе и для создания трансмембранного электрического потенциала; осуществления мышечного сокращения.
Помимо энергетической АТФ выполняет в организме ещё ряд других не менее важных функций:
· Вместе с другими нуклеозидтрифосфатами АТФ является исходным продуктом при синтезе нуклеиновых кислот.
· Кроме того, АТФ отводится важное место в регуляции множества биохимических процессов. Являясь аллостерическим эффектором ряда ферментов, АТФ, присоединяясь к их регуляторным центрам, усиливает или подавляет их активность.
· АТФ является также непосредственным предшественником синтеза циклического аденозинмонофосфата — вторичного посредника передачи в клеткугормонального сигнала.
· Также известна роль АТФ в качестве медиатора в синапсах и сигнального вещества в других межклеточных взаимодействиях (пуринергическая передача сигнала).
Аденозиндифосфат (АДФ) + Н3РО4 + энергия → АТФ.

Синтез АТФ из АДФ и Н3РО4 называется фосфорилированием. Различают две разнолвидности его: субстратное и окислительное фосфорилирование. Первое из них (субстратное фосфорилирование) протекает за счет энергии, освобождающейся при расщеплении макроэргических (богатых энергией) химических связей некоторых веществ- субстратов: 1,3-дифосфоглицериновой, фосфоенолпировиноградной кислот (в реакциях окисления глюкозы ) и активной формы янтарной кислоты (в реакциях окисления активной формы уксусной кислоты в цикле Кребса); 2) за счет энергии освобождающейся при окислении кислородом ионов водорода ферментами дыхательной цепи, расположенной на внутренней мембране митохондрий (окислительное фосфорилирование).
3) Этот процесс является источником АТФ в клетках, особенно при недостатке кислорода в тканях. При окислении одной молекулы глюкозы в реакциях субстратного фосфорилирования образуется 4 молекулы АТФ: по 2 молекулы его в фосфоглицераткиназной и пируваткиназной реакциях. 2 молекулы АТФ затрачиваются на начальных этапах гликолиза: в гексокиназной фосфофруктокиназной реакциях. В конечном итоге, в реакциях анаэробного гликолиза из одной молекулы глюкозы генерируется 2 молекулы АТФ. При этом образуются 2 молекулы молочной кислоты, способные закислять ткани. Поэтому молочная кислота в реакциях глюкоконеогенеза обратно превращается в глюкозу.
билет 26
1. гидрофобные аминокислоты.
2. ферменты-гидролазы, расщепляющие ацилглицеролы.
3. транскрипция- биосинтез информационной РНК.
1) гидрофобные аминокислоты.

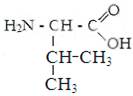
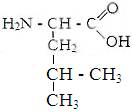

Глицин. Аланин Валин Лейцин
2) Гидролазы расщепляют вещества с присоединением к месту разрыва молекулы воды. Широко распространены. Гидролазы подкласса 3.1, эстеразы, расщепляют сложноэфирные связи эфиров фосфорной, карбоновых кислот, тиолов и т.д.
СН2 -О-СО-С17Н35 СН2 -ОН
1 1
С17Н35 –CO-О-СН Липаза НО-СН + 3 С17Н35 - СООН
1 1
СН2-О-СО-С17Н35 + 3 Н2О СН2-ОН Стеариновая кислота
Тристеарин Глицерол.
Транскрипция – сборка на поверхности гена расплетенной молекулы ДНК информационной РНК (иРНК). Различают четыре этапа этого процесса.
1. Инициация – поступление сигнала от внешнего фактора, образование цАМФ, формирование его комплекса с БАКГ (белком, активирующим катаболический ген) с последующим присоединением иРНК-полимеразы к промотору.
2.Элонгация – продвижение иРНК-полимеразы через оператор к триплетам гена, присоединение к нуклеотидам триплетов ДНК нуклеотидов РНК (АМФ, ГМФ, ЦМФ и УМФ) ядерной жидкости по правилу комплементарности (аденин-урацил, тимин-аденин, цитозин-гуанин, гуанин-цитозин). Между третьим углеродным атомом рибозы и фосфорной кислотой соседнего нуклеотида образуется фосфоэфирная связь. Реакцию катализирует ДНК-зависимая иРНК-полимераза.
3.Терминация – прекращение сборки иРНК по достижении иРНК-полимеразой терминирующего триплета. Образуется пре-иРНК (транскрипт), имеющая в своем составе информативные (экзоны) и неинформативные участки (интроны).
4. Процессинг – превращение пре-иРНК в зрелую иРНК. Это достигается вырезанием интронов ферментом инстректаза и соединением информативных участков иРНК между собой (сплайсинг). Образовавшаяся иРНК соединяется с белком информфером, который доставляет ее в рибосому.
Дата добавления: 2015-01-19; просмотров: 398; Мы поможем в написании вашей работы!; Нарушение авторских прав |
| <== предыдущая лекция | | | следующая лекция ==> |
| Государственные финансы. Структура государственного бюджета. | | | JPEG 2000 (или jp2). |