
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Порядок расчета
Ниже приводятся подробные пояснения к расчетам по обработке результатов химического анализа подземных вод, отображенные в вышележащей таблице 2.3.
1. Расчет ионов из мольной формы (ммоль/дм3, мг-экв/л) в массовую ионную форму (мг/дм3, мг/л).
Зная содержание в воде иона в мольной форме (ммоль/дм3, мг-экв/л), можно определить его содержание в массовой форме (мг/дм3, мг/л).
Например, содержание гидрокарбоната-иона в задании равно: (48,0 • 61 = 2928,0 мг/дм3 или мг/л), где 48,0 (ммоль/дм3, мг-экв/л), – содержание иона по условию задачи, 61,0 – пересчетный коэффициент.
2. Для определения погрешности анализа воды отдельно суммируют содержание анионов и катионов в мольной (мл-эквивалентной) форме (ммоль/дм3, мг-экв/л). Сумма анионов равна 80,0 (ммоль/дм3, мг-экв/л), сумма катионов равна 80,3 (ммоль/дм3, мг-экв/л). Отсюда, относительная погрешность (Х) анализа равна:
 (2.6)
(2.6)
3. Далее выражают химический состав воды в в процент-мольной форме (%-моль, %-экв), приняв суммы анионов и катионов за 100 % каждую, и записывают по порядку в следующую графу таблицы.
Например, сумму анионов и катионов равную 160,3 (ммоль/дм3, мг-экв/л) принимают за 200 %, и, в частности, хлор-ион равен 16 (ммоль/дм3, мг-экв/л), его принимают за неизвестное процент-мольное число (Cl- = х, в %-моль). Решая пропорцию, получаем значение хлора-иона в процент-мольной форме (%-экв), то есть, Cl- = х = (16 • 200/160,3) = 20 %-экв, и т.д. для всех ионов.
4. В связи с тем, что при анализе воды сухой остаток не определялся, (то есть минерализация воды), вычисляют его приближенно. При выпаривании все не газообразные вещества, кроме гидрокарбоната-иона, переходят в сухой остаток. Гидрокарбонат-ион распадается по уравнению:
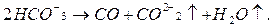 (2.7)
(2.7)
При этом в виде диоксида углерода и паров воды теряется около половины его массы (точно 0,508). Экспериментально определенный сухой остаток всегда больше вычисленного (с учетом 1/2 НСО3-), иногда на 5÷12 %.
Учитывая это, общую минерализацию (сухой остаток) приближенно вычисляют с учетом поправочного коэффициента равного 1,1 по уравнению:
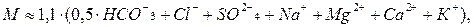 (2.8)
(2.8)
или расчетная минерализация равна:
 (2.9)
(2.9)
5. Концентрация водородных ионов характеризует кислотно-щелочные свойства воды. Вода обладает общекислотной агрессией (рН = 5,6).
Классификация воды по общей минерализации, температуре и водородному показателю приведена в таблице 2.4.
6. Общую жесткость определяют как сумму катионов кальция и магния, выраженных в ммоль/дм3 или мг-экв/л, например:
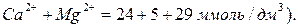 (2.10)
(2.10)
По этому показателю данная вода классифицируется как очень жесткая (см. таблицу 2.4). Например, магнитная обработка воды резко снижает образованиенакипи на стенках котлов ТЭЦ.
7. В данном случае формула Курлова имеет такой вид:
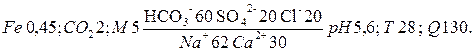 (2.1.1)
(2.1.1)
В наименование состава воды включаются анионы гидрокарбоната - НСО3- и катионы натрия и кальция – Na+ и Ca2+, содержание которых превышает 25 процент-молей (%-экв).
По этой записи воду следует называть: вода – железистая, углекислая, сильносолоноватая, гидрокарбонатно-натриево-кальциевая, кислая, теплая, очень жесткая. Вода высокодебитная, обладает общекислотной агрессией.
Таблица 2.4 - Классифицируемые показатели подземных вод
| Классифицируемые показатели | |||
| По минерализации | измерение | По температуре | измерение |
| г/дм3, г/л | °С | ||
| сверхпресные | < 0,2 | переохлажденные | < 0 |
| пресные | 0,2 ÷ 1 | холодные | 0 ÷ 20 |
| слабосолоноватые | 1 ÷ 3 | теплые | 20 ÷ 37 |
| сильносолоноватые | 3 ÷ 10 | горячие | 37 ÷ 50 |
| соленые | 10 ÷ 35 | весьма горячие | 50 ÷ 100 |
| рассольные | > 35 | перегретые | > 100 |
| По величине рН | измерение | По степени жесткости | измерение |
| б/р | ммоль/дм3 | ||
| очень кислые | < 5 | очень мягкие | < 1,5 |
| кислые | 5 ÷ 7 | мягкие | 1,5 ÷ 3,0 |
| нейтральные | умеренно жесткие | 3,0 ÷ 6,0 | |
| щелочные | 7 ÷ 9 | жесткие | 6,0 ÷ 9,0 |
| высокощелочные | > 9 | очень жесткие | > 9 |
Все воды, согласно классификации Алекина (см. рисунок 2.3) делятся по преобладающему аниону на три класса:
I класс – гидрокарбонатный – С – (НСО3-+CO32-), он объединяет маломинерализованные воды рек, пресных озер и немногие озера с повышенной минерализацией;
II класс – сульфатный – S – (SO42-), по распределению и минерализации занимает промежуточный характер между I и III классами;
III класс – хлоридный – C1 – (Cl-), объединяет минеральные воды морей, лиманов, реликтовых и материнских озер, подземные воды солончаковых районов, пустынь и полупустынь.
Распределение подземных вод на классы уточняется делением каждого класса на три группы по преобладанию одного из катионов: Ca2+, Mg2+, ∑Na++K+. Каждая группа подразделяется на три типа по соотношению между миллимолями ионов (ммоль/дм3).
Вывод:
Учитывая общую минерализацию, химический состав, содержание ионов водорода (рН), температуру и вычисленную жесткость, а также соотношение всех компонентов, показанных на графиках-треугольниках Ферре, окончательно дают воде наименование.
Вода - железистая, углекислая, сильносолоноватая, гидрокарбонатно-натриевая, теплая, кислая, очень жесткая. Вода высокодебитная, обладает общекислотной агрессией.
Вода относится к типу 3а, а именно:
Cl- < Na+ + Mg2+ или 16 мг-экв/л < (50 + 5) мг-экв/л.
Итак, по классификации О.А. Алекина обозначение воды – СIIINа – класс гидрокарбонатных вод, группа натрия, тип третий.
Дата добавления: 2015-01-19; просмотров: 1348; Мы поможем в написании вашей работы!; Нарушение авторских прав |