
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая связь
Лишь немногие химические элементы (благородные газы) при обычных условиях находятся в состоянии одноатомного газа. Атомы остальных элементов могут взаимодействовать друг с другом и с атомами других элементов образуя при этом более или менее сложные частицы (молекулы, молекулярные ионы и свободные радикалы), что указывает на наличие причины, по которой атомы связываются друг с другом. Эта причина получила название химическое связи.
Химическая связь - это результат взаимодействия электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании устойчивой химической системы – молекулы.
Доказано, что в образовании химической связи между атомами главную роль играют валентные электроны, расположенные на внешней оболочке атома и, следовательно, связанные с ядром наименее прочно. Именно поэтому строение валентной электронной конфигурации атомов является определяющим фактором при рассмотрении условий образования химической связи.
Согласно теории химической связи, наибольшей устойчивостью обладают внешние оболочки из двух или восьми электронов (характерные для благородных газов). Это и служит причиной того, что благородные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы же, имеющие на внешней оболочке менее восьми электронов (или иногда менее двух), стремятся приобрести структуру благородных газов. Такая закономерность позволила сформулировать положение, которое является основным принципом образования молекулы: при образовании молекулы атомы стремятся приобрести устойчивую восьмиэлектронную (октет) или двухэлектронную (дублет) оболочки.
Образование устойчивой электронной конфигурации может происходить несколькими способами и приводит к молекулам (и веществам) различного строения, поэтому различают несколько типов химической связи.
Химическая связь, обусловленная взаимодействием двух электронов по одному от каждого атома с образованием общей электронной пары, называется ковалентной связью. Для ее представления используют электронные формулы, в которых ковалентная связь изображается с помощью точек, обозначающих внешние электроны атома, например:

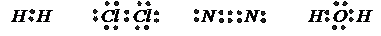 |
При соединении двух атомов водорода в молекулу каждый атом приобретает устойчивую двухэлектронную оболочку, подобную завершенной электронной оболочке атома благородного - гелия. Такие же оболочки имеют атомы водорода в молекулах воды. При соединении двух атомов хлора или двух атомов азота наружная оболочка каждого атома дополняется до устойчивой восьмиэлектронной конфигурации атома неона.
Важное свойство ковалентной связи - ее направленность. Так электронные орбитали имеют разную форму и ориентацию в пространстве, их взаимное перекрывание может осуществляться различными способами (рис. 4.5.).

Рис. 4.5. Схема образования химической связи.
Другим типом химической связи является ионная связь, В отличие от молекул, молекулярные ионы представляют собой многоатомные частицы, несущие электрический заряд, и сами по себе не образуют какое-либо вещество, т.к. между ними существует электростатическое отталкивание, которое может быть скомпенсировано лишь одновременным присутствием эквивалентного числа противоположно заряженных ионов.
Химическая связь, осуществляемая в результате взаимного электростатического притяжения противоположно заряженных ионов, называется ионной связью. Впервые предположения об ионной связи были высказаны в 1916 г. немецким ученым Косселем, который полагал, что при взаимодействии двух атомов один из них отдает, а другой принимает электроны. При этом первый атом превращается в положительно заряженный ион, а второй - в отрицательно заряженный ион. Взаимное электростатическое притяжение образовавшихся ионов приводит к образованию устойчивого соединения.
Дальнейшее развитие этих идей привело к созданию современных представлений об ионной связи. Ионные соединения образуют атомы элементов, резко отличных по электроотрицательности. Образование ионной связи можно проследить на примере хлорида натрия NaCl:
Na – е - = Na+ ; Cl + е - = Сl - ; Na+ + Cl - = NaCl
В обычных условиях ионные соединения представляют собой кристаллические вещества с высокой температурой плавления и кипения. Например, температура плавления NaCl составляет +800○С.
Дата добавления: 2015-01-29; просмотров: 918; Мы поможем в написании вашей работы!; Нарушение авторских прав |