
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Технологическая схема МЭА-очистки.
МЭА очистка газа эксплуатируется в агрегате АМ-76, производительностью 1360 т/сут. Конвертируемая паро/газ. смесь под давлением 2,8 МПа и при температуре 40+50ºС.
Поступает в абс-р (5), орошаемый 17÷20% р-ром МЭА. Абсорбция СО2 осущ-ся в абсорбере с высокослойными ситчатыми тарелками, разделёнными на 2 секции: верхняя, предназначенная для тонкой очистки газа, орошается глубокорегенерированным р-ром (II поток); в нижнюю секцию поступ. груборегенир. р-р (I поток), который смешивается с р-ром из верхней секции. Газ, содержащий до 19% СО2 проходит в начале нижнюю секцию, а затем верхнюю и очищ. до остаточного содер. СО2 не более 0,003 ÷0,010% об.
В верхней части абс-ра газ проходит колпачковые тарелки орошаемые флегмой; сепаратор (4) и поступает на метанирование. Р-р МЭА насыщенный до α = 0,67, выходит из нижн. секции абс-ра (5) при t = 57÷65 ºС, и поступает в регенератор – рекуператор (15). Последний разделён также, как и абсорбер на 2 секции. В верхней секции на ситчатых тарелках расположены U – образные т/обменные элементы, в которые через сетку происходит передача тепла от горячего регенерируемого р-ра к насыщенному р-ру. За счёт тепла ПГС, поступает из нижней секции и тепла регенерируемого р-ра обоих потоков, передаваемого через встроенные т/обменники, насыщенный р-р регенерируется в верхней части и содержание СО2 в нём снижается от 0,67 до 0,35 моль /моль.
Далее раствор делится на 2 равных потока. 1-ый поток – грубогенерированный при t = 114÷120 ºС насосом (13) прокач-ся через встроенные т/обменники, где охлождается до 62 ÷ 70ºС. Дальнейшее охлаждение 1 потока происходит в воздушном холодильнике (12) с доохлаждением в летнее время в водяном холодильнике (10). 2-ой поток через переменные устройства внутри регенератора – рекуператора поступает в нижнюю секцию для более глубокой регенерации до содержания СО2 ≈ 0,12 моль/моль. Тонко-регенерированный р-р при тем-ре 125÷130 ºС из нижней секции регенератора – рекуператора подаётся насосом (16) во встроенные т/обменники, где охлаждается до 62÷70ºС. Дальнейшее охлаждение р-ра осуществляется в воздушном холодильнике (11) и водяном холодильнике (9). Тепло для регенерации р-ра подв-ся с конвертированной ПГС, поступающей при t = 174ºС в газовый кипятильник (20). Предусмотрен подвод тепла также через смоловыделитель (14) и паровой кипятильник (17).
Конструкцияя регенератора – рекуператора предусматривает возможность получения чистого СО2, содержащего не более 0,02 % об. горючих примесей, необходимого для производства карбомида. Чистая фракция СО2, составляющая свыше 75% общего объема СО2 выводится из реген.– рекуператора ниже точки ввода насыщенного р-ра при t=65÷70 ºС под Р ≈ 0,135 МПа, охлаждается до 45 ºС в холодильнике (18), проходит сепаратор (19) и направляется к потребителю. Грязная фракция СО2, содер. до 10% горючих, промывается в верх. части регенератора - рекуператора на колпачковых тарелках флегмой, затем охлаждается в холодильнике (18) до 40ºС и, пройдя сепаратор (21), выбрасывается в атмосферу.Для очистки рабочего р-ра МЭА от продуктов разложения, окисления и осмоления, вызывающих коррозию аппаратуры, установлены песчаный и угольный фильтры (на схеме не показаны), а также предусмотрена разгонка части циркулирующего р-ра в спец. аппарате – смоловыделителе (14).
17. Очистка конвертерного газа от СО2 по методу «КАРСОЛ».
В крупнотоннажном агрегате ТЕС (производительность 1360 т/сут.) в качестве абсорбента СО2 прим. карбонат К2СО3 (поташ), в виде 25 ÷ 35 % р-ра. Процесс основан на реакции:
К2СО3 + СО2 + Н2О ↔ 2КНСО3, ΔН < 0 (1)
Регенер. отработанного раствора протекает по реакции, обратной (1).
Преимуществом поташного метода перед МЭА очисткой, отн-ся:
1) меньшая стойкость абс – та;
2) меньший расход Q на регенерацию насыщенного раствора.
К недостаткам метода относится:
1) Малая растворимость К2СО3 и КНСО3 в Н2О при обычной температуре.
2) низкая скорость хемсорбции СО2;
3) значительное равнов. РСО2 над р-рами К2СО3, что предопределяет сравнительно высокое содержание СО2 в очищенных газах.
Для устранения этих недост. на практике исп-ся повышение тем-ры 70÷105 ºС и добавления в р-р активатора равного диэтаноламина (ДЭА) : (НОСН2СН2СН2)2 NН.
Увеличение тем-ры позволяет повысить р-римость карбонатов и скорость р-ции. Добавление ДЭА приводит к повышению скорости пр-са и снижению равновесного РСО2 над р-ром, что увеличивает степень очистки газа от СО2.Разновидность поташного метода, используемого в агрегате ТЕС наз-ся метод «КАРСОЛ».
В состав раствора «КАРСОЛ» входят, % масс : К2СО3 … 25÷ 28; ДЭА … 1,9; V2О5 (ингибитор коррозии) … 0,4; V – соn (антивспениватель) … 0,001 ÷ 0,00015; Остальное вода.Содержание СО2 в очищенном газе при использовании метода «КАРСОЛ» составляет от 0,05 до 0,15 % об., что на порядок больше, чем при МЭА.
18.Физико-химические свойства NН3.Требования к качеству NН3.Синтез NН3 :реакция,равновесие процесса
Относительная молекулярная масса 17,03
Мольный V – м, г /моль: дм3/моль 22,08
tкип (конд.) (при р = 0,1 МПа), ºС 33,3
tплав, (крист.), ºС 77,7
Предел взрываемости, % об.: в смеси с воздухом 15÷28
в смеси с О2 13,5÷79
Температура конденсации NН3 существенно повышается с увеличением Р, это позволяет выводить продукционный NН3 из циркуляционного газа, находящегося под Р в жидком состоянии при повышенных температурах.
Зависимость tконд. NН3 от Р , Па.
| Давление | атм | 0,2 | 0,5 | ||||||
| МПа | 0,020 | 0,051 | 0,101 | 0,203 | 0,507 | 1,013 | 3,040 | 6,080 | |
| Тем-ра конд-ции, °С | -60,5 | -46,0 | -33,3 | -18,7 | +4,7 | +25,7 | +66,1 | +98,3 |
1 атм = 0,101325 МПа
Требования к качеству продукционного NН3 по ГОСТ 6221 – 90.
ГОСТ 6221-90: “Аммиак жидкий технический. Технические условия”.В зависимости от назначения жид. NН3 выпускают 3 марок: А – для производства азот. кислоты, для азотирования, в качестве хладоагента, для создания защитных атмосфер;Ак – для поставок на экспорт и для транспортирования по магистральному аммиакопроводу.Б – для переработки на удобрения, и для исп. в с/х в качестве азотного удобрения.
По физико – химическим показателям NН3 должно соответствовать следующим нормам:
| Показатель | А | Ак | Б |
| 1. Массовая доля NН3 | 99,9 | 99,6 | 99,6 |
| 2. Массовая доля N2,% не менее | - | ||
| 3. Массовая доля Н2О (остаток после испарения),% | - | 0,2÷0,4 | 0,2÷0,4 |
| 4. Массовая доля Н2О (метод Фишера), % не более | 0,1 | - | - |
| 5. Массовая концентрация масла, мг/дм3, не более | |||
| 6. Масс. конц. железа мг/дм3, не более | |||
| 7. Масс. конц. общего хлора, мг/кг, не более | - | 0,5 | - |
| 8. Масс. доля СО2, мг/кг, не более | - | 30±10 | - |
Для Ак контролируют 7 и 8, чтобы не разрушился аммиакопровод, т.к. хлор и СО2 вызывают коррозию.Равновесие реакции синтеза NН3
Синтез NН3 может быть описан обратимой экзотерм. реакцией.
N2(г) +3 Н2(г) ↔ 2 NН3 (г), ΔН = - 92 кДж (1)
Согласно принципу М – Шателье, выход продукта будет увеличен при Р↑ и t↓.
Выражение для Кр синтеза им. Вид:
 , (2)
, (2)
Равнов. конц – ии NН3 в смеси N2 и Н2 состава приведены в таблице а)
Равновесные концентрации NН3, % обТаблица а)
| Температура,º С | Давление, МПа | ||
| 0,98 | 4,9 | 29,4 | |
| 14,7 | 39,4 | 71,0 | |
| 1,21 | 5,56 | 26,44 |
Таблица б)
“Константы равн – я р – ции синтеза NН3 МПа-1”
| Температура,º С | Давление, МПа | |||
| 0,98 | 4,9 | 29,4 | 58,8 | |
| 0,624 | 0,665 | 0,867 | 1,733 | |
| 0,038 | 0,038 | 0,050 | 0,065 |
Из табл. б) следует, что значения Кр, вычисл-ые по (2) зависят не только от t, но и от Р. Это является следствием отклонения, свойств сжатых газов от свойств идеал. газов.
Зависимость Кр р-ции синтеза от t и Р выраж-ся несложным эмпирическим ур-ем Ларсона и Доджа: lg√К = - 2074,8/Т + 2,4943 lgТ + βТ – 1,8564 *10-7 *Т2 + J , (3)
где : Т – тем-ра, К; β – коэффициент, зависящий от давления; J – константа интегрирования.Уравнение (3) записано для Кр обратной р-ции, т. е для К = РН20,5 * РN21,5/ РNН3 .Для прямого знаки меняются на противоположные, в правой части уравнения.
Кпрям *Кобр = 1.
Теплота реакции вычисл. Из Ур – ния, учит – го влияния t и Р:
q = 38276,7+(23,00+35488,37/Т+19407,15*106/Т3)*Р+22,35Т+10,55*10-4*Т2 –7,08*10-6*Т3, (4),где q – тепловой эффект, кДж / кмоль; Т - средняя температура в зоне синтеза, К; Р - давление в зоне синтеза, МПа.
Фазовое равновесие в системе газ – жидкость.Рассмотрение этой системы необходимо для выбора оптимальных условий конденсации NН3 из газовой фазы в жидкую.Таблицав)
“Равновесные конц-ции NН3 в газе в системе «газ-жидкость» для смеси N2–Н2–NН3, %об.”
| Давление, МПа | Температура, ºС | |||
| -20 | +20 | +50 | ||
| 9,8 | 2,51 | 5,49 | 10,69 | 25,19 |
| 29,4 | 1,32 | 2,90 | 5,64 | 13,29 |
Из этих данных следует, что равновесная концентрация NН3 в газовой фазе для 3 – х компонентной системы N2 – Н2 – NН3 зависит от t и Р.Для более полного выделения NН3 из газа путём конденсации следует использовать более низкую температуру и более высокое давление. Накопление инертных примесей метана и Ar в синтез – газе является «-» фактором, поскольку приводит к повышению конц-ции NН3 в равновесном газе - таблица г).Таблица г) “Равновесные конц-ции NН3 в газе (% об.) в системе «Г-Ж» для 5-ти компонентной смеси N2 –Н2–NН3–СН4–Ar при Р = 29,4 МПа”
| Температура,º С | Давление, МПа | ||
| -20 | +20 | ||
| 1,32 | 2,90 | 5,64 | |
| 1,46 | 3,16 | 6,16 | |
| 1,59 | 3,43 | 6,65 |
Таким образом, увеличение содержания инертов в газе приводит к снижению доли NН3, кот. конденсируется.
19.Синтез аммиака: кинетика, механизм реакции, катализаторы и параметры процесса.
Синтез NН3 протекает с заметной скоростью, только в присутствии кат-ра. Скорость синтеза NН3 на Fe – кат-ре, активизированная оксидами Аl и К определяется ур-ем Тёмкина–Пигкова:
V = k1 *рN2 *(РН23 /Р NН22)α - k2 *(РНN32 /Р Н23)α -1, (5)
где v – скорость реакции; k1- константа скорости прямой реакции обр – я НN3; k2 - константа скорости прямой реакции разложения НN3; (заметим что k1/ k2 = Кр – константа давления); рi – нарц. давление участков р – ции; α - константа, удовл-я неравенству 0<α<1.
Значение α харак-ет степень покрытия пов-ти кат-ра азотом в условиях процесса синтеза НN3; для промыш. кат-ра в интервале тем-р 400 ÷ 500ºС α = 0,5.
Зависимость k1 прямой р – ции от температуры следующая:
| Температура,ºС | |||
| k1 |
Значения ta для промышленных кат-ров и инт. температур 400÷ 500ºС равно 167,5 кДж /моль.Часто механизм относительно простого кат-ра р-ции оказался сложным. К таким относятся и реакция синтеза НN3 на пов-ти кат-ра, протекающая через следующие промеж. стадии:
I N2 (газ) → 2 N(адс)
II N2 (газ) → 2 Н(адс)
III N(адс) + Н(адс) → NН(адс)
IV NН(адс) + Н(адс) → NН2(адс)
V NН2(адс) + Н(адс) → NН3(адс) → NН3(газ)
Лимитирующей наиб. медленной является стадия I – активированная адсорбция газообр. N2 кат-ром; медленно протек и стадия III – присоед. 1 атома Н к сорбированному азоту.
Рассмотрим катализаторы процесса синтеза NН3.В промыш. нашёл применение железный кат-р, полученный сплавлением магнетита Fe3О4 с промотирующими компонентами. Кат-ры переводят в активное рабочее состояние, вост-ем водородом. В нашей стране разработан среднетемп-ный кат-р марки СА-1. В его состав входит Fe 32÷38% (в пересчёте на FеО) и три промотирующих компонента Аl2О3, К2О, СаО. Кат-р СА-1 выпускаются в виде зёрен неправильной формы (дроблёный кат-р) и в виде округлых гранул. Этот кат-р предназначен для работы в колоннах синтеза при тем-рах от 400 до 590º С, Р до 60 МПа и содержанием кислородных соединений в АВС до 40 см3 /м3. При этих условиях кат-р обеспечивает стабильную работу колонны в течении до 4 ÷ 5 лет. В отсутствии ядов (кислородсодерж. соединений) и при темп-рах до 500ºС продолжительность его эксплуатации возрастает до 7 лет.Разработан и освоен кат-р марки СА – 2, предн. lля работы при повыш. nемпературах от 477 до 600ºС.
20. Оборудование стадии синтеза NН3.Технологические особенности производств
На рис. представлена 4-х полочная колонна синтеза NН3, агрегата мощностью 1360 т/сут. Рабочее давление до 32 МПа. Это вертикальный аппарат состоит из нижнего и верхнего корпусов высокого Р и насадок:Внутренний диаметр нижнего корпуса – 2,4 м; толщина стенки – 25 см; высота корпуса – 22м.
Внутренний диаметр верхнего корпуса – 1м; толщина стенки – 11см; высота – 6,5м.

Насадка (2) состоит из катализаторной коробки и т/обменника (5). В нём размещены 1920 трубок ( d =12 мм), высота трубок 7,5 м, поверхность т/ обмена 475 м2. V и m катализатора на полках возвращают по ходу движения газа согласно следующих данных:
| № полки | V катализатора, м3 | m катализатора, т |
| I | 7,1 | 15,6 |
| II | 8,4 | 22,7 |
| III | 12,8 | 34,6 |
| IV | 14,7 | 39,6 |
| Всего | 112,5 |
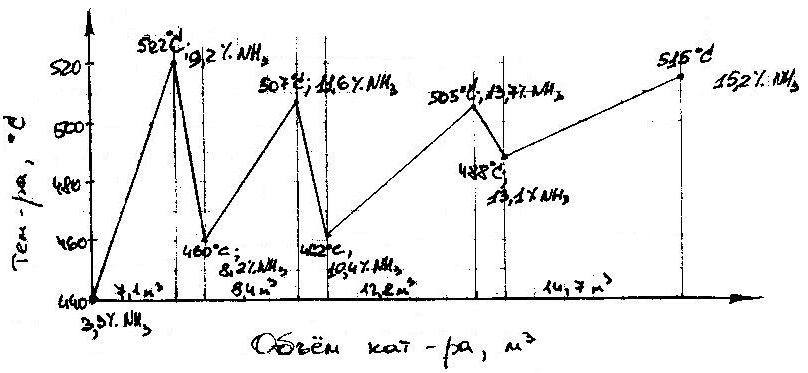 Рассм. движение газ. потоков внутри колонны синтеза. Перед колонной газ. смесь, содержащая 3,3% NН3 раздел-ся на 5 потоков. Основной поток газа идёт вниз колонны, поднимается по кольцевому забору между корпусом колонны и Кt–ой коробкой и поступает в межтруб. пр-во теплообменника вверху колонны. В теплообменнике газ нагревается до 400÷440 ºС за счёт горючего газа, выходящего из Кt-ой коробки, и поступает в Кt-ую зону на 1-ю полку. На полке происх. образование NН3 из АВС. 4 др. линии служат для ввода байпасного газа в колонну перед каждой полкой. С целью регулирования tº р-ции синтеза. Пройдя последовательно 4 слоя Кt-ра, на кот. происх. обр-ие NН3 газ. смесь с содержанием 14÷16 % об. NН3 при tº 480÷ 530 ºС по центральной трубке поднимается вверх, проходит по трубкам т/обменника, где охлаждается до 335 ºС и выходит из колонны синтеза.
Рассм. движение газ. потоков внутри колонны синтеза. Перед колонной газ. смесь, содержащая 3,3% NН3 раздел-ся на 5 потоков. Основной поток газа идёт вниз колонны, поднимается по кольцевому забору между корпусом колонны и Кt–ой коробкой и поступает в межтруб. пр-во теплообменника вверху колонны. В теплообменнике газ нагревается до 400÷440 ºС за счёт горючего газа, выходящего из Кt-ой коробки, и поступает в Кt-ую зону на 1-ю полку. На полке происх. образование NН3 из АВС. 4 др. линии служат для ввода байпасного газа в колонну перед каждой полкой. С целью регулирования tº р-ции синтеза. Пройдя последовательно 4 слоя Кt-ра, на кот. происх. обр-ие NН3 газ. смесь с содержанием 14÷16 % об. NН3 при tº 480÷ 530 ºС по центральной трубке поднимается вверх, проходит по трубкам т/обменника, где охлаждается до 335 ºС и выходит из колонны синтеза.
Рассмотрим tº-ый режим, поддерж. в колонне синтеза. Распределение Кt по полкам согласно данных табл. связано с поддержанием оптим. уровня tº синтеза и исключением перегрева Кt. Если исключить фактор перегрева, высокие tº были бы благоприятны с точки зрения кинетики процесса; но поскольку р-ция экзотетмич-я, равновесие процесса сдвигается в сторону обр-я NН3 при снижении tº. Для регулирования tº на полках подаётся байпасный газ в нужных кол-вах. Тем-ый режим 4-х полочной колонны приведён на рис.
Энерготехнологическая схема производства аммиака с рекуперацией энергии стадий получения синтез-газа. Энергетическая потребность агрегата. Масса и параметры генерируемого пара. Паровой привод турбокомпрессоров агрегата.
Эн/техн. принцип, закладываемый в основу современных ХТС, предполагает использование внутренних энергетических ресурсов для обеспечения собственных нужд процесса по пару и мех. энергии. Источником утилизируемой внутр. эн. явл-ся тепло экзотермич. реакций и физ. тепло продуктов переработки. Эн/техн. принцип в первую очередь актуален при использовании Р в крупнотоннажных агрегатах. В процессах под Р повыш-ся их скорость и сокращается V аппаратуры. Но для создания Р требуется значительные затраты механической энергии на сжатие газов в компрессорах. При производстве NН3 необходимо компримировать (сжимать) 3 основных потока: 1 – ПГ; 2 – воздух; 3 – АВС – синтез-газ.
Для обеспечения произв-ти 1360 т/сут NН3 требуется след. мощность двигателя компрессоров: ПГ – 2,2 МВт; воздуха – 11 МВт; АВС – 26 МВт. В целом энергетическая потребность агрегата составляет около 50 МВт или 882 кВт*ч/т NН3.
Покрытие этой требуемой мощности возможно 2-мя способами:
1. За счёт подвода эл/ энергии со стороны;
2. за счёт выработки и использования водяного пара высоких параметров.
Для аммиачного агрегата самым энергоёмким явл-ся компрессор синтез-газа мощностью 26 МВт с числом оборотов около 11000 об/мин. Применение для привода этого компрессора эл/ двигателя с редуктором технически не реализуемо. В то же время на агрегате технически возможно получение необходимого количества высококонцентрированного пара. Поэтому в качестве привода компрессора синтез-газа выбрана именно паровая турбина.
Рассмотрим принцип энерготехнологическую схему производства NН3 мощностью 1360 т/сут.Тепловой эффект эндотерм. р-ций паровой конверсии ПГ в трубч. печи с избытком покрывается суммарным тепловым эффектом экзотерм. реакций шахтной доконверсии СН4, сгорание топливного ПГ в радиат. зоне трубчатой печи, конверсии СО и синтеза NН3. Поэтому для утилизации избыточного тепла схема оснащена 3-мя мощными котлами-утилизаторами: котлом I ступени (12), котлом II ступени (13), установленными после шахтного конвертора СН4 (11) и котлом (16) после конвертора СО I ст. (15). В этих колоннах генерируется насыщ. пар одного и того же параметра Р=10,5 МПа и Т=315 ºС.
Общее количество пара равно 348 т/ч. Поверхность т/обмена котлов-утилизаторов следующая; м2: (12) – 262; (13) – 200; (16) – 330.
Дальнейшее повышение энергетического потенциала пара (перегрев пара) возможно благодаря исп-ию тепла горючих дымовых газов трубчатой печи конверсии ПГ (7). Для этого пар из котлов (12,13 и 16) вначале поступает в общий паросборник (14). Из паросборника пар направляется в пароперегреватель (8) конвекционной зоны трубчатой печи, где перегревается до 480 ºС. Весь перегретый пар подаётся в турбину турбокомпрессора синтез газа (3). В турбине энергия пара превращается в мех. энергию на валу компрессора. Пар при этом дросселируется до 4,1 МПа, а тем-ра понижается до 380 ºС. Пар с этими ещё высокими парами используется для привода менее мощных компрессоров: компрессора ПГ (1) и воздушного компрессора (2). Этот пар исп-ся и для технологических нужд в процессах конверсии и доконверсии СН4 и конверсии СО (смесители (6) и (9)). Избыток пара конденсируется под вакуумом и вместе с др. потоками конденсата направляется на водоподготовку. Т.о., благодаря реализации энергетических возможностей ХТС и генерации собственного высокопотенциального пара, агрегат почти полностью обеспечивает себя энергией. Вместо 882 кВт*ч/т NН3 со стороны потребляется только 79 кВт*ч /т NН3 в виде эл/энергии.
23.Производство НАК. Сырье. Требования к качеству продукционной кислоты. Стадии производства.Балансовая реакция получения HNO3 и расчет расходных коэффициентов. Стадия контактного окисления аммиака…
HNO3 - одно из исх в-в для пол-я N-сод-их продуктов, 70-80% - на про-во удобр-й. Пром-ть выраб-ет НАК (46-60% HNO3) и конц (98-99% HNO3). ВОАО «Азот» дей-т 3 агрегата по пр-ву НАК 120 тыс т /год кажд (в пересчете на HNO3). Выпускают 57-59% HNO3. Треб-я:
1 – внешний вид - бесцвет или желтая ж-ть без мех-их примесей;
2 – мас. доля HNO3, % не более: Высш.сорт - 57,0; 1 сорт – 56; 2 сорт –46;
3 – мас. доля окс азота, % не менее(в пересч на N2O4) Высш.сорт - 0,07; 1сорт - 0,1; 2 сорт - 0,2;
3 - мас. доля остатка после прокал-я, % не менее Высш.сорт 0,004; 1 сорт- 0,02; 2 сорт -0,06. Сырье для пр-ва НАК – NH3, воздух и ХОВ.
Вспом. мат-ы: Kt-ы окисл-я NH3 и очистки хвост газов;фильтр-ие мат-ы ПГ;оборот вода;пар;эл.Е. Процесс пр-ва сос-т из 2 стадий:1-окис-е NH3 кислородом возд. с пол-ем NO; 2 - пер-ка NO в HNO3. На 2 стад. снач идет окис-е NO до высших оксидов NO2 и N2O4 с поглощ-ем их водой и обр-ем HNO3.
Имеется и стадия каталит-кой оч-ки хвост.газов от NОх. Суммар-я р-я получ-я HNO3: NH3 + 2O2 =HNO3 +H2O, Н= - 421(1).
Расходные коэффициенты На 1т HNO3 для с/х под Р=0,716 Мпа требуется: 1) NH3 = 17*1000/63=269кг, 63 – мол.масса HNO3 ,практически расход-ся 293кг на 1т; 2) ХОВ для абс-и: для получения 58% HNO3 :63*42/58=45,62кг; необх-мо специально добавить 45,62 – 18 = 27,62кг; необх-мо добавить на 1т HNO3 27,62*100/63=438кг, практически 0,45м3; 3) Рt-й кт-р, потери 0,15г/т; Кт-р АВК-10М (в пересч на V2O5), безвозвр потери 0,014кг/т; 4)ХОВ для котлов: произ-ть 1-го котла 24т/ч, 2-го - 7,5т/ч, всего 31,5 т/ч. На 1 т HNO3: 31,5/14,8 = 2,13т/т, где 14,8 т/ч произв-ть по HNO3; практич-ки 2,2м3. 5) Вода оборотная 160м3; 6) ПГ (топлив) 60-70м3; эл.Е 20кВт*ч или 50-70МДж.
При окис-и NH3 в зав-ти от Kt и условий проц-са м. получить NO,N2O.N2 по р-ям: 4NH3+5O2 = 4NO+6H2O, Н=-907(2); 4NH3+4O2=2N2O+6H2O, Н=-1105 (3); 4NH3+3O2=2N2+6H2O, Н=-1269 (4). Все 3 р-ии идут почти до конца,поэтому состав конечных прод-в будет опред-ся избират-ной способ-стью Kt.
При получ-ии HNO3, целевая р-ей является (2), а (3) и (4) подавл-ся. Для направл-я пр-са по р-и (2) наилучший Kt из Pt-ого сплава (Pt - Pd - Ro - Ru), позволяющ.достиг.выс.степень превр-я NH3 именно в NO (97-98% при атм.Р; 95-96% при 0,8МПа и 880-920С).
Вычисл-ые при 900С конст-ты равн-я р-й (2-4) К2= РNO4*РH2O6/РNH34*РО25 =1053; K3 =1061 ; К4 =1067. Огром значения свидет-ют о практич. необр-ти. р-ии, т.е. в реал-х условиях окис-е NH3 м. опред-ся только скор-ю этих р-й. Образ-е NO идет только на пов-ти Kt. Pt хорошо адсор-рует О2, слабо NH3, поэтому ск-ть окис-я NH3 опред-ся ск-тью адсор-ции NH3, а последн. ск-тью диффузии NH3. Чтобы пов-ть Kt всегда была покрыта О-ом, необх. избыток по отнош-ю к стехиом. кол-ву в р-ии(2) (не > 30%, т.е. мольное или объемное от-е O2 к NH3 = 1,7-1,9). Содерж. NH3 в АВС поддерж-ся 9,5-10,6% об.
Задача №13.2 Скор-ть окисл. NH3 м. опред-ть по ур-ю 1-го порядка: - dPNH3/dτ = k*PNH3 ,где τ- время контактир.,с; k – конст. ск-ти р-ии, с-1; PNH3 - парц.давл. NH3 на входе в Kt, Па. С увелич. т-ры k увел-ся.
Время превр-я (конверсии) NH3 в NO на Kt при 900С очень мало и выраж-ся ур-ем (при 90-98% конверсии) lgτ = -0,107α+7,02*10-6*α3, где α - степень конверсии, %; τ - время конвер., с. Из-за огром ск-ти окис-я NH3 высоки показ-ли: нагрузка Kt и напряж-ть Kt. Нагрузка Kt - V или масса NH3, подаваемого в конт ап-т в ед-цу времени, м3/ч или кг/ч. Напряж-ть Kt - кол-во NH3 окисляемого на 1 м2 активн. пов. Kt в сутки, кг/м2*сут: g=gNH3*24/Fс , где gNH3 – час-ой расход NH3, кг/ч; Fс - суммар-я активн. пов-ть всех Kt-ых сеток, м2. Pt-ый Kt исп-ся в виде тончайших сеток с диам. нити 0,09мм, размер стороны ячейки 0,22мм. На 1 см2 сетки размещ-ся 1024 яч. Акт-ая пов-ть 1 м2 сетки 1,809 м2. Акт-ая пов-ть сетки, м2/м2: F = 2αdn1/2,где d – диам. проволоки сетки, см; n - число плетений на 1см2 сетки. Раб. площ. Kt-ой сетки S, м2: S=1,2*100*τ*V0*Tk*P/1,1*m*d*Pk*273(1-1,57*d*n1/2), где 1,2 - коэф-т, учит-ий не полный разлом сеток; V0 – объемн.ск-ть газа при н.у., м3; τ -время конверсии,с; Тk – темп. контакта, К; d – диам. проволоки сетки; Р – атм.давл., МПа; Рk – давл. в контакт. апп-те, МПа; n - число плетений на 1 см2; m - число сеток в комплекте; 1,1 - коэф-т учитыв-ий ур-е времени контакта за счет удлинения нитей при провисании. Pt-ные Kt-s чувствит. к ядам, мех. примесям, маслу, серн. соед-ям, фосфатам, фторидам, хлоридам. Ведутся поиски замены этих Kt-ов из-за их дороговизны, дефецита, отравл-ти, безвозвр.потерь. Из-за большого тепл. эффекта р-ии (2-4) окисл-е NH3 сопровожд-ся разогревом газов. смеси на 67-69С на кажд % окисл-ого NH3,т-ра НГ под сетками 880-920С.
Тепло НГ в начале утилиз. в пароперегр-ле, а оконч в котле-утилиз. При прохожд. газа через котел он перед. тепло питат. воде, котор. испар. и при этом образ-ся насыщ. пар под давл. 1,5 МПа. НГ при этом охлажд. до 250С.
Рассчет процесса парообраз. Пусть в котел-утилиз.(КУ) поступ. тепловой поток величиной 8000 МДж, 98% котор. расх. на получ. пара, а 2%-потери в окр.ср. Расчет массы обра-егося при этом пара рассч. по ф-ле: m=Q/(H11-H1), где Q - тепло для получ-я пара, кДж; H11 - энтальпия насыщ. вод. пара, кДж/кг; H1 - энтальпия питат. воды, кДж/кг (таблицы);
Прим.1.КУ выраб. насыщ. пар. с Р=4,8МПа. В КУ под-ся. питат. вода с темп. насыщ-я. Рассч. массу пара.. Q=8*106*0,98=7840000 кДж. H1=632,2 кДж/кг, H11=746 кДж (при р=4,8 атм.,t=150C). mп=7840000/(2746-632,2)=3709 кг.
Прим.2 КУ выраб. нас. пар с Р=4,8 атм. В КУ под-ся пит. вода с t-ой 30С. На нагрев питат. воды до t насыщ. и на испар. этой воды.: H11=2746 кДж/кг (при150С и Р=4,8атм). H1=126 кДж/кг(при 30С и Р=4,8атм).mп=7840000/(2746-126)=2992 кг Прим.3 КУ выраб пар с Р=4,8атм. и t=400С, пит. вода с t=30C. На нагрев воды до tнасыщ., испар. ее и на перегр. пара до t=400С: H11=3272,3 кДж/кг (при 4,8атм. и 400С), H1=126 кДж/кг (при 4,8атм. и 30С). mп=7840000/(372,3-126)=2491,8 кг.
25.Гомогенное окисление монооксида азота: реакции, равновесие, кинетика и параметры процесса.
25.1. НГ, вых-ие из узла конверсии NH3 сод-ат NO в кол-ве 9,5-11% об. С водой NO не регир., поэт. для получ-я HNO3, NO необх-о перевести в хими-ки активные формы оксидов. Превр-е NO протекает по р-ям:
2NO+O2↔2NO2;-114 (1), 2NO2↔N2O4;-56,9 (2), NO+NO2↔N2O3,-40,1(3).
Главн. роль играет р-я окис-я NO до NO2 р-ия (1).
25.2. Завис-ть конст-ты равн-я р-и (1) от темпер-ры выраж-ся ур-ем Боденштейна:
lgKобр=lgPNO2* PO2/ PNO22 = - 5749/Т+1,75lgТ-0,0005Т+1,8306. Кпрямой р-и =1/Кобрат. р-и, Па-1.
25.5. С увел. t К ум-ся в соответ-и с принципом Ле-Шат. Р-я (1) протекает с низ ск-тью и имеет важн особен-ть - ее ск-ть ув с уменьш. т-ры. Объясн-е находят в 2-ух стадийности процесса: 4NO+3O2↔N5O5,<0, быстр р-я. С увел. т-ры, равнов-е смещ-ся влево; 2NO+2N2O5↔6NO2,<0,медл р-я, опред-ет суммар-ю ск-ть пр-са.
Итоговая р-ция:2NO+O2↔2NO2. Ск-ть р-ии окисл-я опис-ся ур-ем 3-го порядка: -d PNO/dt=k*PNO2*PO2 (4). По ур-ю (4) интегрированием можно получ-ть ур-е, кот исп-ся в техноло-х расчетах: t*k*a2* P2=[a/{(g-1)*(1-a)}]+[1/(g-1)2]*ln[g(1-a)/[g-a], где a-степень окис-я NO, доли ед; t - время окис-я, с; k – конста-та ск-ти р-и, 1/%об2*с; a-половина начальн. кон-ии NO, %об; Р-общее давление газа,атм; g=b/a, отн-е конц-и O2 в газе к половинной конц-и NO. Конста-та ск-ти р-ии уменьш. с ув-ем т-ры. Особенно мала ск-ть р-и (1) при низк. парц-х Р-ях NO.
25.6. Необх-ть глубокой перераб-ки NOх в кислоту до остаточ конц-и в газе 0,09-0,11% об. и вынуждает сооружать высок абс колонну (45-50 м) с больш межтарельч-ми расстояниями ~1м. В соответ-и с р-ей (2) в газе, содер-ем оксиды азота (IV) устан-ся равновесие между формой NO2 и ее димером N2O4. Если NO2 имеет желтокоричн. окраску, то N2O4 - бесцв. Хим св-ва их одинак. В соот-и с тепл эф-ом р-и равновесная конц-я N2O4 увелич. c пониж. t. Конст. равнов-я опред-ся из выр-я: lgK= lgPNO22/ PN2O4= - 2866/Т+lgТ+6,251.Ск-ть прямой и обрат-й р-и (2) велика и опред-ся кинетич ур-ем: dPN2O4/dt=k* PNO22. С учетом влияния т-ры на кинетику и равн-ие р-ий (1) и (2) содер-е N2O4 особ-но велико в конечных НГ-х при пониж-ых t. Равновесие р-иие (2) играет важн роль и в жидкой фазе. Роль р-ии (3) невелика. Содер-е N2O3 в обычн НГ при 25С не превыш 2-3% от всех оксидов азота.
27. Переработка оксидов азота в азотную кислоту: реакции, равновесие, кинетика и параметры процесса.
27.1. Оксиды N взаим. с водой по р-ям: 2NO2г+H2Oж=HNO3р+HNO2р, DН=-116 (1) N2O4г+H2Oж=HNO3р+HNO2р, DН=-59кДж (2); N2O3г+H2Oж=HNO2р, DН=-56кДж (3). Р-ии 1-2 идут с выс скор. HNO2 – малоуст-е соед-е и распад-я на HNO3 и NO: 3HNO2р= HNO3р+2NO+H2Oж, DН=75,8 (4). Ск-ть (4) невелика. Для перераб. NOх в HNO3 необх. ↓t, а для разлож-я HNO2 -↑ее, поэт. в ускор-и распада HNO2 важно интенс. перемеш. раств. на тарелке и окис-е HNO2 в жид ф. раств-м О2 по р-и: 2HNO2р+O2г« 2HNO3ж, DН=-8,96(5)
27.2. Зав-ть ск-ти р-и (4) от t выраж. ур-м: lgk=-6250/T+22,65. Сум. р-я образ-я АК склад. из ур-й (1-4): 3NO2г+H2Oж=2HNO3г+NOг, DН=-136,2 (6). В АК превр. тол. 2/3 NO2, а 1/3 возвр. в газ. форму в виде вторич. NO (II). Используется абс-я кол. с бол. кол-ом тарелок и объем-ми межтар-ми раст-ми для гомог. окисл. вторич. NO по р-ии 2NO+O2 Û 2NO2, -114 (7). Из 4NH3+5O2=4NO+6H2O, DН=-907 (8), Из реакц. (6 и 7) => что Р-давл по-разн. влияет на пр-сы окисл. NH3 и перераб. NОх в кис-у. (8) идет с ↑V, => Р на стад. окисл. нужно ↓.(6 и 7) прох-т с ↓V, поэт для глуб. перераб. NOх Р необ.↑. Конст. равн. р-ии (6) K= PNO* PHNO32/ PNO23*PH2O, рассм-ся как произв. 2-х частных const К=K1*K2, где K1= PNO / PNO23 ; K2= PHNO32/PH2O. Пр-сс абс-ии осущ. в многотар-й абс-й кол. Перераб. NOх в HNO3 происх. в ГЖ-м слое ситч. тар. в абс к-е. На тар. пост. НГ.
Для расч. эф-ти пр-са перераб. NO на тар. нужно знать предельные (равнов-е) знач. парц-х Р NO, NO2, и N2O4 кот-е лишь теорет. возм. при дан. t и нач.Р.
27.3. Осн. на р-ях: 3NO2+Н2ОÛ2НNO3+NO(А), тогда K1= PNO / PNO23 PNO = K1* PNO23 2NO2ÛN2O4(В), тогда K3= PNO22 / PN2O4 ; PN2O4= PNO22 / K3. Обоз-м-а,в,с–парц. Р комп-в в исх-м г.; х-кон-е парц. Р NO2. Выр-м с пом. Кравн. равнов-е парц. Р NO и N2O4:
| Комп- нт | Парц. давл-я | |
| в исхгазе | в равн-м газе | |
| NO | а | К1*х3 |
| NO2 | в | х |
| N2O4 | с | х2/К3 |
Согл-но (А) кол-во образ-ся NО в 3 раза < кол-ва погл. NO2. Обоз-м сумм.-ое парц-ое Р высших NО и NO2 как РNO2(с), тогда т.к. N2O4Û2NO2, общее РNO2(с) без учета димеризации NO2 м. рассм. как РNO2+2 РN2O4, тогда убыль NO2 при поглащ. =: ''в-х'', но (в-х)/3 равно: (в-х)/3 = К1х3 – а, откуда в-х = 3(К1х3 – а) (С). С др стороны убыль NO2 равна: в-х = (в+2с)-(х+2х2/К3) (Д). Прирав-я (С) и (Д) пол-им: 3К1х3+2х2/К3+х= 3а +в+2с. Решив это ур-е, относ-но х=РNO2, для изв-х К1 и К3, получ. равнов. парц. РNO и РN2O4.
Кинетика взаим. NOх с водн. раств-и АК – слож. массообм. пр-сс. Скор. взаим-я зав. от ф.-х. и гидродин. усл-й абс-ии. Скор. пр-са удовл-но опис-ся ур-ем массопер.: V=K*(Dp-p/); где V- скор. поглощ. NOх (в пересч. на HNO3), кг/м2ч; К- коэф. массоп-чи, кг/м2ч*МПа; Dp- сред. движ. сила пр-са, МПа; p/ -фактор учитыв. насыщ. жид. ф. оксидами N. В промыш. усл-х скорость абс-ции лимитируется скоростью диффузии.
27.4. Эфф-ть пр-са массопер-и опр. КПД, т.е. степ. достиж. равн-я между NOх и р-ром HNO3 на тар. по фор-е: h=(рн-рк)/ рн-рр где рн, рк, рр-парц Р NOх на вх. на тар, вых. из нее и равн-ое. h при расч. опр.: h=(8,73*Р0,15*СNOх0,1*a0,4Н0,15СHNO30,1/
W0.26d10.15S0.13T0.87). где Р-общ. Р г., атм; СNOх-общ. конц. NOх в НГ; a-степ. окисл-ти NOх, доли ед; Н- выс. перелива жид-ти на тар, м; СHNO3-конц-я HNO3,% мас; W- скор. г. в полом сеч. к-ны, м/с; d-Ø отв-й ситч. тар, м; S-доля своб сеч-я тар, д.ед; Т-t р-ра на тар, К.
Дата добавления: 2015-04-18; просмотров: 543; Мы поможем в написании вашей работы!; Нарушение авторских прав |