
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Протолитическая теория кислот и оснований.
Бренстед и Лoури (1923 г.) предложили протолитическую теорию кислот и оснований. Согласно этой теории к кислотам относятся вещества, способные отдавать протоны, а к основаниям – вещества, способные их присоединять. Поскольку отдача протона кислотой – процесс обратимый, то получившийся при этом остаток кислоты может снова присоединить протон и, следовательно, будет основанием. Поэтому с каждой кислотой сопряжено основание, в которое она переходит, теряя протон, например:
| кислота | протон | основание | ||
| HCL | 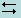
| H+ | + | CL- |
| NH4+ | 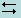
| H+ | + | NH3 |
| H3O+ | 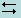
| H+ | + | H2O |
Все реакции кислотно-основного взаимодействия по этой теории состоят в обратимом перенос протона от кислоты к основанию. В результате такого процесса образуется пара новых частиц, одна из которых способна отдавать протон, а другая его принимать. Таким образом, кислота оказывается в равновесии с сопряженным основанием, а основание – с сопряженной кислотой:
| HA | + | B | 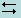
| A- | + | HB+ |
| Кислота | Основание | Сопряженное основание | Сопряженная кислота |
| СH3COOH | + | OH- | 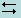
| CH3COO- | + | H2O |
| Кислота | Основание | Сопряженное основание | Сопряженная кислота |
Соединения, которые могут быть как кислотами, так и основаними, называются амфипротными, или амфолитами. К ним относятся вода, продукты ступенчатой диссоциации многоосновных кислот
(HPO42-,HC2O-4 ) и т. д., поскольку они могут и присоединять, и отдавать протон.
Вода в очень незначительной степени диссоциирует с образованием ионов гидроксония и гидроксида:
H2O+ H2O 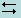 H3O++OH-,
H3O++OH-,
или в упрощенном виде
H2O 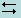 H++OH-
H++OH-
В соответствии с законом действующих масс можно записать
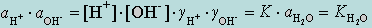
где KH2O – ионное произведение воды (KW). Так как αH2O постоянна, она входит в  .
.
При 25 °С 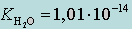 .
.
Так как при диссоциации воды образуется одинаковое число ионов [H+] и [OH-] и yH+ = yOH- = 1
(концентрация [H+] и [OH-] очень мала), получим
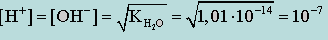 (моль/л).
(моль/л).
Для удобства расчетов введены водородный (рН) и гидроксидный (рОН) показатели:
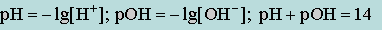
В нейтральных растворах концентрация ионов водорода равна концентрации гидроксид-ионов.
[H+]= [OH-]=10-7моль/л.
В кислых растворах концентрация ионов Н+ больше 10-7 моль/л; рН<7, а в щелочных – меньше 10-7; рН>7.
Зная величину рН или рОН, можно вычислить концентрацию ионов водорода или гидроксид-ионов в растворах.
Сила кислот и оснований, согласно протолитической теории, оценивается по реакции с водой. Равновесному состоянию
кислота + Н2О  основание + Н3О+
основание + Н3О+
соответствует константа

Считая концентрацию молекул [Н2О] в разбавленных растворах постоянной, получают выражение для константы равновесия кислотно-основной пары (K)

Чем больше величина константы, тем выше концентрация [Н3О+] и тем сильнее кислота. В кислотно-основной паре сильной кислоте соответствует слабое основание и наоборот.
Например, сильная кислота HSO-4 образует пару с очень слабым основанием SO2-4 .
Очень слабой кислоте HCN соответствует в паре довольно сильное основаниеCN- .
Дата добавления: 2015-04-18; просмотров: 632; Мы поможем в написании вашей работы!; Нарушение авторских прав |