
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
При связывании разных атомов степень окисления равна заряду, который приобрел бы атом в этом соединении, если бы оно могло состоять из ионов.
Довольно просто определять степень окисления в ионных соединениях, где сразу видно, откуда и куда перешли электроны. Из табл. 3-4 видно, что знак и величина степени окисления всегда совпадают со знаком и зарядом одноатомных ионов.
 Например, при взаимодействии магния с кислородом образуется ионное соединение Mg2+O2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов" – горение магния в кислороде.
Например, при взаимодействии магния с кислородом образуется ионное соединение Mg2+O2– (где 2+ и 2– заряды ионов магния и кислорода, табл. 3-4). Посмотрите видеоопыт из "Единой коллекции цифровых образовательных ресурсов" – горение магния в кислороде.
Степень окисления магния составляет +2, а степень окисления кислорода составляет –2. Точно так же в соединении CaCl2 степень окисления кальция +2, а степень окисления хлора –1.
Сложнее обстоит дело с полярными ковалентными соединениями. Здесь на помощь приходит знание относительной электроотрицательности элементов. Например, в молекуле воды Н2О кислород более электроотрицателен, чем водород,
поэтому электроны связей смещены в сторону кислорода. Если бы вода была ионным соединением, то ее формулу можно было бы записать так.
Здесь степени окисления - это условные заряды атомов в молекуле, если считать, будто бы это ионная, а не полярная ковалентная молекула. Тогда степень окисления кислорода в воде составляет -2, а степень окисления водорода +1.
6. Общая характеристика состояния электрона в многоэлектронном атоме определяется принципом Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. На одной орбитали могут находиться не более двух электронов, отличающихся друг от друга спинами. Максимальная емкость энергетического подуровня – 2(2+l) электронов, а уровня – 2n2.
Согласно правилу Гунда, заселение орбиталей, относящихся к одному и тому же энергетическому подуровню, начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заселение орбиталей парами электронов с противоположными спинами. В результате суммарный спин (и сумма спиновых квантовых чисел) всех электронов в атоме будет максимальным.
Правило Клечковского - Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел n+l. При одинаковой сумме раньше заполняется орбиталь с меньшим значением n.
7. Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Валентность – свойство атома данного элемента присоединять элементы или замещать определённое число атомов другого элемента. Под валентностью химического элемента также понимают способность его атомов образовывать химические связи в соединениях. Количественно валентность определяется числом химических связей, образованных атомом.
8.Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
Появление атомной модели Бора, впервые объяснившей строение электронной оболочки, способствовало созданию представления о химической связи и её электронной природе. В соответствии с моделью Бора электроны могут занимать в атоме положения, которым отвечают определенные энергетические состояния, т. е. энергетические уровни. В 1915г. немецкий физик Коссель дал объяснение химической связи в солях, а в 1916 году американский учёный Льюис предложил трактовку химической связи в молекулах. Они исходили из представлений о том, что атомы элементов обладают тенденцией к достижению электронной конфигурации благородных газов (полного заполнения внешнего электронного слоя). Представления Косселя и Льюиса получили названия электронной теории валентности.
Валентность элементов главных подгрупп Периодической системы зависит от числа электронов, находящихся на внешнем электронном слое. Поэтому эти внешние электроны принято называть валентными. Для элементов побочных подгрупп в качестве валентных электронов могут выступать как электроны внешнего слоя, так и электроны внутренних подуровней.
Различают три основных типа химической связи: ковалентную, ионную, металлическую.
Ковалентная связь существляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной.
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной.
Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
9. Характерные свойства ковалентной связи – направленность, насыщаемость, полярность, поляризуемость – определяют химические и физические свойства органических соединений.
Направленность связи обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяют реакционную способность молекул по отношению к полярным реагентам.
КРАТНОСТЬ СВЯЗИ - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. Так, в молекуле этана Н 3 С-СН 3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов); в молекуле этилена Н 2 С = СН 2 связь С = С двойная, К. с. равна двум (две - пары обобществлённых электронов); в молекуле ацетилена НС  СН тройная связь с тремя обобществлёнными парами электронов.
СН тройная связь с тремя обобществлёнными парами электронов.
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании  -связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
-связи осуществляется так называемое боковое перекрывание электронных облаков, и плотность электронного облака максимальна «над» и «под» плоскостью σ-связи. Для примера возьмем этилен, ацетилен и бензол.
В молекуле этилена С2Н4 имеется двойная связь СН2=СН2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют  -связью.
-связью.
В линейной молекуле ацетилена
Н—С≡С—Н (Н : С ::: С : Н)
имеются σ-связи между атомами углерода и водорода, одна σ-связь между двумя атомами углерода и две  -связи между этими же атомами углерода. Две
-связи между этими же атомами углерода. Две  -связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
-связи расположены над сферой действия σ-связи в двух взаимно перпендикулярных плоскостях.
Все шесть атомов углерода циклической молекулы бензола С6H6 лежат в одной плоскости. Между атомами углерода в плоскости кольца действуют σ-связи; такие же связи имеются у каждого атома углерода с атомами водорода. На осуществление этих связей атомы углерода затрачивают по три электрона. Облака четвёртых валентных электронов атомов углерода, имеющих форму восьмерок, расположены перпендикулярно к плоскости молекулы бензола. Каждое такое облако перекрывается одинаково с электронными облаками соседних атомов углерода. В молекуле бензола образуются не три отдельные  -связи, а единая
-связи, а единая  -электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
-электронная система из шести электронов, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола совершенно одинаковые.
10. При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга.
При рассмотрении ковалентных химических связей нередко используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация является формальным приемом, применяемым для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной (гибридизованной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами.
В результате гибридизации появляются новые гибридные орбитали (рис.24), которые ориентируются в пространстве таким образом, чтобы расположенные на них электронные пары (или неспаренные электроны) оказались максимально удаленными друг от друга, что соответствует минимуму энергии межэлектронного отталкивания. Поэтому тип гибридизации определяет геометрию молекулы или иона.
Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулы вблизи какого-либо атомного ядра в зависимости от его окружения, то есть позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическое расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействий соседних атомов.
Для такого расчета выбирают одну из возможных систем гибридных орбиталей и располагают ее в пространстве так, чтобы обеспечить макс. перекрывание отдельных пар гибридных орбиталей разных атомов. Другой подход применяется в неэмпирических методах квантовой химии, в которых все взаимодействия атомов в молекулеучитываются одновременно и волновая функция молекулы не зависит от того, атомные или гибридизированные орбитали используются для расчета. В этом случае гибридные орбитали строят после определения волновой функции молекулы таким образом, чтобы в отдельных областях пространства распределение электронной плотности можно было описать одной гибридной орбитали.
В обоих подходах тип гибридизации атомных орбиталей обусловлен геометрической конфигурацией молекулы и для большинства равновесных конфигураций оба подхода приводят к близким формам гибридной орбитали.
В теоретической химии для систематизации экспериментальных данных о равновесных конфигурациях молекул часто применяют феноменологический подход, в рамках которого атомы данного элемента склонны к гибридизации определенного типа, а тип гибридизации определяет взаимное расположение ядер ближайшего окружения.
Отклонение конфигурации молекулы от симметричной связывают с взаимодействием химических связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии.
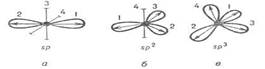
11. В результате гибридизации появляются новые гибридные орбитали, которые ориентируются в пространстве таким образом, чтобы после их перекрывания с орбиталями других атомов образующиеся электронные пары оказались максимально удалёнными друг от друга. Это сводит к минимуму энергию отталкивания электронов в молекуле.
Гибридизация не является реальным процессом. Это понятие введено для описания геометрической структуры молекулы. Форма частиц, возникающих при образовании ковалентных связей, в которых участвуют гибридные атомные орбитали, зависит от числа и типа этих орбиталей. При этом σ – связи создают жёсткий «скелет» частицы:
Орбитали участвующие в гибридизации s, p. Тип гибридизации sp – гибридизация  . Пространственная форма молекулы Линейная
. Пространственная форма молекулы Линейная  . Примеры BeCl2,CO2, C2H2, ZnCl2, BeH2 .Две sp - орбитали могут образовывать две σ - связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p - орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
. Примеры BeCl2,CO2, C2H2, ZnCl2, BeH2 .Две sp - орбитали могут образовывать две σ - связи (BeH2, ZnCl2). Еще две p- связи могут образоваться, если на двух p - орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
Орбитали участвующие в гибридизации s, p, p. Тип гибридизации sp2 – гибридизация  . Пространственная форма молекулы Треугольная (плоская тригональная)
. Пространственная форма молекулы Треугольная (плоская тригональная)  . Примеры BH3 , BF3, C2H4, AlCl3. Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
. Примеры BH3 , BF3, C2H4, AlCl3. Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется σ - связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется π - связь. Три sp2- орбитали могут образовывать три σ - связи (BF3, AlCl3). Еще одна связь (π - связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Орбитали участвующие в гибридизации s, p, p, p. Тип гибридизации sp3 – гибридизация  . Пространственная форма молекулы Тетраэдрическая
. Пространственная форма молекулы Тетраэдрическая  . Примеры СH4 NH4 PO43- BF4-
. Примеры СH4 NH4 PO43- BF4-
12. Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
В качестве количественной меры полярности связи используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Н+δ — Cl−δ, где δ — некоторая доля элементарного заряда).
Практически все химические связи, за исключениям связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны.Ионные связи — сильно полярны.
Полярность молекулы – Молекула составлена из одной или более химических связей (ковалентные связи) междумолекулярным orbitals различных атомов. Молекула может быть полярной или в результате полярных связей из-за различий в electronegative как описано выше, или в результате асимметричного расположения неполярных ковалентных связей и несближающихся пар электронов, известных как полное молекулярное орбитальное.
- Пример 1. Водородный фторид, ПОЛОВИНА, молекула является полярной на основании полярных ковалентных связей — в ковалентных электронах связи, перемещены к большему количеству electronegative атома фтора.
- Пример 2. В аммиаке, NH3, молекуле у трех связей N–H есть только небольшая полярность (к большему количеству electronegative атома азота). Однако, у молекулы есть два одиноких электрона в орбитальном, которое указывает на четвертую вершину приблизительного четырёхгранника, (VSEPR). Это орбитальное не участвует в ковалентном соединении; это - электронные богатые, который приводит к мощному диполю через целую молекулу аммиака.
- Пример 2.5. В озоне, O3, молекуле две связи O–O неполярны (нет никакого electronegativity различия между атомами того же самого элемента). Однако, распределение других электронов неравно — так как центральный атом должен разделить электроны с двумя другими атомами, но каждый из внешних атомов только должны разделить электроны с одним другим атомом, центральный атом более лишен электронов чем другие (у центрального атома есть формальное обвинение +1, в то время как внешние атомы у каждого есть формальное обвинение −1/2). Так как у молекулы есть геометрия склонности, это приводит к диполю через целую молекулу озона.
Подобным образом, молекула может быть неполярной или потому что нет (почти) никакой полярности в связях или из-за симметрического расположения полярных связей.
- Пример 3. В метане молекула CH4 четыре связи C–H устроены четырёхгранным образом вокруг углеродистого атома. У каждой связи есть полярность (хотя не очень сильный). Однако, связи устроены симметрично, таким образом, в молекуле нет никакого полного диполя.
- Пример 4. Бор trifluoride, BF3, у молекулы есть треугольное плоское расположение трех полярных связей в 120o, Это не приводит ни к какому полному диполю в молекуле.
- Пример 5. Кислород, O2, у молекулы нет полярности в ковалентной связи из-за равного electronegativity, следовательно в молекуле нет никакой полярности.
13. Донорно-акцепторный механизм (иначе координационный механизм) — способ образования ковалентной химической связи между двумя атомами или группой атомов, осуществляемый за счет неподеленной пары электронов атома-донора и свободной орбитали атома-акцептора. Донорами обычно выступают атомы азота, кислорода, фосфора, серы и др., имеющие неподелённые электронные пары на валентных орбиталях малого размера. Роль акцептора могут выполнять ионизированный атом водорода H+, некоторые p-металлы (напр., алюминий при образовании иона AlH4-) и, в особенности, d-элементы, имеющие незаполненные энергетические ячейки в валентном электронном слое.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общаяэлектронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Рассмотрим способ образования на примере хлорида натрия NaCl. Электронную конфигурацию атомов натрия и хлора можно представить: 11 Na 1s2 2s2 2p 6 3s1; 17 Cl 1s2 2s2 2p6 Зs2 3р5. Это атомы с незавершенными энергетическими уровнями. Очевидно, для их завершения атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один электрон, чем отдать семь. При химическом взаимодействии атом натрия полностью отдает один электрон, а атом хлора принимает его. Схематично это можно записать так: Na. — l е —> Na+ ион натрия, устойчивая восьми электронная 1s2 2s2 2p6 оболочка за счет второго энергетического уровня. :Cl + 1е --> .Cl - ион хлора, устойчивая восьми электронная оболочка. Между ионами Na+ и Cl- возникают силы электростатического притяжения, в результате чего образуется соединение. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу. Образуются ионы.
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ, хим. связь, обусловленная взаимод. электронного газа (валентные электроны) в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная модель металлической связи отвечает образованию частично заполненных валентнымиэлектронами металла зон энергетич. уровней (см. Твердое тело), наз. зонами проводимости. При сближении атомов, образующих металл, атомные орбитали валентных электронов переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным p-орбиталям сопряженных соединений. Количественно описать металлическая связь можно только в рамках квантовой механики, качественно образование металлической связи можно понять исходя из представлений о ковалентной связи.
14. ВАн Дер Ваальс изучал силы межмолекулярного взаимодействия.
Существование веществ в разных сосстояниях говорит о том, что между частицами возникает взаимодействие. Силы межмолекулярного взаимодействия, возникающие без передачи электронов, называют вандерваальсовские. Они универсальны, так как взаимодействуют между всеми молекулами и атомами без исключения.
3 типа: Ориентационное, Индуктивное,дисперсионное.
ОРИЕНТАЦИОННОЕ (между диполями (+ -)(+ -)).
ИНДУКЦИОННОЕ (происходит за счет индуцированных диполей -> при встрече неполярной молекулы и диполя, последний вызывает поляпризацию неполярной молекулы, то есть индуцирует диполь, который в свою очередь вызывает еще большую поляризацию диполя ( ( )(+ -) -> (+ -)(+ -) ).
ДИСПЕРСИОННОЕ (универсально, обусловлено действием молекул друг с другом за счет образования мгновенных микродиполей, возникают вследствие движения электронов в атоме, Таким образом молекулу можно рассматривать как совокупность очень быстро меняющихся мгновенных микродиполей (Cl:Cl) ).
Вандерваальсовские силы слабее ковалентной связи.
15. Твердые вещества, как правило, имеют кристаллическое строение. Оно характеризуется правильным расположением частиц в строго определенных точках пространства. При мысленном соединении этих точек пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решеткой.
Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах воображаемой решетки могут находиться ионы, атомы или молекулы. Они совершают колебательные движения. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении тел.
В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором, как уже отмечалось, каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Такому расположению соответствует наиболее плотная упаковка, если ионы представить в виде шаров, размещенных в кристалле . Очень часто кристаллические решетки изображают, как показано на рис  , где указывается только взаимное расположение частиц, но не их размеры.
, где указывается только взаимное расположение частиц, но не их размеры.
Число ближайших соседних частиц, вплотную примыкающих к данной частице в кристалле или в отдельной молекуле, называется координационным числом.
В решетке хлорида натрия координационные числа обоих ионов равны 6. Итак, в кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.
Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными. Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером может служить алмаз - одна из модификаций углерода. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Координационное число углерода в алмазе 4  . В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
. В решетке алмаза, как и в решетке хлорида натрия, молекулы отсутствуют. Весь кристалл следует рассматривать как гигантскую молекулу. Атомная кристаллическая решетка характерна для твердого бора, кремния, германия и соединений некоторых элементов с углеродом и кремнием.
Кристаллические решетки, состоящие из молекул (полярных и неполярных), называются молекулярными.
Молекулы в таких решетках соединены между собой сравнительно слабыми межмолекулярными силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления, нерастворимы или малорастворимы в воде, их растворы почти не проводят электрический ток. Число неорганических веществ с молекулярной решеткой невелико.
Примерами их являются лед, твердый оксид углерода (IV) ("сухой лед"), твердые галогеноводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Сl2, Br2, I2, Н2, О2, N2), трех- (О3), четырех- (Р4), восьми- (S8) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рис .  Большинство кристаллических органических соединений имеют молекулярную решетку.
Большинство кристаллических органических соединений имеют молекулярную решетку.
16. Энтальпи́я, также тепловая функция и теплосодержание — термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. H = U + PV
Энтропи́я — в естественных науках мера беспорядка системы, состоящей из многих элементов. В частности, в статистической физике — мера вероятности осуществления какого-либо макроскопического состояния; в теории информации — мера неопределённости какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации; в исторической науке, для экспликации феномена альтернативности истории (инвариантности и вариативности исторического процесса).  ,
,
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита (CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому я рекомендую решать задачи с пропорциями через количество вещества.
17. Закон Гесса —Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. 

Следствия из закона Гесса: 1.Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (закон Лавуазье — Лапласа).
2.Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν): 
3.Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν): 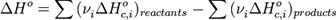
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
4.Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
18. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:  где
где  — внутренняя энергия,
— внутренняя энергия,  — давление,
— давление,  — объём,
— объём,  — абсолютная температура,
— абсолютная температура,  — энтропия.
— энтропия.
Итак имеем два критерия возможности самопроизвольного протекания химического процесса - изменение энтальпии DН, которое отражает взаимодействие атомов, образование химических связей, т.е. определенное упорядочение системы и изменение энтропии DS, которое отражает противоположную тенденцию к беспорядочному расположению частиц. Если DS=0, то движущей силой процесса будет стремление системы к минимуму внутренней энергии, т.е. критерий процесса - уменьшение энтальпии или DН<0.Если DН=0, то критерий самопроизвольного протекания процесса DS>0.Чтобы иметь возможность количественно сопоставить эти два критерия, нужно, чтобы они выражались в одинаковых единицах. (DН- кДж, DS- Дж/K). Очевидно, чтобы выразить энтропийный фактор в единицах энергии, его нужно домножить на температуру. Это тем более логично, что повышение Т способствует увеличению беспорядка в системе. Тогда ТDS - энтропийный фактор процесса, DН - энтальпийный. В состоянии равновесия оба эти фактора должны быть равны
DН = ТDS (1)
19. Скорость химических реакций - это число элементарных актов химических превращений, приводящих к образованию продуктов реакции, в единицу времени в единице объема или на единице поверхности.
В любой реакции реагенты расходуются, она замедляется. Поэтому можно говорить только о скорости в данный момент времени. Очевидно, что скорость зависит от концентрации реагирующих веществ.
Закон действующих масс - скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В ® продукты реакции этот закон выражается уравнением:v = k cA cB,где v - скорость реакции; cA и cB - концентрации веществ А и В, моль/л;
k - коэффициент пропорциональности, называемый константой скорости реакции.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении.Физический смысл константы скорости реакции k следует из уравнения закона действующих масс: k численно равна скорости реакции при концентрации каждого из реагирующих веществ равной 1 моль/л.Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.
20. Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило: При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:  где
где  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — скорость реакции при температуре
— скорость реакции при температуре  ,
,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
21. Энергия активации — минимальное количество энергии, которое требуется сообщить системе (в химии выражается в джоуляхна моль), чтобы произошла реакция.
Уравнение Аррениуса устанавливает связь между энергией активации и скоростью протекания реакции:
 k — константа скорости реакции,
k — константа скорости реакции,  — фактор частоты для реакции,
— фактор частоты для реакции, 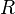 — универсальная газовая постоянная,
— универсальная газовая постоянная,  — температура в кельвинах.
— температура в кельвинах.
С повышением температуры растёт вероятность преодоления энергетического барьера.
Гомогенный катализ Примером гомогенного катализа является разложение пероксида водорода в присутствии ионов йода. Реакция протекает в две стадии: H2О2 + I → H2О + IO H2О2 + IO → H2О + О2 + I
При гомогенном катализе действие катализатора связано с тем, что он вступает во взаимодействие с реагирующими веществами с образованием промежуточных соединений, это приводит к снижению энергии активации.
Гетерогенный катализ При гетерогенном катализе ускорение процесса обычно происходит на поверхности твердого тела — катализатора, поэтому активность катализатора зависит от величины и свойств его поверхности. На практике катализатор обычно наносят на твердый пористый носитель.
Механизм гетерогенного катализа сложнее, чем у гомогенного. Механизм гетерогенного катализа включает пять стадий, причем все они обратимы.
1. Диффузия реагирующих веществ к поверхности твердого вещества
2. Физическая адсорбция на активных центрах поверхности твердого вещества реагирующих молекул и затем хемосорбция их
3. Химическая реакция между реагирующими молекулами
4. Десорбция продуктов с поверхности катализатора
5. Диффузия продукта с поверхности катализатора в общий поток
Примером гетерогенного катализа является окисление SO2 в SO3 на катализаторе V2O5 при производстве серной кислоты (контактный метод).
22. Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Факторы, влияющие на химическое равновесие:
1) При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции. CaCO3=CaO+CO2 -Q t↑ →, t↓ ← N2+3H2↔2NH3 +Q t↑ ←, t↓ →
2) При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
CaCO3=CaO+CO2 P↑ ←, P↓ → 1моль=1моль+1моль
3) При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ. S2+2O2=2SO2 [S],[O]↑ →, [SO2]↑ ←
Катализаторы не влияют на смещение химического равновесия!
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии  = 0,1013 МПа или 1 атм) может быть рассчитана по выражению:
= 0,1013 МПа или 1 атм) может быть рассчитана по выражению:  где
где  — относительные парциальные давления компонентов,
— относительные парциальные давления компонентов, 
Для обратимой химической реакции константа равновесия может быть выражена через константы скорости прямых и обратных реакций, исходя из того факта, что в состоянии равновесия скорости прямой и обратной реакций равны. Например, для элементарной обратимой химической реакции первого порядка  легко показать[2], что:
легко показать[2], что:  где k1 — константа скорости прямой реакции, а k2 — обратной.
где k1 — константа скорости прямой реакции, а k2 — обратной.
23. Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры.
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
24. Растворами называют гомогенные однородные системы, состоящие из двух и более компонентов, состав которых можно изменять в определенных пределах без нарушения однородности. Различают растворы истинные и коллоидные . При образовании истинных растворов соединения распадаются на частицы размером 
 см, т. е. растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Коллоидные растворы относятся к дисперсным системам - гетерогенным системам, в которых частицы одного вещества равномерно распределены в другом. Размер частиц в дисперсных системах лежит в пределах от
см, т. е. растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Коллоидные растворы относятся к дисперсным системам - гетерогенным системам, в которых частицы одного вещества равномерно распределены в другом. Размер частиц в дисперсных системах лежит в пределах от  см до
см до  см.
см.
Растворы бывают газообразными (газовые смеси), жидкими и твердыми. Газообразным раствором является, например, воздух. Морская вода - наиболее распространенный жидкий раствор различных солей и газов в воде. К твердым растворам относятся многие металлические сплавы. Наибольшее практическое значение имеют жидкие растворы. В этих растворах обычно протекает большинство реакций, так как в них создаются весьма благоприятные условия для перемещения молекул и тесного их сближения, необходимого для химического взаимодействия.
Растворы состоят из растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другими - газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент, которого больше
Дата добавления: 2015-04-18; просмотров: 311; Мы поможем в написании вашей работы!; Нарушение авторских прав |