
КАТЕГОРИИ:
АстрономияБиологияГеографияДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРиторикаСоциологияСпортСтроительствоТехнологияФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
ПАТОГЕНЕЗ ЛУЧЕВЫХ ПОВРЕЖДЕНИЙ 8 страница
XVIII в. - рак кожи мошонки у трубочистов в Англии - продукты перегонки каменного угля (сажа).
Ямагива и Ичикава (1914-1916 гг.) - смазывали уши кролика каменноугольной смолой - возник плоскоклеточный ороговевающий рак кожи уха кролика.
Выделены чистые канцерогены (более 1000, 60-70 истинных канцерогенов).
Химические канцерогены:
1. Экзогенные:
1. Полициклические ароматические углеводы (ПАУ): фенантрен, бензпирен, бензидин; 3-4 бензпирен - индикатор канцерогенности; анилин и анилиновые красители: азосоединения; нитрозамины и нитрозамиды - образуются в организме при употреблении в пищу продуктов с нитратами:
нитраты ---------------------------------------------------и нитраты
нитратдедуктаза
амины амиды
нитрозамины ----------------------------------- нитрозамиды
канцерогенез
Специфичность канцерогенов относительна:
уретан - рак легкого
b-нафталамин - опухоль мочевого пузыря при любом пути введения.
Факторы, определяющие канцерогенность химического соединения:
1. Химическая структура соединения.
2. Путь метаболических превращений вещества, попавшего в организм
b-нафталамин и 2-амино-1-нафтол и опухоль
Проканцерогены - вещества, попадая в организм превращаются в канцерогены.
3. Доза вещества.
Опухоль возникает через длительный латентный период (1/7 - 1/3 продолжительность жизни, 12-18 лет для человека).
Синканцерогенез - усиление эффекта канцерогенеза под влиянием неканцерогенных веществ: кротоновое масло (коканцероген)
Трансплацентарный канцерогенез - через плаценту канцерогены проникают от матери к плоду по 2-й половине беременности и вызывают опухоли уже во взрослом состоянии (если в 1-й половине беременности - преждевременные роды, уродство плода).
Пути появления экзогенных канцерогенов:
1. Химическое производство, металлургические предприятия
2. Использование нитратов, пестицидов в сельском хозяйстве
3. Выхлопные газы транспорта (от 60 до 80 канцерогенов)
Строение большинства канцерогенов близко к строению стероидных гормонов.
2. Эндогенные канцерогены
метилхолантрен - из дезоксихолевой кислоты
Шабад - бензольный экстракт из рака желудка человека вызывал опухоль у мышей.
В животном организме образуются канцерогенные вещества:
- продукты расщепления холестерина (холестеридины), продукты расщепления триптофана, тирозина.
ФИЗИЧЕСКИЕ КАНЦЕРОГЕНЫ
Чахотка горнорабочих Шнейберга - рак легких (радиоактивные изотопы в Саксонских рудах).
Рак рентгенолога - проверили кистью жесткость лучей.
Торотраст (содержит радиоактивный Th) 0 контрастное вещество и злокачественные опухоли.
R-лучи, -лучи; Уф лучи.
БИОЛОГИЧЕСКИЕ ФАКТОРЫ КАНЦЕРОГЕНЕЗА
Мечников, Роуз - предполагали, что причина опухолей - вирусы.
перевивка бесклеточного фильтрата лейкозной ткани вызывала лейкоз (Боурейм).
Перевивка фильтрата саркомы кур
Онкогенные вирусы передаются вертикально от родителей детям (не исключен и горизонтальный путь).
Лимфома Беркитта - 4 узла на челюсти (симметричные) - это уже метастазы опухоли.
Рак шейки матки - вирус герпеса.
Онкогенные вирусы:
1. РНК-содержащие (Oncornaviridae): лейкозосаркоматозный комплекс обезьян, мышей, крыс...
2. ДНК-содержащие:
группа Papovaviridae
группа вирусов оспы
аденовирусы
группа вирусов герпеса
Патогенез опухолей один - опухоли монопатогенетичны.
Экспериментальное воспроизведение опухолей:
1. Перевивка (трансплантация) опухолей:
Новинский в 1876 г. впервые пересадил опухоль от собаки
Правила перевивки опухолей:
очень малый разрез
очень малый кусочек опухоли
тщательное соблюдение асептики и антисептики
молодое животное
живая ткань
перевивка животному того вида.
аутотрансплантация
гомо(алло)трансплантация
гетеро(ксено)трансплантация
2. Индуцирование опухолей.
3. Эксплантация - культивирование опухолевых клеток вне организма
1907 г. Харрисон - в течение 2 нед эмбрион клетки лягушки культивировал.
1911 г. Каррель - питательная Среда.
1950 г. - ткань опухоли человека рака шейки матки культивируется до сих пор (культура НеLa)
80.Значение наследственности, возраста, пола, особенностей питания, вредных привычек в возникновении и развитии опухолей.
1. Возраст: чем старше организм, тем более вероятность развития опухоли.
2. Пол: мужчины - рак желудка, легкого; женщины - рак молочной железы, матки.
3. Питание:
объем пищи - избыток питания повышает риск заболеть
характер пищи - недостаток витаминов, белка; избыток жира - рак прямой кишки; копченые, консервированные - рак пищевода.
индолы в капсуле; кумарины в других овощах - противоопухолевые факторы в овощах и фруктах.
Роль наследственности в развитии опухолей:
Большая наследственная предрасположенность:
Ретинобластома сетчатки
саркома сосудистой оболочки глаза
пигментная ксеродерма
нейрофиброматоз
полипоз толстого кишечнике
Вредные привычки и рак:
1. Курение: в 20 раз чаще рак легкого; рак языка, глотки, пищевода, кишечника, 30 - 40% опухолей связаны с курением.
2. Алкоголь.
3. Загар - увеличение рака кожи у мужчин на 20%, у женщин - на 50% за последние годы.
4. Жевание бетеля.
81.Основные биологические особенности опухолей. Метастазирование опухолей механизмы, стадии. Понятие об опухолевой прогрессии.
Биологические особенности злокачественных новообразований:
1. Относительная автономность и нерегулируемость роста (рост не подчиняется регуляторным механизмам).
- отсутствуют лимит клеточного деления Хейблига
- ослаблены межклеточные контакты
- понижены механизмы контактного торможения
- расстройство рецепторной поверхности клеток
- нарушены синтез и чувствительность к кейлонам (вырабатываются зрелыми клетками и подавляют размножение опухолевых клеток).
- нарушена работа аденилатциклазы системы
2. Упрощение структурно-химической организации клеток (анаплазия):
- морфологическая анаплазия
- биохимическая
- энергетическая
- функциональная
- иммунологическая
а) морфологическая
тканевая - соотношение стромы и паренхимы нарушены
клеточная - разные размеры, форма клеток, миграция ядрышка, нарушение структуры поверхности клеток.
б) биохимическая анаплазия:
набор изоферментов уменьшен
активность ферментов снижена
изоферментное упрощение (монотонизация)
в) энергетическая анаплазия
энергия за счет гликолиза как анаэробного, так и аэробного
Превалируют синтетические процессы - снижение белка за счет продуктов разрушения клеток.
Нарушение соотношения гистонов и негистоновых белков.
Много ферментов синтеза РНК на денатурированной матрице ДНК.
г) функциональная анаплазия
Функция либо понижена, либо повышена.
Гипо- ли гипертиреоз - пример.
д) иммунологическая анаплазия:
органоспецифические антигены
межорганные антигены
1. Антигенное упрощение - резко уменьшено количество органоспецифических антигенов (нем. Вейлер).
2. Антигенная дивергенция - синтез.
В опухолевых клетках гетерогенных антигенов (другого органа; Вейлер и Оленов).
3. Антигенная реверсия - синтез в опухолевых клетках эмбриональных антигенов (Абеленов и Татаринов - в гепатоме найден a-феропротеин; эмбриональный преальбумин в гепатоме мыши).
3. Наследуемость изменений - раковая клетка при размножении дает себе подобные.
4. Способность к метастазированию - образование вдали от первичного опухолевого узла вторичного опухолевого зачатка.
Этапы метастазирования:
1. Отрыв опухолевых клеток от тканей опухоли
2. Транспортировка клеток по кровеносному или лимфатическому руслу, Лишь 9-11? переходит в 3 стадию.
3. Фиксация клетки к стенке сосуда. Если вызвать повреждение стенки сосуда, то фиксируется 85-90% клеток (атеросклеротическое; дистрофическое поражение стенки сосуда).
Дремлющие клетки не проявляют своей активности до воздействия определенных агентов.
4. Пролиферация при действии факторов:
гормональные нарушения
нейродистрофические изменения
хирургические вмешательства
5. Способность к инвазивному и деструктивному росту.
6. Прогрессия опухоли (Фулис) - способность опухоли в процессе ее эволюции менять биологические свойства. Опухоль становится все более и более злокачественной.(повыш. изменчивось генотипа опух. кл., постоянно изменяется генотип опух.кл., возрастание степени приспособл.кл.опухоли, повыш. резистентности кл.опухоли)
7. Системное действие опухоли на организм.
Эпидемиология опухолей:
Самая высокая заболеваемость раком:
среди мужчин - Австрия
среди женщин - Чили
СССР - самая высокая заболеваемость раком в республиках Прибалтики; самая низкая - Ср. Азия.
82. Виды и основные проявления атипизма опухолевых клеток.
Упрощение структурно-химической организации клеток (анаплазия):
- морфологическая анаплазия
- биохимическая
- энергетическая
- функциональная
- иммунологическая
а) морфологическая
тканевая - соотношение стромы и паренхимы нарушены
клеточная - разные размеры, форма клеток, миграция ядрышка, нарушение структуры поверхности клеток.
б) биохимическая анаплазия:
набор изоферментов уменьшен
активность ферментов снижена
изоферментное упрощение (монотонизация)
в) энергетическая анаплазия
энергия за счет гликолиза как анаэробного, так и аэробного
Превалируют синтетические процессы - снижение белка за счет продуктов разрушения клеток.
Нарушение соотношения гистонов и негистоновых белков.
Много ферментов синтеза РНК на денатурированной матрице ДНК.
г) функциональная анаплазия
Функция либо понижена, либо повышена.
Гипо- ли гипертиреоз - пример.
д) иммунологическая анаплазия:
органоспецифические антигены
межорганные антигены
1. Антигенное упрощение - резко уменьшено количество органоспецифических антигенов (нем. Вейлер).
2. Антигенная дивергенция - синтез.
В опухолевых клетках гетерогенных антигенов (другого органа; Вейлер и Оленов).
3. Антигенная реверсия - синтез в опухолевых клетках эмбриональных антигенов (Абеленов и Татаринов - в гепатоме найден a-феропротеин; эмбриональный преальбумин в гепатоме мыши).
3. Наследуемость изменений - раковая клетка при размножении дает себе подобные.
4. Способность к метастазированию - образование вдали от первичного опухолевого узла вторичного опухолевого зачатка.
83. Патогенез опухолей. Современные представления о молекулярно-генетических механизмах неопластической трансформации. Современная трактовка концепции онкогена. Роль мутаций, вирусов и эпигеномных нарушений в механизмах превращения протоонкогена в онкоген.
Молекулярно-генетические механизмы опухолевой трансформации клетки
Современная концепция канцерогенеза получила название концепции онкогена. Основополагающие положения ее были сформулированы еще в 1981-1985 гг. Этому предшествовали сложные поиски ведущего патогенетического звена в механизме опухолевой трансформации клетки. Все исследователи второй половины 20-го столетия считали, что данный процесс осуществляется на молекулярно-генетическом уровне, но суть его трактовали по-разному.
Мутационная концепция канцерогенеза
Нормальная клетка превращается в опухолевую в результате структурных изменений в генетическом материале, т.е. мутаций. В этом заключается суть мутационной концепции. Различают три ее варианта. Первый вариант концепции (Т. Bovery, 1914) касается хромосомных аббераций и геномных мутаций, затрагивающих значительную часть генома. Второй вариант (Н.Н. Петров, К.Н. Bayer, 1924) учитывает еще и точечные или генные мутации. Третий вариант касается возможности участия в канцерогенезе мутации регуляторных генов.
О возможной роли мутационных механизмов в канцерогенезе свидетельствуют следующие факты:
Мутагенность подавляющей части (90 %) известных канцерогенов и канцерогенность большинства (у 85-87 % исследованных образцов) мутагенов.
Обнаружение в клетках ряда опухолей человека и животных так называемых маркерных хромосом (например, филадельфийской хромосомы примиелоцитарном лейкозе человека).
Резкое увеличение заболеваемости лейкозом и опухолевой болезнью людей с различного рода генетическими дефектами (при болезни Дауна, синдромах Клайнфельтера, Шерешевского-Тернера и др).
Эпигеномная концепция канцерогенеза
Согласно этой концепции (Ю.М. Оленов, А.Ю. Броновицкий, B.C. Ша-пот), в основе превращения нормальной клетки в злокачественную лежат стойкие нарушения регуляции генной активности, а не изменения структуры генетического материала. Под влиянием химических и физических канцерогенов, а также онкогенных вирусов происходит сдвиг в строго специфичной для каждой ткани регуляции генной активности: дерепрессируются группы генов, которые в данной ткани должны быть зарепрессированы и (или) блокируются активные гены. В результате клетка в значительной мере утрачивает присущую ей специфику, становится нечувствительной или малочувствительной к регуляторным влияниям целостного организма, неуправляемой.
С точки зрения эпигеномной концепции канцерогенеза можно объяснить ряд особенностей неоплазмы: изоферментное упрощение, антигенную реверсию, выработку некоторыми опухолями гормонов, не присущих клеткам гомологичной ткани и др.
Вирусо-генетическая концепция канцерогенеза
Данную концепцию предложил Л.А. Зильбер (1948). Она заключается в следующем. Опухолевая трансформация клетки происходит в результате привнесения в ее генетический материал новой генетической информации онкогенными вирусами. Главным свойством последних является их способность разрывать цепочку ДНК и объединяться с ее обрывками, т.е. с клеточным геномом. Проникнув в клетку, вирус, освободившись от белковой оболочки, под влиянием содержащихся в нем ферментов встраивает свою ДНК в генетический аппарат клетки. Привнесенная вирусом новая генетическая информация, меняя характер роста и «поведение» клетки, превращает ее в злокачественную. G. Temin (1963) открыл явление обратной транскрипций: списывание генетической информации возможно не только в одном направлении (ДНК-РНК-белок), но и в обратном (от РНК к ДНК). Обнаружение в РНК-содержащих вирусах фермента ревертазы, или обратной транскриптазы, обеспечивающего процесс обратной транскрипции, позволило понять механизм действия и РНК-вирусов. Они синтезируют ДНК-овую копию своей РНК, которая и встраивается затем в геном клетки. В процессе обратной транскрипции на концах ДНК-вой копии формируются одинаковые последовательности — большие терминальные повторы (LTR), играющие роль в трансформации нормальной клетки в опухолевую.
Современная концепция онкогена
Альтернативные точки зрения относительно природы неопластической трансформации в 70-е годы значительно сблизились, поскольку появились неопровержимые факты участия в канцерогенезе и мутационных, и эпигеномных, и вирусно-генетических механизмов, последовательно включающихся в процесс опухолевой трансформации. Стало аксиомой представление о многоэтапности процесса канцерогенеза, решающей предпосылкой которого является нерегулируемая экспрессия трансформирующего гена - онкогена, предсущест-вующего и геноме.
Впервые онкогены были обнаружены с помощью трансфекции («переноса генов») в вирусах, вызывающих опухоли у животных. Затем с помощью данного метода было установлено, что в организме животных и человека содерпотенциальные онкогены – протоонкогены, экспрессия которых и обуславливает трансформацию нормальной клетки в опухолевую.
Согласно современной концепции онкогена мишенью для изменений, обусловливающих начаяо опухолевого роста, являются протоонкогены, или потенциальные онкогены, существующие в геноме нормальных клеток и обеспечивающие yсловия для нормальной жизнедеятельности организма. В эмбриональный период они обеспечивают условия для интенсивного размножения клеток и нормального развития организма. В постэмбриональном периоде функциональная их активность в значительной степени снижается — большая часть их оказывается в репрессированном состоянии, а остальные обеспечивают лишь периодическое обновление клеток.
Механизмы превращения протоонкогена в онкоген
Превращение протоонкогена в активно действующий онкоген обеспечивается следующими механизмами.
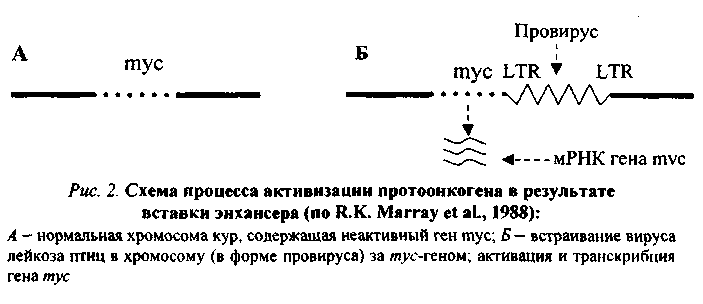
 1. Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.
1. Присоединение к протоонокгену промотора — участка ДНК, с которым связывается РНК-полимераза, инициирующая транскрипцию гена, в том числе и онкогена, располагающегося непосредственно за ним (рис.1). Такого рода участки (промоторы) содержатся в больших терминальных повторах (LTR) ДНК-копий РНК-содержащих вирусов. Роль промотора могут выполнять и транспозирующие элементы генома — мобильные генетические элементы, способные перемещаться по геному и встраиваться в различные его участки.
2. Вставка в геном клетки энхансера (enchancer — усилитель) — участка ДНК, способного активизировать работу структурного гена, находящегося не только в непосредственной близости от него, но и на расстоянии многих тысяч пар нуклеотидов или даже встроенного в хромосому после него. Свойствами усилителя обладают подвижные гены, LTR ДНК-копий. В случае, проиллюстрированном рис. 2, LTR провируса не может работать как промотор (см. рис. 1, Б) и выступает в роли энхансера, в результате чего ген туе активизируется и транскрибируется.
3. Хромосомные абберации с явлениями транслокации, роль которых в механизмах опухолевой трансформации клетки можно проиллюстрировать следующим примером.
 При лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.
При лимфоме Беркитта конец (q-плеча хромосомы 8, отделившись от нее, переходит к хромосоме 14: гомологичный фрагмент последней перемещается к хромосоме 8; а неактивный ген туе (протоонкоген), находившийся в том ее сегменте, который попадает на хромосому 14, встраивается вслед за активными генами, кодирующими тяжелые цепи молекул иммуноглобулинов, и активизируется (рис. 3, 4). Явления реципрокной транслокации между 9-й и 22-й хромосомами имеют место в 95 % случаев миелоцитарного лейкоза. Хромосома 22 с укороченным в результате такой транслокации одним плечом получила название Филадельфийской.
Точечные мутации протоонкогена, к примеру, C-H-raS, согласно имеющимся сведениям, отличается от нормального гена (C-H-raS) всего одной аминокислотой, но тем не менее обусловливает снижение гуанозинтрифосфатазной активности в клетке, что может вызвать рак мочевого пузыря у человека.
Амплификация (умножение) прогоонкогенов, обладающих в норме небольшой следовой активностью, обусловливает увеличение их общей актив ности до уровня, достаточного для инициации опухолевой трансформации. Известно, что в икринке шпорцевой лягушки около 5 млн копий гена туc. После оплодотворения и дальнейшего деления яйцеклетки число их прогрессирующе уменьшается. В каждой клетке будущего головастика в эмбриональный период развития содержится не более 20—50 копий тус-гена, обеспечивающих быстрое деление клеток и рост эмбриона. В клетках же взрослой лягушки выявляются лишь единичные гены туc, в то время как в раковых клетках той же лягушки число их вновь достигает 20-50.
6. Трансдукция неактивных клеточных генов (протоонкогенов) в геном ретровируса и последующее их возвращение в клетку: считается, что онкоген опухолеродного вируса клеточного происхождения; при инфицировании животных или человека таким вирусом «похищенный» им ген попадает в иной участок генома, что и обеспечивает активизацию некогда «молчавшего» гена.
84.Виды и функции клеточных онкогенов, роль онкобелков в нарушении функции трансформированных клеток. Понятие об антионкогенах.
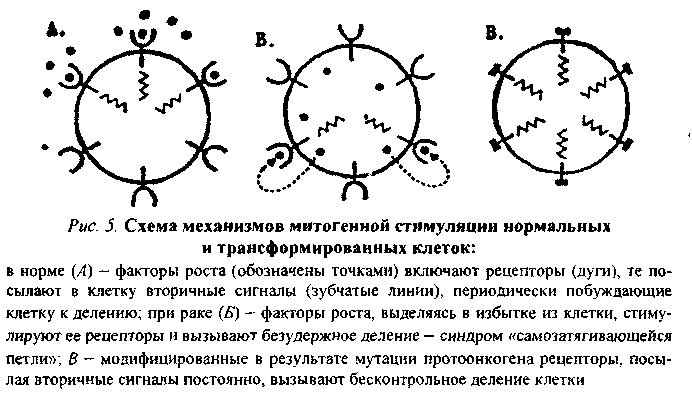
Продукты деятельности онкогенов — онкобелки в следовых количествах синтезируются и в нормальных клетках, функционируя в них как регуляторы чувствительности их рецепторов к факторам роста или как синергисты последних. Многие онкобелки гомологичны или родственны ростовым факторам: тромбоцитарному (ТФР), эпидермальному (ЭФР), инсулинподобному и др. Находясь под контролем регуляторных механизмов целостного организма, фактор роста, действуя прерывисто, обеспечивает процессы регенерации. Выйдя из-под контроля, он «работает» перманентно, вызывая безудержную пролиферацию и подготавливая почву для процесса малигнизации (теория «самозатягивающейся петли»). Так, добавление ТФР в культуру нормальных клеток, имеющих соответствующие рецепторы, может вызывать обратимые фенотипи-ческие изменения, сходные с трансформацией: круглые клетки превращаются в веретенообразные, растут многослоем. Большая часть онкобелков принадлежит к протеинкиназам. Известно, что рецепторы факторов роста на своей внутренней, погруженной в цитоплазму стороне несут каталитическую часть протеин-киназы или гуанилат-циклазы.
Механизмы действия онкогенов и их продуктов — онкобелков можно подразделить на три основные категории (рис. 5).
Онкобелки могут имитировать действие факторов роста, оказывая влияние на синтезирующие их клетки по аутокринному пути (синдром «самозатягивающейся петли»; рис. 5, Б).
Онкобелки могут модифицировать рецепторы факторов роста, имитируя ситуацию, характерную для взаимодействия рецептора с соответствующим фактором роста, без его действия (рис. 5, В).
Продукты онкогенов могут действовать на ключевые внутриклеточные процессы, участвующие в контроле роста клеток без внешней их стимуляции. Так, продукт гена sre, являющийся тирозинпротеинкиназой, может воздействовать на митотическую активность клетки и тем самым влиять на фосфори лирование ключевых регуляторных белков. Аналогичный эффект возможен при действии продукта гена ras, стимулирующего (опосредованно) активность аденилатциклазы.
 Многоэтапность процесса онкогенеза
Многоэтапность процесса онкогенеза
В становлении неопластического фенотипа принимает участие не один онкоген а последовательно включающиеся в данный процесс несколько (по меньшей мере два) онкогена. Этот феномен лежит в основе еще одного явления характерного для канцерогенеза, — многоэтапное™, многоступенчатости процесса, причем два этапа решающие. На первом этапе происходит им-мортелизация популяции клеток, т.е. процесс, формирующий их способность беспредельно размножаться. В нем принимают участие ядерные онкогены, он-кобелки которых поступают в ядро. На втором этапе совершается процесс, меняющий характер роста клетки, определяющий ее агрессивность. К этому причастны в основном мембранные онкогены, онкобелки которых накапливаются в мембранах. Предполагается, что непрерывное деление клеток — функция ядра, а агрессивный (инфильтрирующий) их рост— функция мембран.
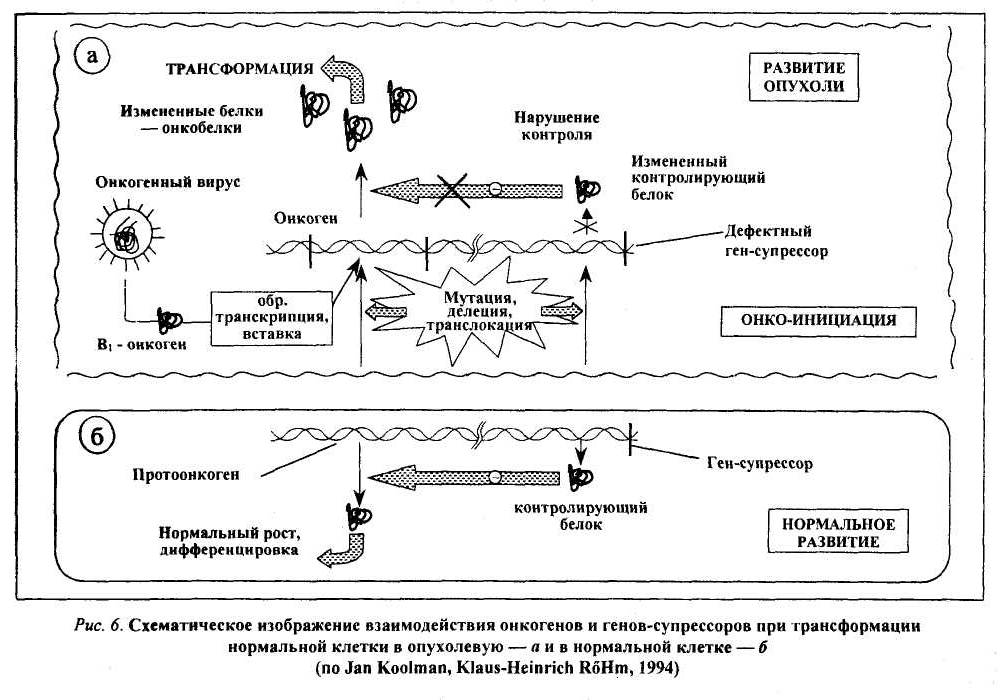 Антионкогены и их роль в онкогенезе
Антионкогены и их роль в онкогенезе
В геноме клетки имеется и второй класс опухолеродных генов — гены-супрессоры (антионкогены). В отличие от онкогенов, они контролируют синтез не стимуляторов роста, а его ингибиторов (подавляют активность онкогена и соответственно — размножение клеток; стимулируют их дифференцировку). Нарушение баланса процессов синтеза стимуляторов и ингибиторов роста и лежит в основе трансформации клетки в опухолевую (рис. 6). Впервые ген-супрессор был обнаружен в 1985 году при исследовании ретинобластомы — злокачественной опухоли сетчатки глаза у детей. Выяснилось, что в клетках опухоли ген, локализующийся в нормальных клетках в длинном плече 13-й хромосомы, отсутствует или в результате мутации утратил функциональную активность. Кодируемый этим геном (РБ) белок (р 100) регулирует активность генов (в частности, онкогенов), вызывающих опухолевую трансформацию клеток сетчатки глаза. С помощью методов генной инженерии он был выделен и перенесен в безудержно размножающиеся клетки культуры ретинобластомы. Раковые клетки, получив отсутствующий ген, стали вырабатывать белок р100, который блокировал действие онкогена. В результате опухолевые клетки превратились в нормальные, жили положенный им срок, старели и погибали. В последующем было установлено, что РБ-ген отсутствует в 40 % случаях рака мочевого пузыря, почти во всех случаях рака легких, молочной железы, саркомы костей. При других формах злокачественных новообразований отсутствуют другие гены (возможно, супрессоры) различных хромосом.
85. Взаимосвязь нарушений функций нервной и эндокринной систем с возникновением и развитием опухолей. Гормонально-зависимые опухоли.
Патогенез опухолевого роста не ограничивается механизмами опухолевой трансформации клетки. Появление опухолевой клетки - лишь начальный этап онкогенеза. Дальнейшая судьба такой клетки во многом зависит от регуляторных систем организма (нервной, эндокринной, иммунной), состояние которых во многом определяет как сам факт возникновения опухоли, так и характер течения опухолевой болезни.
Нервная система и развитие опухоли
О важной роли в онкогенезе состояния нервной системы организма убедительно свидетельствуют экспериментальные и клинические данные. Так, у собак с экспериментальным неврозом значительно выше процент самопроизвольно возникающих опухолей. У них легче вызвать химический канцерогенез. Введение экспериментальным животным средств, угнетающих ЦНС, облегчает, а возбуждающих - затрудняет перевивку и индуцирование опухоли. Перевивку и индуцирование опухолей намного легче осуществить у животных со слабым типом высшей нервной деятельности, чем у животных с сильным уравновешенным подвижным типом ее. Локализация очагов опухоли может определяться нарушением иннервации органа: узлы опухоли развиваются после введения опухолевых клеток в кровь кролика на фоне денервации селезенки — в селезенке; после денервации почки - в почке; после денервации желудка — в желудке. Из этого следует, что повреждение периферических образований нервной системы может иметь определенное значение в усилении метастазирования, которое иногда происходит после хирургических вмешательств.
Анализ клинических наблюдений позволяет считать, что хронические стрессовые ситуации, длительная депрессия являются предрасполагающими факторами, заметно увеличивающими риск развития рака при прочих равных условиях.
Развивающаяся опухоль в свою очередь оказывает влияние на неврологический статус организма: вначале у больного преобладает возбуждение, затем на заключительном этапе болезни нарастает угнетение.
Эндокринная система и развитие опухоли
По степени участия эндокринных факторов в онкогенезе различают дисгармональные опухоли, в происхождении которых решающую роль играет нарушение гормонального фона организма, и опухоли неэндокринного происхождения, в возникновении и развитии которых нарушения гормонального фона организма играют дополнительную, хотя иногда и весьма существенную роль.
Из дисгормональных опухолей человека и животных наиболее часто встречаются опухоли молочной железы, матки, предстательной железы. Ведущая роль в развитии опухоли (в том числе рака) грудной железы, матки принадлежит гиперэстрогенизации организма. В основе канцерогенного действия эстрогенов лежит их физиологическая способность стимулировать процесс пролиферации в указанных органах. Такое же действие оказывает фоликулостимулирующий гормон гипофиза. Он не только стимулирует процесс продуцирования эстрогенов, но и сам активизирует процессы пролиферации в матке и грудных железах.
Антитиреоидная терапия по поводу хирургического вмешательства в связи с развивающейся опухолью благоприятствует рецидивам и метастазирова-нию последней. Назначение онкологическим больным тиреоидных гормонов в послеоперационный период способствует более благоприятному исходу лечения. Тиреоидные гормоны, как и эстрогены, усиливают клеточную пролиферацию, однако они, в отличие от последних, способствуют дифференцировке клеток и повышают неспёцифическую резистентность организма, его защитные силы.
Длительная стимуляция клеточной пролиферации, развивающаяся по принципу обратной связи в той или иной железе внутренней секреции при понижении ее функции, иногда способствует развитию опухолевого роста в самих эндокринных железах, как в гиперплазированной периферической железе, так и в железе-хозяйке — гипофизе. Следовательно, способность некоторых гормонов стимулировать клеточную пролиферацию может при определенных условиях иметь отрицательное для организма значение.
Растущая опухоль в свою очередь часто меняет гормональный фон организма. Так, при опухолях эндокринных желез возможны и угнетение, и активизация процесса выработки гормонов, а также эктопический синтез их (паранеоэндокринный синдром). К примеру, раковая опухоль щитовидной железы нередко синтезирует адренокортикотропный гормон гипофиза (АКТГ), хорион-эпителиома — тиреотропный гормон и антидиуретический гормон гипофиза (ТТГ и АДГ). Опухоли, исходящие из островкового аппарата поджелудочной железы, могут синтезировать до 7 различных гормонов. В ряде опухолей неэндокринных органов синтезируются гормоноподобные вещества. Например, некоторые формы бронхогенного рака нередко синтезируют вещества, подобные АКТГ, АДГ и т.д. Такого рода явления называются паранеоэндокринным синдромом (одна из разновидностей паранеопластического синдрома). Последний представляет собой совокупность клинических симптомов, проявляющихся в результате действия специфических и неспецифических продуктов обмена опухоли на организм, исчезающих при ее удалении и возобновляющихся при рецидиве и метастазировании опухоли. Паранеопластический синдром может проявляться в виде нейротрофических, аутоиммунных и эндокринных изменений.
Дата добавления: 2015-04-21; просмотров: 215; Мы поможем в написании вашей работы!; Нарушение авторских прав |